Класс IB
Препараты класса IB умеренно эффективны для лечения желудочковых аритмий. Их существенное преимущество перед остальными препаратами I класса состоит в том, что они имеют низкий проаритмический потенциал.
Как видно из рис. 3.2, препараты класса IB оказывают относительно малое воздействие на быстрые натриевые каналы при нормальных частотах сердечного ритма и при терапевтических сывороточных концентрациях, а значит, и на скорость проведения. Их основной электрофизиологический эффект состоит в уменьшении продолжительности потенциала действия, а значит, и в укорочении рефрактерных периодов. Возможно, по причине того, что длительность потенциала действия в предсердной ткани короче, чем в желудочковой, препараты класса IB влияют на предсердия незначительно (поэтому полезны только для лечения желудочковых аритмий). В табл. 3.3 и 3.4 суммированы главные клинические характеристики и электрофизиологические свойства антиарит- мических препаратов класса IB.
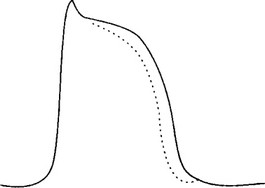
Рис. 3.2. Эффект препаратов класса IB на сердечный потенциал действия. Исходный потенциал действия изображен сплошной линией; пунктирная линия показывает действие препаратов класса IB
Клиническая фармакология препаратов класса IB
Таблица 3.3
ЖКТ — желудочно-кишечный тракт.
Лидокаин
Лидокаин используется в клинической практике с 1943 г. в качестве местного анестетика; с 1950-х гг. применяется для экстренного лечения желудочковых аритмий. До сегодняшнего дня лидокаин остается препаратом первого выбора при желудочковых аритмиях во многих острых ситуациях.
Клиническая фармакология
Хотя лидокаин хорошо всасывается в кишечнике, он в значительной степени подвергается метаболизму при первом прохождении через печень, поэтому препарат обычно назначают внутривенно. Очень небольшое его количество экскретируется
Таблица 3.4
Электрофизиологические эффекты препаратов класса IB
АВУ — атриовентрикулярным узел; РСД — ранние следовые деполяризации; ПСД — поздние следовые деполяризации; ФП — фибрилляция предсердий; ТП — трепетание предсердий; ЖЭС — желудочковая экстрасисто- лия; ЖГ — желудочковая тахикардия; ФЖ — фибрилляция желудочков.
почками даже после внутривенного применения. Лидокаин на 70 % связывается с белками плазмы. Кроме того, белки, связывающиеся с лидокаином, являются острофазовыми реактантами, то есть в стрессовых ситуациях, например при остром инфаркте миокарда, количество белков плазмы, связывающих лидокаин, возрастает, что может вызвать удлинение периода полувыведения с 1—2 до 4 ч, а это, в свою очередь, может привести к увеличению уровня лидокаина даже при постоянной скорости инфузии.
Дозировка
Лидокаин обычно быстро вводят внутривенно в нагрузочной дозе 1,5 мг/кг с последующей постоянной 1—4 мг/мин инфузией. При болюсном введении препарат быстро распределяется в органы-мишени (фаза 1 распределения), а в течение 20 мин распределяется по всему организму (фаза 2 распределения); начальная немедленная эффективность препарата снижается в течение фазы 2. Поэтому обычно используются 2 или 3 дополнительных болюса с 10-минутными интервалами после первого; доза дополнительных болюсов составляет, как правило, половину первоначального.
Электрофизиологические свойства
Как типичный представитель класса IB, лидокаин (в основном вследствие особенностей кинетики с быстрым связыванием) не вызывает замедления фазы деполяризации потенциала действия и скорости проведения в нормальной ткани. Однако при высоких частотах сердечного ритма, а также на фоне ишемии, гипокалиемии или ацидоза препарат может существенно замедлять деполяризацию и скорость проведения. Потенциал действия и рефрактерный период укорачиваются под действием лидокаина в желудочковой ткани, но не в предсердной. Лидокаин способен подавлять как нормальный, так и аномальный автоматизм, что порой приводит к асистолии при введении лидокаина на фоне желудочкового выскальзывающего ритма. Выявлено также свойство препарата подавлять ранние и поздние следовые деполяризации.
Гемодинамические эффекты
Действие лидокаина на гемодинамику весьма незначительное или отсутствует вовсе.
Терапевтическое применение
Лидокаин эффективен при желудочковых тахиаритмиях и обычно является препаратом выбора для экстренной терапии этих нарушений сердечного ритма, поскольку существует возможность быстрого достижения его терапевтического уровня в плазме. Ранее было показано, что лидокаин снижает частоту фибрилляции желудочков при остром инфаркте миокарда, но не уменьшает смертность.
Побочные реакции и взаимодействие с другими препаратами
В основном неблагоприятное воздействие препарата отражается на центральной нервной системе и представлено нечеткостью речи, головокружением, онемением и парестезией вокруг рта, обмороками и остановкой дыхания, что обычно связано с токсическим уровнем препарата в плазме.
На уровень лидокаина в плазме могут влиять пропрано- лол, метопролол и циметидин (но не ранитидин). Фенобарбитал снижает концентрацию лидокаина в плазме.
Лидокаин редко оказывает проаритмическое действие.
Мексилетин
Мексилетин — препарат для применения внутрь, родственный лидокаину. Одобрен Комитетом по использованию пищевых продуктов и лекарственных препаратов США (FDA) в 1986 г.
Клиническая фармакология
Мексилетин почти полностью абсорбируется в желудочно-кишечном тракте и в минимальной степени подвергается метаболизму при первом прохождении через печень. Пиковый уровень препарата в плазме наблюдается через 4—6 ч после приема; примерно 70 % мексилетина связывается с белками. Препарат в основном метаболизируется в печени, период по- лувыведения — 8—16 ч.
Дозировка
Вследствие вариабельности метаболизма и того факта, что терапевтические и токсические диапазоны доз мексилетина имеют тенденцию перекрывать друг друга, дозу препарата подбирают индивидуально. При отсутствии печеночной патологии препарат применяется в дозе 150 мг 3 раза в день. При отсутствии эффекта в течение нескольких (по крайней мере трех) дней и признаков токсического действия препарата дозу повышают до 200 мг 3 раза в день. При необходимости через 3 дня дозу можно увеличить еще, если не развивается интоксикация. Однако случаи, когда при назначении более 750 мг/день не наблюдаются серьезные побочные явления, очень редки.
Электрофизиологические свойства
Электрофизиологические свойства мексилетина фактически идентичны таковым у лидокаина.
Гемодинамические эффекты
Действие мексилетина на артериальное давление и сердечную функцию незначительно или отсутствует вовсе.
Терапевтическое применение
Терапевтический профиль мексилетина сходен с таковым у лидокаина, то есть препарат эффективно подавляет желудочковые аритмии. Однако, в отличие от лидокаина, мексилетин не пригоден для лечения острых аритмий, так как титрование дозы препарата может занять много дней (в связи с чем область применения мексилетина ограничена лечением хронических желудочковых аритмий). Препарат эффективен для подавления желудочковых экстрасистол и неустойчивой желудочковой тахикардии, однако эти нарушения сердечного ритма, как правило, не требуют лечения при отсутствии выраженной симптоматики. Как выяснилось на основе серийного тестирования препаратов в электрофизиологической лаборатории, мексилетин редко подавляет индуцируемую устойчивую желудочковую тахикардию; при этом препарат эффективен только у 5-10 % тестированных пациентов.
Побочные реакции и взаимодействие с другими препаратами
Как и лидокаин, мексилетин оказывает неблагоприятное воздействие преимущественно на центральную нервную систему, которое наиболее часто проявляется тремором, нечеткостью зрения и атаксией. Также при применении мексилетина наблюдаются желудочно-кишечные расстройства. Хотя препарат обычно не влияет на гемодинамику, есть данные о том, что у пациентов с тяжелой кардиомиопатией он вызывает прогрессирование сердечной недостаточности. Мексилетин также может вызвать тромбоцитопению.
Уровень препарата может снижаться под действием фе- нитоина, фенобарбитала, хлорамфеникола и изониазида. При сочетанном назначении с мексилетином не исключено выраженное повышение уровня теофиллина. Побочные эффекты мексилетина и лидокаина способны суммироваться.
Как типичный представитель класса IB антиаритмиче- ских препаратов, мексилетин редко оказывает проаритмиче- ское действие.
Токаинид
Токаинид — еще один аналог лидокаина для применения внутрь — по своим свойствам очень похож на мексилетин, за исключением того, что выводится из организма через печень и почки. Поскольку обнаружено, что токаинид вызывал у некоторых пациентов агранулоцитоз, он сейчас почти не используется в клинической практике, кроме чрезвычайно редких случаев, когда больной нуждается в хронической терапии, но не переносит другие препараты класса IB.
Фенитоин
Фенитоин используется в клинической практике в качестве антиконвульсанта с 1938 г. К началу 1950-х гг. были обнаружены его антиаритмические свойства. В 1960-х гг. препарат имел широкую популярность, однако его полностью вытеснили ли- докаин и новокаинамид. Фенитоин не был одобрен Комитетом по использованию пищевых продуктов и лекарственных препаратов США (FDA) для лечения нарушений сердечного ритма. В целом, фенитоин довольно редко назначают при аритмиях, хотя в отдельных случаях его полезность у таких пациентов несомненна.
Клиническая фармакология
Абсорбция фенитоина после приема внутрь относительно медленная и широко варьируется. Максимальный уровень препарата в плазме может наблюдаться через 3—12 ч после однократного приема. Фенитоин на 90 % связывается с белками и метаболизируется в печени до неактивных соединений. При более низких уровнях препарата в плазме (lt; 10 мг/л) кривая его элиминации имеет экспоненциальную форму. При более высоких уровнях выведение зависит от дозы, и уровень фенитоина в плазме растет в диспропорции к дозе. Средний период полувыведения препарата — 24 ч, но это значение очень вариабельно.
Дозировка
При применении фенитоина внутрь обычно рекомендуется нагрузочный режим, особенно если необходимо достичь терапевтического уровня в течение 24 ч. Как правило, в 1-й день назначают 15 мг/кг внутрь раздельными дозами, во 2-й — 7,5 мг/кг с последующим переходом на поддерживающую дозу 5 мг/кг (обычно 300—500 мг/день в 2 или 3 приема). Хроническую (поддерживающую) дозу не следует изменять чаще, чем один раз в 10—14 дней, поскольку скорость выведения препарата зависит от его дозы.
Фенитоин может также использоваться внутривенно, предпочтительно через центральную вену для предотвращения возможного развития тромбофлебита. Внутривенно препарат вводят со скоростью 50 мг/мин до общей дозы 7,5—10 мг/кг.
Отсутствие нистагма при взгляде вбок —- полезный индикатор терапевтического уровня препарата в сыворотке (10-20 мг/л).
Электрофизиологические свойства
Электрофизиологический профиль фенитоина аналогичен таковому у лидокаина. Действие фенитоина на быстрые натриевые каналы (с быстрым связыванием и освобождением) зависит от частоты сердечного ритма. Вследствие этого в нормальной ткани и при обычном сердечном ритме проведение изменяется минимально. В отличие от препаратов класса IB, фенитоин обладает опосредованным центральным антиадре- нергическим действием. Он подавляет отсроченную постдеполяризацию, которая наблюдается при дигиталисной интоксикации.
Гемодинамические эффекты
При быстром внутривенном введении нагрузочной дозы не исключена гипотензия, которая контролируется титрованием скорости введения препарата. При применении фенитоина внутрь гипотензии обычно не наблюдается. Препарат не оказывает отрицательного инотропного эффекта.
Терапевтическое применение
Фенитоин эффективен для лечения желудочковых тахиаритмий, вызванных дигиталисной интоксикацией, чаще всего из-за подавления поздних следовых деполяризаций. Кроме того, как препарат класса IB фенитоин иногда эффективен при интенсивной терапии, направленной на подавление желудочковых аритмий, обусловленных повышенным автоматизмом.
Побочные реакции и взаимодействие с другими препаратами
К наиболее частым побочным эффектам относятся желудочно-кишечные расстройства и осложнения со стороны центральной нервной системы. Симптоматика, вызванная воздействием на ЦНС (в основном атаксия и нистагм), зависит от уровня препарата в плазме. Редкие побочные эффекты включают остеомаляцию (из-за нарушения метаболизма витамина D), мегалобластическую анемию (вследствие нарушения метаболизма фолиевой кислоты) и реакции гиперчувствительности (волчаночный синдром, гепатонекроз, гематологические нарушения, псевдолимфома). Гиперплазия десен на фоне приема фенитоина наблюдается у 20 % детей и нечасто — у взрослых.
Обнаружено взаимодействие фенитоина с некоторыми препаратами. Применение фенитоина способствует увеличению уровней теофиллина, хинидина, дизопирамида, лидокаи- на и мексилетина в плазме. Концентрация фенитоина возрастает при его сочетанном приеме с циметидином, изониазидом, сульфаниламидами и амиодароном. Теофиллин может снижать уровень фенитоина в плазме.
Как и другие препараты класса IB, фенитоин редко вызывает проаритмию.
Как видно из рис. 3.2, препараты класса IB оказывают относительно малое воздействие на быстрые натриевые каналы при нормальных частотах сердечного ритма и при терапевтических сывороточных концентрациях, а значит, и на скорость проведения. Их основной электрофизиологический эффект состоит в уменьшении продолжительности потенциала действия, а значит, и в укорочении рефрактерных периодов. Возможно, по причине того, что длительность потенциала действия в предсердной ткани короче, чем в желудочковой, препараты класса IB влияют на предсердия незначительно (поэтому полезны только для лечения желудочковых аритмий). В табл. 3.3 и 3.4 суммированы главные клинические характеристики и электрофизиологические свойства антиарит- мических препаратов класса IB.

Рис. 3.2. Эффект препаратов класса IB на сердечный потенциал действия. Исходный потенциал действия изображен сплошной линией; пунктирная линия показывает действие препаратов класса IB
Клиническая фармакология препаратов класса IB
Таблица 3.3
|
|
Лидокаин |
. ..'.Ц ¦ — ¦ ¦ Мексилетин |
Фенитоин |
|
Всасывание в ЖКТ |
— |
gt;90% |
Вариабельное |
|
Связывание с белками |
70% |
70% |
90% |
|
Выведение |
Печень |
Печень |
Печень |
|
Период полувыве- дения |
1-4 ч |
8-16 ч |
24 ч |
|
Терапев тический уровень |
1,5-5 мг/л |
0,75-2 мг/л |
10-20 мг/л |
|
Дозировка |
1,5 мг/кг в/в, затем 1-4 мг/мин; повторить введение 1/2 дозы через 10 мин |
150-200 мг 3 раза в день |
Внутрь: 300-500 мг/день в несколько приемов; в/в: нагрузочная доза 7,5-10 мг/кг со скоростью 50 мг каждые 2 мин |
ЖКТ — желудочно-кишечный тракт.
Лидокаин
Лидокаин используется в клинической практике с 1943 г. в качестве местного анестетика; с 1950-х гг. применяется для экстренного лечения желудочковых аритмий. До сегодняшнего дня лидокаин остается препаратом первого выбора при желудочковых аритмиях во многих острых ситуациях.
Клиническая фармакология
Хотя лидокаин хорошо всасывается в кишечнике, он в значительной степени подвергается метаболизму при первом прохождении через печень, поэтому препарат обычно назначают внутривенно. Очень небольшое его количество экскретируется
Таблица 3.4
Электрофизиологические эффекты препаратов класса IB
|
|
Лидокаин |
Мексилетин |
Фенитоин |
|
Скорость |
— |
— |
— |
|
проведения |
|
|
|
|
Рефрактерные |
Снижает |
Снижает |
Снижает |
|
периоды |
+ |
+ |
+ |
|
Автоматизм |
Подавляет |
Подавляет |
Подавляет |
|
|
++ |
++ |
++ |
|
Следовые |
Подавляет |
Подавляет |
Подавляет |
|
деполяризации |
РСД и ПСД + |
ПСД + |
ПСД + |
|
Эффективность |
|||
|
ФПЯП |
— |
— |
— I |
|
АВУ-риентри |
— |
— |
— |
|
Макрориентри |
+/- |
— |
— |
|
ЖЭС |
++ |
++ |
+ |
|
ЖТ/ФЖ |
+ |
+ |
+ |
АВУ — атриовентрикулярным узел; РСД — ранние следовые деполяризации; ПСД — поздние следовые деполяризации; ФП — фибрилляция предсердий; ТП — трепетание предсердий; ЖЭС — желудочковая экстрасисто- лия; ЖГ — желудочковая тахикардия; ФЖ — фибрилляция желудочков.
почками даже после внутривенного применения. Лидокаин на 70 % связывается с белками плазмы. Кроме того, белки, связывающиеся с лидокаином, являются острофазовыми реактантами, то есть в стрессовых ситуациях, например при остром инфаркте миокарда, количество белков плазмы, связывающих лидокаин, возрастает, что может вызвать удлинение периода полувыведения с 1—2 до 4 ч, а это, в свою очередь, может привести к увеличению уровня лидокаина даже при постоянной скорости инфузии.
Дозировка
Лидокаин обычно быстро вводят внутривенно в нагрузочной дозе 1,5 мг/кг с последующей постоянной 1—4 мг/мин инфузией. При болюсном введении препарат быстро распределяется в органы-мишени (фаза 1 распределения), а в течение 20 мин распределяется по всему организму (фаза 2 распределения); начальная немедленная эффективность препарата снижается в течение фазы 2. Поэтому обычно используются 2 или 3 дополнительных болюса с 10-минутными интервалами после первого; доза дополнительных болюсов составляет, как правило, половину первоначального.
Электрофизиологические свойства
Как типичный представитель класса IB, лидокаин (в основном вследствие особенностей кинетики с быстрым связыванием) не вызывает замедления фазы деполяризации потенциала действия и скорости проведения в нормальной ткани. Однако при высоких частотах сердечного ритма, а также на фоне ишемии, гипокалиемии или ацидоза препарат может существенно замедлять деполяризацию и скорость проведения. Потенциал действия и рефрактерный период укорачиваются под действием лидокаина в желудочковой ткани, но не в предсердной. Лидокаин способен подавлять как нормальный, так и аномальный автоматизм, что порой приводит к асистолии при введении лидокаина на фоне желудочкового выскальзывающего ритма. Выявлено также свойство препарата подавлять ранние и поздние следовые деполяризации.
Гемодинамические эффекты
Действие лидокаина на гемодинамику весьма незначительное или отсутствует вовсе.
Терапевтическое применение
Лидокаин эффективен при желудочковых тахиаритмиях и обычно является препаратом выбора для экстренной терапии этих нарушений сердечного ритма, поскольку существует возможность быстрого достижения его терапевтического уровня в плазме. Ранее было показано, что лидокаин снижает частоту фибрилляции желудочков при остром инфаркте миокарда, но не уменьшает смертность.
Побочные реакции и взаимодействие с другими препаратами
В основном неблагоприятное воздействие препарата отражается на центральной нервной системе и представлено нечеткостью речи, головокружением, онемением и парестезией вокруг рта, обмороками и остановкой дыхания, что обычно связано с токсическим уровнем препарата в плазме.
На уровень лидокаина в плазме могут влиять пропрано- лол, метопролол и циметидин (но не ранитидин). Фенобарбитал снижает концентрацию лидокаина в плазме.
Лидокаин редко оказывает проаритмическое действие.
Мексилетин
Мексилетин — препарат для применения внутрь, родственный лидокаину. Одобрен Комитетом по использованию пищевых продуктов и лекарственных препаратов США (FDA) в 1986 г.
Клиническая фармакология
Мексилетин почти полностью абсорбируется в желудочно-кишечном тракте и в минимальной степени подвергается метаболизму при первом прохождении через печень. Пиковый уровень препарата в плазме наблюдается через 4—6 ч после приема; примерно 70 % мексилетина связывается с белками. Препарат в основном метаболизируется в печени, период по- лувыведения — 8—16 ч.
Дозировка
Вследствие вариабельности метаболизма и того факта, что терапевтические и токсические диапазоны доз мексилетина имеют тенденцию перекрывать друг друга, дозу препарата подбирают индивидуально. При отсутствии печеночной патологии препарат применяется в дозе 150 мг 3 раза в день. При отсутствии эффекта в течение нескольких (по крайней мере трех) дней и признаков токсического действия препарата дозу повышают до 200 мг 3 раза в день. При необходимости через 3 дня дозу можно увеличить еще, если не развивается интоксикация. Однако случаи, когда при назначении более 750 мг/день не наблюдаются серьезные побочные явления, очень редки.
Электрофизиологические свойства
Электрофизиологические свойства мексилетина фактически идентичны таковым у лидокаина.
Гемодинамические эффекты
Действие мексилетина на артериальное давление и сердечную функцию незначительно или отсутствует вовсе.
Терапевтическое применение
Терапевтический профиль мексилетина сходен с таковым у лидокаина, то есть препарат эффективно подавляет желудочковые аритмии. Однако, в отличие от лидокаина, мексилетин не пригоден для лечения острых аритмий, так как титрование дозы препарата может занять много дней (в связи с чем область применения мексилетина ограничена лечением хронических желудочковых аритмий). Препарат эффективен для подавления желудочковых экстрасистол и неустойчивой желудочковой тахикардии, однако эти нарушения сердечного ритма, как правило, не требуют лечения при отсутствии выраженной симптоматики. Как выяснилось на основе серийного тестирования препаратов в электрофизиологической лаборатории, мексилетин редко подавляет индуцируемую устойчивую желудочковую тахикардию; при этом препарат эффективен только у 5-10 % тестированных пациентов.
Побочные реакции и взаимодействие с другими препаратами
Как и лидокаин, мексилетин оказывает неблагоприятное воздействие преимущественно на центральную нервную систему, которое наиболее часто проявляется тремором, нечеткостью зрения и атаксией. Также при применении мексилетина наблюдаются желудочно-кишечные расстройства. Хотя препарат обычно не влияет на гемодинамику, есть данные о том, что у пациентов с тяжелой кардиомиопатией он вызывает прогрессирование сердечной недостаточности. Мексилетин также может вызвать тромбоцитопению.
Уровень препарата может снижаться под действием фе- нитоина, фенобарбитала, хлорамфеникола и изониазида. При сочетанном назначении с мексилетином не исключено выраженное повышение уровня теофиллина. Побочные эффекты мексилетина и лидокаина способны суммироваться.
Как типичный представитель класса IB антиаритмиче- ских препаратов, мексилетин редко оказывает проаритмиче- ское действие.
Токаинид
Токаинид — еще один аналог лидокаина для применения внутрь — по своим свойствам очень похож на мексилетин, за исключением того, что выводится из организма через печень и почки. Поскольку обнаружено, что токаинид вызывал у некоторых пациентов агранулоцитоз, он сейчас почти не используется в клинической практике, кроме чрезвычайно редких случаев, когда больной нуждается в хронической терапии, но не переносит другие препараты класса IB.
Фенитоин
Фенитоин используется в клинической практике в качестве антиконвульсанта с 1938 г. К началу 1950-х гг. были обнаружены его антиаритмические свойства. В 1960-х гг. препарат имел широкую популярность, однако его полностью вытеснили ли- докаин и новокаинамид. Фенитоин не был одобрен Комитетом по использованию пищевых продуктов и лекарственных препаратов США (FDA) для лечения нарушений сердечного ритма. В целом, фенитоин довольно редко назначают при аритмиях, хотя в отдельных случаях его полезность у таких пациентов несомненна.
Клиническая фармакология
Абсорбция фенитоина после приема внутрь относительно медленная и широко варьируется. Максимальный уровень препарата в плазме может наблюдаться через 3—12 ч после однократного приема. Фенитоин на 90 % связывается с белками и метаболизируется в печени до неактивных соединений. При более низких уровнях препарата в плазме (lt; 10 мг/л) кривая его элиминации имеет экспоненциальную форму. При более высоких уровнях выведение зависит от дозы, и уровень фенитоина в плазме растет в диспропорции к дозе. Средний период полувыведения препарата — 24 ч, но это значение очень вариабельно.
Дозировка
При применении фенитоина внутрь обычно рекомендуется нагрузочный режим, особенно если необходимо достичь терапевтического уровня в течение 24 ч. Как правило, в 1-й день назначают 15 мг/кг внутрь раздельными дозами, во 2-й — 7,5 мг/кг с последующим переходом на поддерживающую дозу 5 мг/кг (обычно 300—500 мг/день в 2 или 3 приема). Хроническую (поддерживающую) дозу не следует изменять чаще, чем один раз в 10—14 дней, поскольку скорость выведения препарата зависит от его дозы.
Фенитоин может также использоваться внутривенно, предпочтительно через центральную вену для предотвращения возможного развития тромбофлебита. Внутривенно препарат вводят со скоростью 50 мг/мин до общей дозы 7,5—10 мг/кг.
Отсутствие нистагма при взгляде вбок —- полезный индикатор терапевтического уровня препарата в сыворотке (10-20 мг/л).
Электрофизиологические свойства
Электрофизиологический профиль фенитоина аналогичен таковому у лидокаина. Действие фенитоина на быстрые натриевые каналы (с быстрым связыванием и освобождением) зависит от частоты сердечного ритма. Вследствие этого в нормальной ткани и при обычном сердечном ритме проведение изменяется минимально. В отличие от препаратов класса IB, фенитоин обладает опосредованным центральным антиадре- нергическим действием. Он подавляет отсроченную постдеполяризацию, которая наблюдается при дигиталисной интоксикации.
Гемодинамические эффекты
При быстром внутривенном введении нагрузочной дозы не исключена гипотензия, которая контролируется титрованием скорости введения препарата. При применении фенитоина внутрь гипотензии обычно не наблюдается. Препарат не оказывает отрицательного инотропного эффекта.
Терапевтическое применение
Фенитоин эффективен для лечения желудочковых тахиаритмий, вызванных дигиталисной интоксикацией, чаще всего из-за подавления поздних следовых деполяризаций. Кроме того, как препарат класса IB фенитоин иногда эффективен при интенсивной терапии, направленной на подавление желудочковых аритмий, обусловленных повышенным автоматизмом.
Побочные реакции и взаимодействие с другими препаратами
К наиболее частым побочным эффектам относятся желудочно-кишечные расстройства и осложнения со стороны центральной нервной системы. Симптоматика, вызванная воздействием на ЦНС (в основном атаксия и нистагм), зависит от уровня препарата в плазме. Редкие побочные эффекты включают остеомаляцию (из-за нарушения метаболизма витамина D), мегалобластическую анемию (вследствие нарушения метаболизма фолиевой кислоты) и реакции гиперчувствительности (волчаночный синдром, гепатонекроз, гематологические нарушения, псевдолимфома). Гиперплазия десен на фоне приема фенитоина наблюдается у 20 % детей и нечасто — у взрослых.
Обнаружено взаимодействие фенитоина с некоторыми препаратами. Применение фенитоина способствует увеличению уровней теофиллина, хинидина, дизопирамида, лидокаи- на и мексилетина в плазме. Концентрация фенитоина возрастает при его сочетанном приеме с циметидином, изониазидом, сульфаниламидами и амиодароном. Теофиллин может снижать уровень фенитоина в плазме.
Как и другие препараты класса IB, фенитоин редко вызывает проаритмию.
Источник: Фогорос Р.Н., «Антиаритмические средства. Изд. 2-е.» 2009
А так же в разделе « Класс IB »
- Глава 3 Антиаритмические препараты I класса
- Дизопирамид
- Класс 1C
- Флекаинид
- Этмозин(морицизин)
- Глава 4 Антиаритмические препараты II класса: 3-блокаторы
- (3 -Блокаторы в лечении аритмий Суправентрикулярные аритмии
- Желудочковые аритмии
- Побочные реакции и взаимодействие с другими препаратами
- Глава 5 Антиаритмические препараты III класса
- Амиодарон
- Электрофизиологические свойства
- Соталол
- Ибутилид
- Глава 6 Препараты IV класса: кальцийблокирующие средства
- Клиническое использование кальцийблокирующих препаратов
- Глава 7 Неклассифицированные антиаритмические средства
- Магний
- Глава 8 Исследуемые антиаритмические препараты
- Азимилид
- Дронедарон
- Тедисамил
- Глава 9 Типичные побочные эффекты антиаритмических препаратов
- Усугубление реципрокных аритмий
- Тахиаритмия torsades de pointes