АНТИМЕТАБОЛИТЫ
Антиметаболитами называют группу природных и синтетических веществ, очень гетерогенную по химической природе и механизмам действия, характерной особенностью которых является то, что их подавляющее действие уменьшается при добавле-
вии одного или нескольких метаболитов. Обычно (но не всегда) структура антиметаболитов аналогична структуре соответствующих метаболитов-антагонистов.
А. МЕХАНИЗМ ДЕЙСТВИЯ
На основании механизма действия аптиметаболиты можно разделить на две большие группы.
- Антиметаболиты, включающиеся вместо природных мономеров б «информационные» полимеры (ДНК, РНК, белки) и изменяющие закодированную в них информацию.
- Антиметаболиты, подавляющие образование незаменимых метаболитов (рис. 3.17).
Антиметаболиты обоих типов обладают следующими свойствами.
1 — блокирование синтеза мономеров с последующей остановкой синтеза полимера и, следовательно, остановкой роста бактерий. 2— блокирование синтеза кофакторов, необходимых для синтеза мономеров; можно также представить себе, что существуют вещества, блокирующие синтез одного или нескольких промежуточных продуктов, необходимых для синтеза мономеров (2а). Поскольку эти метаболиты более или менее одинаковы даже у далеко отстоящих друг от друга в эволюционном отношении организмов, блокирующие вещества не должны обладать высокой избирательностью и должны быть токсичными. 3— блокирование полимеризации. 4 — включение аналогов, приводящее к тому, что соответствующие полимеры становятся нефункциональными.
RfF
- По структуре они часто сходны с природными метаболитами, аналогами которых их считают.
- Они взаимодействуют с ферментами, узнающими в норме природный метаболит, и исключают их взаимодействие с природным метаболитом.
- Степень ингибирования является функцией отношения концентраций аналога и природного метаболита; этот тип ингибирования называют конкурентным.
- Действие антиметаболита может быть блокировано не только природным продуктом, аналогом которого является антиметаболит, но и конечным продуктом ингибируемого метаболического пути.
Б. ВКЛЮЧЕНИЕ В ПОЛИМЕРЫ В ПРОЦЕССЕ БИОСИНТЕЗА
Система полимеризации аминокислот часто не может различить природную аминокислоту и ее аналог и включает в белок и то и другое. При этом синтезируются аномальные белки, плохо функционирующие или вообще нефункциональные, и рост клеток подавляется. Наиболее известными аналогами аминокислот с таким типом действия являются фторфенилалэнин (синтетический продукт) и селенометионин (обнаруженный в некоторых растениях). Имеются также аналоги пиримидиновых оснований, которые включаются в ДНК или в РНК вместо природных нуклеотидов. Наиболее важным синтетическим соединением этого типа является 5-бромурацил, который конкурирует с ти- мином при синтезе ДНК-
s. ПОДАВЛЕНИЕ СИНТЕЗА МЕТАБОЛИТА ИЛИ НЕЗАМЕНИМОГО КОФАКТОРА
В отличие от веществ, описанных в предыдущем разделе, многие антиметаболиты не включаются в макромолекулы вместо метаболитов, которых они напоминают, а подавляют один или несколько ферментов биосинтетических путей, ведущих к образованию соответствующих метаболитов. В конце концов это приводит к подавлению синтеза макромолекулы, незаменимым компонентом которой является данный метаболит.
Аналогичный результат наблюдается, если антиметаболит нарушает синтез кофактора, необходимого для синтеза одного или нескольких незаменимых метаболитов. Описано много антиметаболитов, влияющих на различные функции клетки (синтез промежуточных метаболитов, синтез аминокислот, механизмы транспорта). Наиболее важные из них принадлежат к следующим группам: 1) ингибиторы синтеза нуклеотидов и, следова- ч
тельно, ингибиторы синтеза нуклеиновых кислот; 2) ингибиторы синтеза пентапептида пептидогликана и, следовательно, в конеч-
- 347
ном счете ингибиторы синтеза клеточной стенки; 3) ингибиторы синтеза или функций фолиевой кислоты — кофактора, необходимого для синтеза пуринов и белков.
- ИНГИБИТОРЫ СИНТЕЗА ПУРИНОВЫХ И ПИРИМИДИНОВЫХ НУКЛЕОТИДОВ
К этой группе относятся хадацидин и аланозин
а. Хадацидин
Хадацидин — аналог аспарагиновой кислоты. Аспарагиновая кислота принимает участие в синтезе АМР в следующей реакции:
IMP + Аспарагиновая кислота-*-Адепилсукцинат.
Хадацидин конкурирует с аспарагиновой кислотой за связывание с ферментом, катализирующим эту реакцию, и таким образом подавляет ее. Это конкурентный тип ингибирования, поскольку степень ингибирования является функцией отношения концентраций аналога (хадацидина) и антагониста (аспарагиновая кислота). Та же реакция подавляется аланозином—другим антибиотиком, аналогом аспарагиновой кислоты.
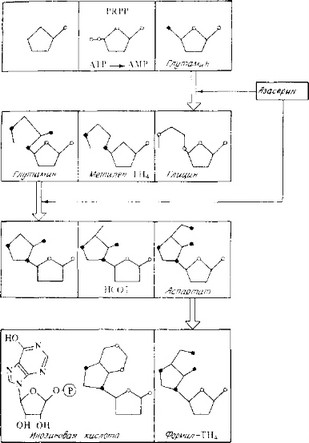
Рис. 3.18. Участки метаболических путей, подавляемые ингибиторами синтеза пуриновых нуклеотидов. Начальные стадии.
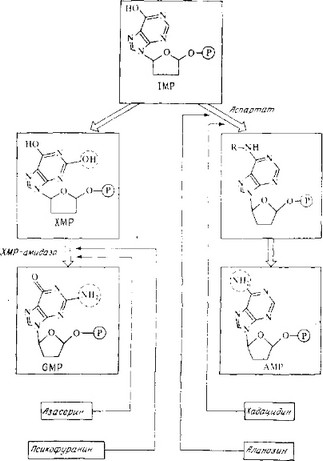
Рис. 3.19. Участки метаболических путей, подавляемые ингибиторами синтеза
пуриновых нуклеотидов. Конечные стадии.
Сходный механизм лежит в остове антибиотического действия азасертна и диазоизонорлейцииа (ДОН), являющихся аналогами глутамина — незаменимого предшественника синтеза пуринов. Оба аналога конкурентно подавляют синтез нуклеотидов и, следовательно, синтез нуклеиновых кислот (рис. 3.18, 3.19).
б. Шовдомицин
Шовдомицин — аналог уридина, нарушающий фосфорилиро- вание UMP с образованием UDP, которое является обязательной стадией превращения UMP в СТР.
Последнее соединение является предшественником нуклеиновых кислот (рис. 3.20).
- ИНГИБИТОРЫ СИНТЕЗА ПЕПТИДОГЛИКАНА
а. Циклосерин
Механизм действия циклосерина представлен в разд. III.Г.2. Этот антибиотик можно рассматривать как антиметаболит, подавляющий образование пептидогликана. Циклосерин является «аналогом» аланина, и его подавляющее действие снимается этим соединением. Оно может сниматься при добавлении как D-аланина, так и D-аланил-О-аланина— конечного продукта метаболического пути, подавляемого циклосерином.
- АНТИМЕТАБОЛИТЫ —ИНГИБИТОРЫ СИНТЕЗА ФОЛИЕВОЙ КИСЛОТЫ
Хотя в этой книге мы рассматриваем только природные антибиотики, т. е. продукты жизнедеятельности микроорганизмов, здесь уместно отметить группу синтетических антибактериальных препаратов—• сульфонамидов, поскольку они служат примером одного из немногих классов антиметаболитов, используемых в клинике. Сульфонамиды по структуре близки к п-ами- нобензойной кислоте (ПАБК), которая является предшествен-
Рис. 3.20. Участок метаболического пути, на который действует шовдомицин.
ником фолиевой кислоты и, следовательно, кофактором, необходимым для роста бактерий.
NH2 уgt;—SOtNH—R
Сульсронамид
Н; N —^ ^— ('QO Н
п-Аминодензойная кислота /ГМБК)
Сульфонамиды конкурентно подавляют включение ПАБК в молекулу фолиевой кислоты и частично включаются в молекулы, напоминающие фолиевую кислоту, образуя аналоги фолиевой кислоты, которые также являются ингибиторами. Добавление фолиевой кислоты к культуре бактерий, рост которых подавлен сульфонамидами, не снимает действия ингибитора, поскольку клеточная мембрана бактерий непроницаема для фолиевой кислоты. Если вместо этого добавить конечные продукты «метаболизма фолиевой кислоты», например метионин или тимин, подавляющее действие сульфонамида снимается. Фолиевая кислота является незаменимым кофактором и для клеток высших организмов; они неспособны синтезировать ее сами, а должны получать из среды. Поэтому клетки животных проницаемы для фолиевой кислоты.
Поскольку клетки животных не синтезируют фолиевую кислоту, сульфонамиды на них не действуют. Избирательность сульфонамидов определяется 1) наличием конкретного метабо
лического пути, чувствительного к сульфонамидам и необходимого для бактерий, но отсутствующего у млекопитающих;
- неспособностью бактерий транспортировать фолиевую клетку в клетку.
- ИНГИБИТОРЫ ДИГИДРОФОЛАТРЕДУКТАЗЫ: ТРИМЕТОПРИМ
Помимо других реакций фолиевая кислота участвует в реакциях восстановления с образованием дигидрофолиевой и тет- рагидрофолиевой кислот, катализируемых ферментом дигидро- фолатредуктазой. Этот фермент присутствует в клетках разных организмов — от бактерий и простейших до млекопитающих, в том числе и человека, но его структура неодинакова у разных групп организмов. Благодаря этим различиям некоторые веще-
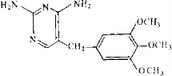
Рис. 3.21. Структурная формула триметоприма.
Птеридин +МБК + Гмутамат
ства при определенных концентрациях подавляют фермент бактерий и не действуют на фермент простейших или клеток животных. Справедливо и обратное. Это типичный случай дифференциального сродства.
Триметоприм (рис. 3.21) ингибирует фермент бактерий и не действует на фермент из клеток млекопитающих. Он является структурным аналогом птеридиновой части дигидрофолиевой кислоты. В присутствии триметоприма тетрагидрофолиевая кислота превращается в дигидрофолиевую. Это приводит к остановке тимидилатсинтетазной реакции, в ходе которой дезоксиури- диловая кислота превращается в тимидиловую, поскольку и этой реакции в качестве кофактора используется тетрагидрофолат, а не дигидрофолат. Вследствие подавления синтеза тими- дилата останавливается синтез ДНК и прекращается рост клеток. Добавление тимина к среде снимает подавляющее действие триметоприма.
Помимо синтеза тимидилата триметоприм подавляет синтез и других продуктов обмена одноуглеродных соединений (глицина, метионина, пуринов) (рис. 3.22).
Механизм действия триметоприма (рис. 3.22) зависит от избирательной доступности продукта обмена одноуглеродных соединений. Если их нет в среде, препарат обладает бактерио- статическим действием. Если тимин отсутствует, но есть глиции и метионин, препарат обладает бактерицидным действием (без- тиминовая гибель). Если в среде содержатся как тимин, так и аминокислоты, ингибирующее действие препарата не проявляется.
Источник: Ланчини Д., Паренти Ф., «Антибиотики. Пер. с англ. — М.: Мир. — 272 с., ил.» 1985