III. ИНГИБИТОРЫ СИНТЕЗА КЛЕТОЧНОЙ СТЕНКИ
Перед тем как обсуждать механизмы действия ингибиторов синтеза клеточной стенки, мы должны кратко рассмотреть химическую структуру клеточной стенки различных микроорганизмов и основные пути ее биосинтеза.
А. СТРУКТУРА И АРХИТЕКТУРА КЛЕТОЧНОЙ СТЕНКИ
Клеточная стенка представляет собой жесткую структуру, которая окружает микробную клетку, определяя ее форму и защищая от разрушения иод действием высокого внутриклеточного осмотического давления. У прокариот в основе структуры клеточной стенки лежит сложная трехмерная сеть из макромолекул пептидогликана (мукопептида, или гликопептида, или муреина) и других полимеров (полисахаридов, липопротеидов и т. д.), которые варьируют у разных бактерий. Пептидогликан представляет собой длинные полисахаридные цепи, состоящие из двух типов мономеров: ацетилмурамовой кислоты (М) и аце- тилглюкозамина (G), расположенных поочередно и соединенных (Р1-gt;4)-гликозидными связями. Цепи связаны между собой пептидами, состоящими из четырех остатков аминокислот, причем третья аминокислота варьирует. Пептиды ответвляются от остатков ацетилмурамовой кислоты, образуя трехмерную структуру (рис. 3.3 и 3.4).
Способ соединения пептидных цепей различается у разных видов бактерий. В некоторых случайх они соединены непосредственно, в других — через дополнительные аминокислотные цепи.
Помимо трехмерной пептидогликановой сети в клеточной ¦стенке имеются другие структуры, неодинаковые у разных орга-

Рис. 3.4. Схематическое изображение слоя пептндоглнкановой сети у Е. coli (А) и у S. aureus (Б). Длинные параллельные горизонтальные цепи состоят из N-ацетнлглюкозамина (темные участки) и мурамовой кислоты (светлые участки). К остаткам мурамовой кислоты присоединены тетрапептиды (светлые сегментированные отрезки). У Е. coli связаны между собой только некоторые тетрапептиды, причем связь всегда образуется между третьей аминокислотой одного тетрапептида и четвертой аминокислотой другого. У S. aureus связи между пептидами непрямые; они осуществляются с помощью пентагли- циновых мостиков (светлые кружочки). [II meccanismo d’azione degli antibiotic!, in M. Vergnano and D. Sassella (eds), Rassegna Medica, Milan, Italy. Gruppo Lepetit, Spa., 1973, p. 33.1
иизмов, но в основном представленные двумя типами. Один из них характерен для грамположительмых бактерий, а другой — для грамотрицательных.
- КЛЕТОЧНЫЕ СТЕНКИ ГРАМПОЛОЖИТЕЛЬНЫХ МИКРООРГАНИЗМОВ
На электронной микрофотографии стенка таких клеток выглядит как однородный слой. Она построена из пептидогликана, белка и тейхоевых кислот. Последние содержатся в клеточной стейке в значительных количествах. У всех грамположительмых бактерии можно также обнаружить «мембранные тейхоевые кислоты», названные так потому, что они расположены между стенкой п плазматической мембраной. Мембранные тейхоевые кислоты представлены цепями из чередующихся остатков глицерина и фосфатов. Тейхоевые кислоты стенки ковалентно связаны с нептндогликаном. Они могут иметь такую же структуру, как мембранные тейхоевые кислоты, а также могут содержать остаток рибита вместо глицерина. У некоторых редких форм тейхоевых кислот основной полимер, помимо многоатомного спирта (глицерина), содержих также сахарные остатки, такие как глю- Koui и ти N-ацетилглюкозамин.
- КЛЕТОЧНЫЕ СТЕНКИ ГРАМОТРИЦАТЕЛЬНЫХ МИКРООРГАНИЗМОВ
У грамотрицательных бактерий клеточная стенка тоньше, чем у грамположителыных, но сложнее. Обычно она состоит из нескольких слоев. Внутренний слой образован пептидогликаном, отделенным от плазматической мембраны периплазматическим пространством, в котором функционируют некоторые ферменты. Снаружи от пептидогликанового слоя расположена наружная мембрана. Ее несколько схематично можно представить как двойной слой липополисахарида, дающий начало структуре, сходной с плазматической мембраной. Слои пересекаются молекулами белков, причем некоторые из них выполняют транспортные функции. Наружную поверхность этой мембраны покрывает сложный липополисахаридный слой.
- КЛЕТОЧНЫЕ СТЕНКИ ГРИБОВ
Стенки грибов построены из полисахаридных нитей, обра- зgt;ющих сеть и погруженных в аморфный полисахарид. Нити обычно состоят из хитина (poly-N-ацетилглюкозамина, pi-»-4).
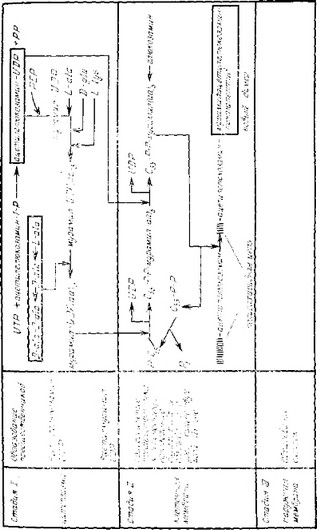
Рис. 3.5. Биоеиптс* пептидогликана
Б. БИОСИНТЕЗ ПЕПТИДОГЛИКАНА
Синтез пептидогликана можно разделить на три стадии (рис. 3.5 и 3.6).
- Образование основных единиц из промежуточных метаболитов, UDP-глЮ'КОвамина, и UDP-мурамилпентапептида.
- Конденсация основных единиц и их перенос к строящейся пептидогликановой структуре. Активированная молекула UDP- мурамилпентапептида присоединяется к липидному переносчику в плазматической мембране (это фосфорилирова-нный изопрано- идный спирт, содержащий 55 атомов углерода), освобождая UDP, и затем ‘взаимодействует с UDP-глюко'замином с образованием гликозидной связи между атомом С-1 мурамовой кислоты и атомом С-4 ацетжлглюкозамина (связь |31-gt;-4). При росте и делении бактерий, когда: должен образовываться новый пеп- тидогликан, ферменты на внутренней поверхности стенки частично гидролизуют трехмерную сеть. В результате у молекулы пептидогликана образуются свободные концы, способные присоединять димер (мурамилпентапептид — ацетилглюкозамин), что приводит к удлинению цепи.
- За мыкание связей между вновь образованными цепями пептидогликана. Соединение цепей происходит в результате потери концевого остатка аланина и образования пептидной связи между карбоксильной группой D-алани'на в четвертом положении и аминогруппой двухосновной аминокислоты в третьем положении другой цепи. Эту реакцию называют сшиванием. У некоторых бактерий сшивание осуществляется не прямым образом, а с помощью короткой пептидной цепи, соединяющей остаток D-аланина в одной цепи с двухосновной аминокислотой в другой. Освобождение в реакции D-ала.нина объясняет, почему в завершенной структуре пептидогликана содержатся тетрапептиды вместо пентапептидных предшественников (ацетилмура- милпентапептид).
Хотя основные особенности синтеза пептидогликана уже описаны выше, по-видимому, кроме этого существуют разные варианты созревания пептидогликана. Можно различить как минимум два таких способа: один связан с удлинением клеток, а другой— с образованием поперечных перегородок. Однако могут существовать и другие способы, на что указывает выделение мутантов с морфологическими деформациями при утрате одного из типов синтетической способности.
В. ИНГИБИТОРЫ СИНТЕЗА КЛЕТОЧНОЙ СТЕНКИ
Ингибиторы синтеза клеточной стенки можно разделить на два класса (рис. 3.7): 1) ингибиторы синтеза пептидогликана и 2) ингибиторы синтеза или сборки других компонентов стенки. Подавляющее большинство известных ингибиторов синтеза кле-
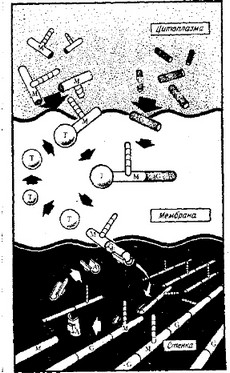
Рис. 3.6. Схематическое представление механизма транспорта субъединиц пептидогликана из цитоплазмы к тому месту, где строится клеточная стенка. На предыдущем этапе, не показанном на этой схеме, мурамовая кислота и N-аце- тилглюкозамин находились в цитоплазме в виде комплекса с UDP. М — мурамовая кислота, G — N-ацетилглюкозамин, Т — переносчик (фосфорилирован- ный липид), А—акцептор (гипотетический). [И meccanismo d’azione degli antibiotici, in M. Vergnano and D. Sassella (eds), Rassegna Medica, Milan. Italy, Gruppo Lepetit, Spa., 1973, p. 34,]
точной стенки относится к первому классу. Единственный антибиотик, относящийся ко второму классу, механизм действия которого изучен достаточно поли о, — бицикломицин. Показано, что он подавляет синтез (или сборку) липопротеида наружной мембраны грамотрицательных бактерий и поэтому действует только
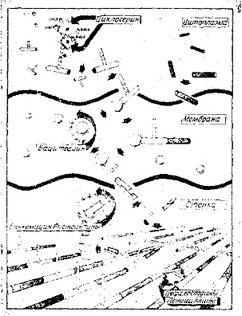
Рис. 3.7. Схематическое изображение места действия некоторых ингибиторов синтеза клеточной стенки, [И meccanismo d’azione degli antibiotici, in M. Ver- gnano and D. Sassella (eds), Rassegna Medica, Milan, Italy, Gruppo Lepetit, Spa., 1973, p. 46.1
it а грамотрицательные бактерии и не действует на грамположи- тельные.
Ингибиторы синтеза пептидогликана удобно подразделить на три группы в зависимости от процесса, «а который они действуют.
- Ингибиторы образования основных компонентов, из которых строится клеточная стенка, например циклосерин, фосфо- мицин.
- Ингибиторы образования димеров и ингибиторы их переноса к растущим цепям пептидогликана, например ванкомицш, ристоцетн-н, бацитрацин, флавомицин.
- Ингибиторы образования сшивок, например пенициллины, цефалоспорины, цефамицины, тиенамицины (р-лактамы с двумя кольцами), монобактамы.
Литические
ферменты
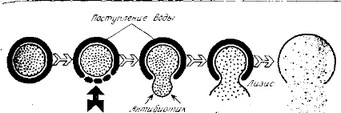
Рис. 3.8. Литическое действие на растущие клетки антибиотиков, подавляющих синтез клеточной стенки.
Несмотря на различия св механизме действия, все известные ингибиторы синтеза клеточной стенки имеют некоторые общие свойства.
Обладают бактерицидным действием. При росте бактериальной клетки с внутренней стороны клеточной стенки функционируют литические ферменты. Они разрывают цепи гтептидоглика- на с образованием свободных концов, к которым переносятся вновь образованные димеры. Если образование димеров или их перенос к растущей цепи пептидогликана подавлены, клеточная стенка становится менее прочной, из-за высокого осмотического давления цитоплазмы разрывается, и цитоплазма вытекает наружу (рис. 3.8) (см. также {3-лактамные антибиотики).
Не действуют на покоящиеся клетки. Литические ферменты, связанные с процессом синтеза клеточной стенки, активны только при росте клеток и неактивны в покоящихся клетках. Поэтому ингибиторы синтеза клеточной стенки не действуют на бактерии в стационарной фазе.
Не действуют на бактерии, утратившие клеточную стенку. О существовании бактерий без клеточной стенки упоминалось в разд. I. Известны три типа таких бактерий. 1. Микоплазмы — бактерии, встречающиеся в природе и являющиеся паразитами животных и растений. У них нет клеточной сгенки, и они не способны ее синтезировать ни при каких условиях. 2. L-формы— бактерии, обычно получаемые в лабораторных условиях, но иногда встречающиеся и в природе (например, при инфекциях мочевых путей, т. е. в гипертонических условиях), способные расти и размножаться при поддержании гипертонических условий. Если в среде отсутствуют ингибиторы синтеза клеточной стенки, L-формы стремятся регенерировать клеточную стенку.
- Протопласты — бактериальные формы, образованные, как и L-формы, в лаборатории, но в отличие от последних неспособные к размножению. Микоплазмы, L-формы и протопласты не чувствительны к действию ингибиторов синтеза клеточной стенки.
Г. ПРИМЕРЫ ИНГИБИТОРОВ СИНТЕЗА КЛЕТОЧНОЙ СТЕНКИ
Здесь мы кратко представим механизмы действия наиболее известных антибиотиков— ингибиторов синтеза пептидогликана (другие свойства этих антибиотиков см. в гл. 5).
- ФОСФОМИЦИН
Фосфомицин (известный ранее под названием «фосфономи- цин») —низкомолекулярное вещество, специфически подавляющее взаимодействие UDP-N-ацетилглюкозамина с фосфоенол- пируватом, ,в результате которого образуется UDP-N-ацетилму- рамовая кислота. Эта реакция катализируется ферментом пирувилтрансфера.зой. Фосфомицин ковалентно связывается с этим ферментом, необратимо ингибируя его активность.
- ЦИКЛОСЕРИН
Циклосерин — антибиотик, особенно активный в отношении микобактерий. Его антибиотическое действие уменьшается при добавлении в среду D-аланина. Это- свидетельствует о том, что цвклосерин действует на концевой участок пентапептида мура- мовой кислоты. In vitro было показано, что он конкурентно подавляет активность 1) фермента, превращающего L-аланин в его стереоизоgt;мер D-аланин (аланинрацемазы), и 2) фермента, катализирующего образование пептидной связи между двумя остатками D-аланина с образованием О-аланил-О-аланина (О-аланил-О-аланинсинтетаза).
Циклосерин по- структуре похож ,на D-аланин в одной из возможных конфсьрмаций, поэтому фермент ошибочно принимает его за D-аланин и связывается с антибиотиком, в результате чего нарушается каталитическая функция фермента.
- БАЦИТРАЦИН А
Бацитрацин А — полипептидный антибиотик, выделенный из бульонных культур Bacillus subtilis. Он блокирует функционирование фосфорилазы, освобождающей один из двух концевых фосфатов из комплекса с липидным переносчиком, который в результате не может служить акцептором мурамилпентапепти- да. Однако бацитрацин не очень специфичен, он подавляет и другие фосфорилазные реакции. Скорее всего именно такое отсутствие специфичности является причиной высокой токсичности этого антибиотика.
- ВАНКОМИЦИН И РИСТОЦЕТИН
Это сложные гликопептиды, содержащие производные ароматических аминокислот и остатков сахаров. Они подавляют перенос мурамилпентапептид—ацетилглюкозамина от липидного переносчика к растущей пептидогликановой цепи.
5. р-ЛАКТАМНЫЕ АНТИБИОТИКИ
Эта группа антибиотиков включает пенициллины, цефало- шорины, цефамицины, а также новые (3-лактамы, такие как тиенамицин, PS-5 и клавулановую кислоту. Все они имеют сходные, но не идентичные механизмы действия, предотвращая созревание пептидогликана путем подавления образования сшивок.
Образование сшивок катализируют два фермента: транспеп- тидаза, которая отщепляет концевой D-аланин от N-ацетилмура- милпенталептвда и связывает остающийся тетрапептид с другим участком пептидогликана, и карбокоипептидаза, которая отщепляет концевой D-аланин, но не катализирует образование сшивки. По-видимому, антибактериальная активность |3-лактам- ных антибиотиков .в первую очередь связана с подавлением активности транспептидазы (рис. 3.9).
Идентифицировано несколько белков внутренней мембраны растущих бактерий, способных специфически связывать (3-лакта- мы; они названы пенициллинсвязывающими белками (ПСБ). Однако разные (3-лактамы обладают неодинаковым сродством к разным связывающим белкам. Крайний случай представляет ме- цилллнам, связывающийся только с одним белком. Разные связывающие белки могут отвечать за различные типы созревания пептидогликана. В результате дифференциального подавления различных типов созревания пептидогликана разные р-лактамы вызывают появление разных морфологических эффектов. Например, бензилпенициллин обладает литическим действием, а цефалексин индуцирует образование удлиненных форм Е. coli, у которых специфически подавлено образование поперечных перегородок, тогда как удлинение клеток не нарушено'. Мецилли- нам, с другой стороны, индуцирует образование округлых форм, у которых нодавлено удлинение клеток, а не образование поперечных перегородок. Различные ПСБ могут быть представлены разными формами транспептидаз и кар'боксипептидаз.
Каков механизм действия р-лактамных антибиотиков, вызывающих лизис восприимчивых к ним микроорганизмов? Несколько лет назад казалось, что этот вопрос полностью решен. В основе модели механизма действия лежали следующие предположения: 1) подавление (3-лактамами функции ключевой биохимической мишени в синтезе клеточной стенки (одного или нескольких ферментов, ответственных за образование транспептидной lt;сшивки йно:вь образующихся цепей пептидогликана); это подавление осуществляется благодаря структурному сходству §-лактамов с О-аланил-О-аланином —субстратом транспепти- дазной реакции; 2) включение несшитых блоков в растущие цепи пептидогликана, в результате чего образуется «ослабленная» клеточная стенка; 3) продолжающееся накопление цито-
|
1 ! § ¦g § |
ДНК |
РНК |
Белок |
Клеточная стенка |
|
г ' / 1 1 1 |
/ ? ..111 |
—А 4 / 1 1 1 |
4 / I I I |
|
|
|
10 Z0 30 |
!0 Z0 30 |
10 20 30 |
10 20 30 |
|
Время инкубации, мин ! |
||||
Рис. 3.9, Влияние пенициллина па включение радиоактивных предшественников в ДНК, РНК, белок и клеточную стенку растущих бактерий. Сплошные кривые — контроль, штриховые — включение метки в культуре, к которой добавлен антибиотик. Время добавления антибиотика отмечено стрелкой.
плазматического материала, приводящее к увеличению давления на ослабленную клеточную стенку, последующее ее разрушение и лизис клеток. Согласно этой модели, лизис клеток является «прямым» следствием «несбалансированного» роста, т. е. результатом подавления синтеза клеточной стенки при продолжающемся приросте массы клетки.
Недавние экспериментальные данные свидетельствуют, однако, о том, что ситуация здесь гораздо сложнее. Перечислим эти данные. 1. Некоторые бактерицидные р-лактамы не подавляют образование сшивок. 2. У некоторых бактерий плохо сшитые элементы пептидогликана не включаются в растущие цепи и, следовательно, не происходит предполагаемого «ослабления» клеточной стенки. 3. Получены мутанты бактерий, у которых добавление пенициллина приводит к подавлению роста, а не к лизису (пенициллин-толерантные штаммы). Эти штаммы или утратили фермент (ферменты), гидролизующий пептидогликан. или имеют избыток ингибитора такого фермента (ферментов).
На основании этих данных предложена новая модель механизма действия р-лактамов. Согласно этой модели, необратимые последствия, к которым приводит ]Воз действие на клетку р-лактамов (лизис клетки), лишь «косвенно» связано с действием антибиотика на первичные мишени (ПСБ). В рамках этой модели 1) р-лактамы подавляют активность одного или нескольких ферментов синтеза пептидогликана (ПСБ), что приводит к подавлению роста бактерий; 2) генерируется «сигнал» (неустанов
ленной пока биохимической природы), вызывающий освобождение тейхоевых кислот в среду; 3) в результате удаления тейхос- вых кислот активируются один или несколько ферментов, гидролизующих пептидогликан; 4) это ослабляет ковалентные связи клеточной стенки, оставляя клеточную мембрану без механической поддержки, и 5) в результате происходит осмотический лизис клетки.
Источник: Ланчини Д., Паренти Ф., «Антибиотики. Пер. с англ. — М.: Мир. — 272 с., ил.» 1985