ОПРЕДЕЛЕНИЕ МИНИМАЛЬНОЙ ПОДАВЛЯЮЩЕЙ КОНЦЕНТРАЦИИ НА ПЛОТНОЙ СРЕДЕ
В принципе эта процедура сходна с определением МПК в жидкой 'Среде. Готовят несколько чашек Петри со ступенчатыми разведениями антибиотика, растворенного в дайной среде. Добавляют расплавленный агар, чашки охлаждают, чтобы агар затвердел. На поверхности среды штрихом засевают культуры одной или нескольких бактерий и после инкубации в термостате в течение необходимого времени определяют минимальную концентрацию антибиотика, при которой подавляется рост бактерий. Одним из преимуществ этого метода перед методом титрования в жидкой среде является то, что разные участки одной и той же чашки можно засевать разными видами или штаммами бактерий. В результате величины МПК для нескольких бактерий можно определить в одном опыте (рис. 2.2).
- ОПРЕДЕЛЕНИЕ АКТИВНОСТИ АНТИБИОТИКОВ
МЕТОДОМ ДИФФУЗИИ В АГАРЕ
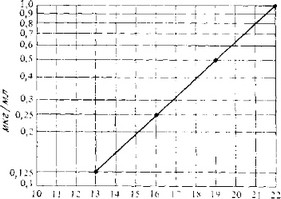
Этот метод применяется для определения концентрации антибиотика в растворе. Он состоит в следующем. Диски из фильтровальной бумаги, смоченные исследуемым раствором антибиотика, помещают на поверхность агаризованной среды, содержащей разведенную суспензию бактерий. После соответствующей инкубации поверхность агара, которая вначале была полупрозрачной, мутнеет из-за рассеяния света выросшими бактериями. Полупрозрачные зоны остаются лишь вокруг дисков фильтровальной бумаги, поскольку антибиотик диффундирует в агар и подавляет рост бактерий. Если диаметр этих зон определять при строго стандартных условиях, то он будет функцией логарифма концентрации антибиотика. Используя известные концентрации антибиотика, строят стандартную кривую, по которой можно определить концентрацию антибиотика в неизвестных растворах (рис. 2.3). Иногда вместо дисков из фильтровальной бумаги используют небольшие полые цилиндрики, поставленные на поверхность агаровой среды и содержащие раствор антибиотика.
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА ОПРЕДЕЛЕНИЕ
АКТИВНОСТИ АНТИБИОТИКОВ
Активность антибиотиков in vitro зависит от условий определения (табл. 2.1). На определение активности влияют такие факторы, как состав среды, плотность инокулума, количество бактериальных клеток в иноку луме (величина инокулума).
 /
/

Таблица 2.1. Факторы, влияющие на определение активности антибиотиков
Тест-организм
Состав среды (pH, ионы, сыворотка, антагонисты)
Величина и плотность инокулума (гетерогенность популяции, механизмы инактивации, попадание веществ-антагонистов)
Условия инкубации (время, температура, аэрация)
А. СОСТАВ СРЕДЫ
Рассмотрим в качестве примера антибиотик, подавляющий биосинтез одной из аминокислот. Если антибиотик испытывают в среде без этой аминокислоты, то кажется, что он обладает очень высокой активностью, другими словами, имеет низкую величину МПК. При испытании в 'среде, содержащей аминокислоту, синтез которой он подавляет и которую бактерия может получать из среды, антибиотик будет казаться неактивным.
Помимо таких специфических эффектов часто наблюдается менее специфическое влияние среды, не связанное непосредственно с механизмом действия или с химической структурой антибиотика. Одним особенно интересным случаем является наличие в среде сыворотки. Ее вводят в среду при определении МПК, чтобы создать физиологические условия, напоминающие условия в крови. Многие антибиотики связываются с белками сыворотки крови (в особенности с альбумином), в результате число свободных молекул антибиотика, которые могут проникать в бактериальные клетки, снижается. Связывание антибиотика с белками сыворотки обычно коррелирует с липофильностью некоторых заместителей в его молекуле.
Очевидно, что условия определения МПК в жидкой среде отличаются от условий в плотной среде хотя бы потому, что в плотной среде присутствует агар. Агар, содержащий S03-rpyn- пы, может адсорбировать антибиотик, изменяя его диффундирующую способность, или адсорбировать растворенный кислород и некоторые компоненты питательной среды. Неудивительно поэтому, что величина МПК антибиотика в отношении данной бактерии зависит от того, определена ли она в жидкой или в плотной среде, даже если эти две среды, за исключением наличия или отсутствия агара, идентичны по составу. Нужно также помнить, что физиология клеток может различаться в зависимости от того, растут ли они поодиночке в жидкости или в виде колоний на поверхности плотной среды.
Очень сильное влияние на активность антибиотиков оказывает величина pH среды. Помимо второстепенных эффектов, как то влияние pH на скорость роста микроорганизмов и, следова-
тешыно, косвенное влияние на их восприимчивость, величина pH оказывает очень сильное и непосредственное действие на способность препарата проникать ,в бактериальную клетку. Например, вещества в неионизированной форме лучше диффундируют через клеточную стейку и плазматическую мембрану, чем вещества в ионизированной форме. Таким образом, pH среды, определяя степень ионизации основного или .кислого антибиотика, может прямо влиять на скорость его проникновения в бактерии и, следовательно, на эффективность.
Б. ПЛОТНОСТЬ И ВЕЛИЧИНА БАКТЕРИАЛЬНОГО ИНОКУЛУМА
Плотность инокулума — это число засеваемых бактерий, отнесенное к объему, в котором они растут. Ее обычно выражают как число клеток в 1 мл культуры. Величина инокулума — общее число засеянных бактерий. На МПК многих антибиотиков не влияют вариации в плотности обычно используемого инокулума (103—106 бактерия/мл). Действительно, даже при очень низких концентрациях антибиотика, например 0,01 мкг/мл, отношение числа молекул антибиотика к числу бактериальных клеток остается очень большим (при концентрации антибиотика с мол. массой 1000, равной 0,01 мкг/мл, в 1 мл раствора содержится ~1012 молекул). Однако имеются некоторые исключения. Например, зачастую очень много молекул антибиотика адсорбируется на наружной поверхности бактериальной клетки. Если плотность бактерий высока, число свободных молекул антибиотика, которые могут проникнуть в клетку, очень сильно снижается. Кроме того, для подавления роста одной клетки часто бывает необходимо большое количество молекул антибиотика. По мере роста бактерии синтезируют и выделяют в среду ферменты, которые могут разрушать антибиотик (например, р-лакта- мазы, действующие на р-лактамные антибиотики; см. гл. 4). Количество разрушенного антибиотика является функцией концентрации фермента в питательной среде и, следовательно, зависит от величины инокулума.
На первый взгляд кажется, что, если плотность культуры бактерий одинакова, не важно, исследуется ли активность антибиотика в маленьких объемах, например 0,25 мл и меньше в миниатюризованных системах, или в объеме 10 мл в обычных лабораторных пробирках. Если все бактерии в популяции идентичны, никакой разницы в результатах не будет.
Когда общее число бактерий в инокулуме очень велико, повышается вероятность того, что в среде будут присутствовать клетки, менее восприимчивые к антибиотику. Рост всех восприимчивых клеток будет подавлен, однако менее восприимчивые (в принципе это может быть даже единственная клетка) будут размножаться, и после инкубации в течение 18 ч образуется по-
Таблица 2.2. Факторы, влияющие на активность некоторых антибиотиков
|
Антибиотики |
Факторы |
|
Аминогликозиды Пеницнллины Тетрациклины Полиеновые макролиды Триметоприм Полиэфирные антибиотики Мегициллин Сульфонамиды |
pH, двухвалентные катионы (Mg2+, Са2+) Величина инокулума pH, двухвалентные катионы (Са2+) Стерины Тимин, глицин, метионин Одновалентные ионы (К+) Величина инокулума (неравномерное распределение восприимчивых форм) 'г-Амшюбенлойная кислота, величина ино- кулума (занос антагонистов), одио- углеродные продукты обмена |
пуляция бактерий с высокой плотностью. Значительная вариабельность величины МПК с изменением числа инокулирован- ных клеток обычно свидетельствует о высокой частоте мутантов, устойчивых к антибиотику (гл. 4). Частота появления устойчивых мутантов неодинакова для разных антибиотиков. В случае антибиотиков, используемых в клинике, она колеблется от 10~7 до 10-10.
В этом разделе описаны далеко не все факторы, которые могут влиять на активность антибиотика в отношении определенной бактерии (табл. 2.2). Поэтому, чтобы использовать подавление роста бактерий для количественного определения активности антибиотиков и получить данные, которые можно воспроизвести в разных лабораториях, необходимо, чтобы все условия были точно определены и по возможности стандартизованы.
Источник: Ланчини Д., Паренти Ф., «Антибиотики. Пер. с англ. — М.: Мир. — 272 с., ил.» 1985