ТЕТРАЦИКЛИНЫ
Тетрациклины до последнего времени считались наиболее важными для клиники антибиотиками. Их используют и сейчас, несмотря на появление новых цефалоспоринов и аминогликози- дов. Тем не менее многие особенности биологических свойств тетрациклинов выяснены неполностью. Это антибиотики широкого спектра действия, бактериостатические, ингибиторы синтеза белка. Механизм, благодаря которому они блокируют функции рибосом, неизвестен. Теоретически они должны быть токсичными, поскольку действуют также и на рибосомы клеток эукариот, однако на самом деле они хорошо переносятся больными. Специфичность токсического действия тетрациклинов на бактерии заключается в том, что последние способны накапливать эти антибиотики. Возможно, это свойство, а также активность тетрациклинов связаны с их способностью образовывать хелатные комплексы с двухвалентными ионами, например кальцием и магнием.
А. ПРИРОДНЫЕ ТЕТРАЦИКЛИНЫ
Первым тетрациклином, нашедшим применение в клинике (в
- г.), был хлортетрациклин, образуемый Streptomyces аигео- faciens. Через два года из культуры Streptomyces rimosum был выделен окситетрациклин, а в 1952 г.—тетрациклин (рис. 5.16). Последний был впервые получен путем каталитического восстановления хлортетрациклина, а позже—путем биосинтеза при выращивании Streptomyces aureofaciens в среде, не содержащей хлора, а затем из штаммов Streptomyces, способных прямо синтезировать тетрациклин.
Ко всем этим трем антибиотикам наблюдается /перекрестная устойчивость, и все они имеют близкие, очень широкие спектры действия, включающие не только грамположительных и грамотрицательных бактерий, но и таких внутриклеточных паразитов, как Rickettsia и микоплаэмы, (которые невосприимчивы к пенициллину и цефалоспорину, поскольку у них нет клеточной стенки). Однако тетрациклины мало активны в отношении Proteus и Pseudomonas. В очень высоких концентрациях они подавляют развитие некоторых простейших. Несмотря на утверждения ряда авторов, тетрациклины не действуют на вирусы, что представляется вполне естественным, если учесть механизм их действия. Терапевтическая эффективность всех тетрациклинов приблизительно одинакова, и все они хорошо (хотя и не полностью) всасываются при приеме внутрь. In vitro хлортетрацик- лин несколько более активен в отношении некоторых бактерий, но при экспериментальных инфекциях проявляет себя не лучше, чем тетрациклин и окситетрациклин, возможно, потому, что он нестабилен при физиологических значениях pH и получить высокие концентрации в крови не удается.
В настоящее время в химиотерапии инфекционных заболеваний человека из природных тетрациклинов почти исключительно используется тетрациклин.
Б. ПОЛУСИНТЕТИЧЕСКИЕ ТЕТРАЦИКЛИНЫ.
ПРОИЗВОДНЫЕ ПО АМИДНОЙ ГРУППЕ
Первые попытки химической модификации тетрациклинов имели сугубо практическую, весьма конкретную цель — получить производные, растворимые в воде при нейтральных значе-
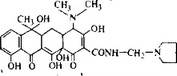
Рис. 5.17. Ролитетрациклин, растворимое производное тетрациклина.
ниях pH, которые при парэнтеральном введении не вызывали бы болезненности и раздражения на месте введения. Эта задача была быстро решена благодаря синтезу ролитетрациклина (рис. 5.17) и близких соединений — лимециклина и мепицикли- на, полученных из тетрациклина в ходе реакции с формальдегидом и соответствующими аминами. Эти препараты имеют такую
f|ke активность, как и тетрациклин, и в водных растворах гидро-
syioTCH с освобождением тетрациклина. Другие амидные проводные, которые гидролизуются плохо, неактивны.
ТЕТРАЦИКЛИНЫ, ОБРАЗУЕМЫЕ БИОСИНТЕТИЧЕСКИМ ПУТЕМ
Л
При обработке кислотой или щелочью природные тетрациклин ы быстро превращаются в неактивные производные. Продукты деградации, полученные при изучении структуры тетра- ... циклинов, также неактивны. Поэтому неудивительно, что перовые активные производные, помимо водорастворимых препаратов, упоминавшихся выше, были получены в результате модификации путей биосинтеза.
Первым представляющим интерес производным был 7-бром- тетрациклин, полученный при замене в среде культивирования S. aureofaciens хлорида на бромид. Однако это производное было менее активно, чем природные тетрациклины, и никогда не
- использовалось.
Производное, которое нашло применение в клинике, 6-дезме- тил-7-хлортетрациклин (рис. 5.18), было получено при добавлении к культуральной среде ингибиторов метилирования, например сульфонамидов, или благодаря выделению мутантных штаммов с неактивным метилирующим ферментом, которые в результате продуцировали дезметильное производное вместо хлортетрациклина. Такими же методами можно получить дезме- тилтетрациклин и дезметилокситетрациклин. Дезметилхлортет- рациклин очень стабилен, и его спектр действия очень близок к спектру действия хлортетрациклина. Он медленнее выводится из организма и дольше остается в крови в высоких концентрациях, что позволяет применять его в меньших дозах.
Г. ПОЛУСИНТЕТИЧЕСКИЕ ТЕТРАЦИКЛИНЫ,
МОДИФИЦИРОВАННЫЕ В ПОЛОЖЕНИЯХ 6 И 7
Сравнение активности природных тетрациклинов и различных производных показало, что в положения 5, 6, 7 и 9 можно вводить разные заместители без какой-либо заметной потери активности. Очевидно, эти положения не важны для образования связей антибиотика с биологическим рецептором. В результате многочисленных исследований удалось найти две реакции, в ходе которых осуществлялась модификация по этим положениям.
- После галоидирования N-хлорсукцинамидом в положении 10 можно отщепить молекулу воды из положения 6. В результате образуется 6-метилентетрациклин. С помощью этого метода получен метациклин (6-дезокси-б-дезметил-б-метиленокси- тетрациклин). Используя это производное в качестве исходногоПродукта, можно синтезировать доксициклин, или 6-дезокси-5- фкситетрациклин (рис. 5.18). Однако эта блестящая химическая работа не дала никаких интересных биологических результатов. §Сак метациклин, так и доксициклин используются в клинике, но единственным их преимуществом является поддержание высокого уровня антибиотика в црови в течение длительного времени.
- Гидрогенолиз в особых условиях (при использовании родия в качестве катализатора) приводит к отщеплению гидроксильной группы в положении 6. При удалении гидроксильной группы активность дезметилтетрациклина существенно не изменяется, а активность тетрациклина и окситетрациклина значительно снижается, но не потому, что удаляется гидроксил, а вследствие изменения конфигурации метальной группы в положении 6. Действительно, доксициклин, упоминавшийся выше, не несет гидроксильной группы в положении 6, но метильная группа имеет правильную конфигурацию, и активность остается такой же высокой, как у окситетрациклина. Поэтому 6-дезметил- 6-дезокситетрациклин является идеальным исходным материалом, на основе которого с помощью других химических реакций можно получить производные с заместителями в положениях 7 и 9.
Среди них наиболее важным производным является мино- циклин (рис. 5.18), или 7-диметиламино-6-дезметил-6-дезокситет- рациклин, активный in vitro и in vivo в отношении штаммов S. aureus, Streptococcus и Е. coli (но не Proteus или Pseudomonas), которые устойчивы к тетрациклину. Однако надежды на то, что этот препарат послужит только началом и что будут синтезированы другие тетрациклины, к которым не будет развиваться перекрестная устойчивость с исходным препаратом, по-видимому, не оправдаются. Поисками новых тетрациклинов занимаются в настоящее время лишь немногие лаборатории. Единственным интересным препаратом, полученным в последние годы, является 6-тиатетрациклин, который сейчас проходит клинические испытания.
Д. НЕРЕШЕННЫЕ ПРОБЛЕМЫ
- УСТОЙЧИВОСТЬ
Штаммы, устойчивые к тетрациклину, можно получить в лаборатории с помощью серийного культивирования, но устойчивость развивается медленно и относится к многоступенчатому типу. Однако имеется много природных устойчивых штаммов, нечувствительность которых связана с наличием у них трансмиссивного R-фактора.
Низкая частота устойчивых мутантов среди бактерий, происходящих от обычных штаммов, имеет важное практическое
значение, поскольку редко наблюдается «конверсия», т. е. появление устойчивых бактерий при лечении больного, зараженного чувствительными бактериями. Однако широкое распространение (особенно © больницах) устойчивых штаммов бактерий приводит ,к увеличению частоты заболеваний, не поддающихся лечению тетрациклином. Выше было отмечено, что миноциклин активен в отношении некоторых -мутантов, устойчивых к другим тетрациклинам. Только длительная клиническая практика покажет, эффективен ли он в отношении широкого круга устойчивых форм.
- ПОБОЧНЫЕ РЕАКЦИИ
Тетрациклины иногда тоже вызывают аллергические реакции, однако значительно реже, чем пенициллины и цефалоспорины. Тем не менее довольно часто при их приеме наблюдаются кишечные расстройства, а в очень высоких дозах тетрациклины могут оказывать токсическое действие на печень. В связи с широким спектром действия, неполным всасыванием и выделением с желчью тетрациклины могут значительно изменять кишечную флору, что приводит к развитию вторичных инфекций (иногда тяжелых), вызываемых дрожжами или устойчивыми штаммами S. aureus. Другой типичный побочный эффект, являющийся следствием накопления тетрациклинов в растущих костях и зубах,— окрашивание зубов в желто-щричневый цвет и обратимое замедление роста костей — наблюдается у детей до 5 лет. Тетрациклины, особенно дезметилхлортетрациклин, часто обладают фотосенсибилизирующим действием, что приводит к развитию эритемы при облучении кожи солнечным светом. Все эти эффекты связаны с общими биологическими свойствами тетрациклинов, поэтому вряд ли новые активные производные не будут вызывать этих побочных реакций.
Источник: Ланчини Д., Паренти Ф., «Антибиотики. Пер. с англ. — М.: Мир. — 272 с., ил.» 1985