VIII. НЕКОТОРЫЕ ДРУГИЕ АНТИБИОТИКИ
В этом разделе сгруппированы отдельные антибиотики, используемые в клинике, которые нельзя отнести ни к одному из описанных выше классов ни по химическим, ни по биологическим свойствам. Мы опишем также два класса антибиотиков, не обсуждавшихся детально, поскольку это не антимикробные средства, а исключительно противоопухолевые препараты. Это нуклеозидные антибиотики и антибиотики-антрациклины.
- НУКЛЕОЗИДНЫЕ АНТИБИОТИКИ
Это аналоги природных нуклеозидов, от которых они отличаются или основанием (пурином или пиримидином), или сахарным остатком. Они не используются в качестве антибактериальных средств, поскольку являются антагонистами природных нуклеозидов во многих ферментативных реакциях и, следовательно, токсичны не только для бактериальных клеток, но и для клеток высших животных. Среди многих известных нуклео- зидных антибиотиков мы отметим только пуромицин, используемый исследователями в качестве ингибитора синтеза белка. Подавление пуромицином синтеза белка основано на его структурном сходстве с концевым нуклеотидом аминоацил-тРНК.
- АНТРАЦИКЛИНЫ
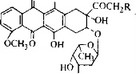
Это гликозильные производные плоской структуры, содержащей четыре кольца и напоминающей тетрациклины. Они заметно отличаются от тетрациклином по механизму действия. Действительно, антрациклины образуют комплексы с ДНК и нарушают как транскрипцию, так и репликацию. Наиболее
о он
nh2
Рис. 5.34. Дауномицин (R=H) и адриамицин (R=OH).
важными антрациклинами являются дауномицин и адриамицин (рис. 5.34), используемые в качестве противоопухолевых препаратов.
- ХЛОРАМФЕНИКОЛ
Хлорамфеникол был выделен в 1947 г. из штамма Streptomyces venezuelae. Хлорамфеникол — первый химиотерапевтический препарат, эффективный ib отношении риккетсий и близких к ним организмов, а также в отношении наиболее важных грамотрицательных и некоторых грамположительных бактерий. Он хорошо всасывается при приеме внутрь. Это наиболее предпочтительный препарат для лечения брюшного тифа и сальмонеллезов. Хлорамфеникол служит также одним из наиболее эффективных средств для лечения инфекционных заболеваний, вызываемых Haemophilus influenzae, Klebsiella pneumoniae и т. д. Антибактериальный спектр действия хлорамфеникола представлен в табл. 2.3.
Терапевтическое использование хлорамфеникола ограничивается возможностью аплазии костного мозга, а также аллергическими реакциями, почти всегда с летальным исходом в тех случаях (примерно один на 40 000), когда они возникают. Проявление аплазии костного мозга не коррелирует с дозой хлорамфеникола, но это осложнение появляется после длительного лечения и его можно предотвратить при постоянном гематологическом обследовании больных. К менее серьезным побочным эффектам относятся анемия, которая является обратимой и зависит от дозы, нарушение функций желудочно-кишечного тракта и — вследствие широкого спектра действия антибиотика — вторичные инфекции, возникающие в результате подавления нормальной бактериальной флоры. В очень высоких дозах антибиотик опасен для грудных детей, так как у них он недостаточно эффективно выводится.
Структурная формула хлорамфеникола представлена на рис. 5.35. Так как в молекуле имеется деа асимметрических центра, возможны четыре стереоизомера. Из них активен только D-треоизомер. Хлорамфеникол — единственный антибиотик, производимый в промыщленных масштабах путем химического синтеза, а не биосинтеза. Исследование многочисленных аналогов хлорамфеникола .позволило установить следующие закономерности взаимосвязи между структурой и активностью.
- Остаток дихлор уксусной кислоты можно замещать без значительной потери активности другими кислотами в том случае, когда последние обладают сильными электроотрицательными свойствами и не создают стерических препятствий.
- Активность зависит от структуры пропандиола, на что указывает тот факт, что активен только один из стереоизоме-
ов. При этерификации первичной гидроксильной группы активность хлорамфеникола, по-видимому, сохраняется в той степени, в какой он может гидролизоваться in vivo. В медицинской Практике используется эфир пальмитиновой кислоты, поскольку он не имеет неприятного вкуса.
•| 3. Нитрогруппу в ароматической части молекулы можно за
менить другими полярными функциональными группами, например метилтио- или метилсульфоновой группой. В химиотерапии довольно успешно используется тиамфеникол (рис. 5.35) —
- производное, несущее последний из двух указанных заместите- V лей.
\ Устойчивость к хлорамфениколу обычно связана с действием инактивирующих ферментов, ацетилирующих одну или обе гид- » роксильные группы. Эти ферменты являются индуцируемыми у 4' S. aureus и конститутивными у Е. coli. У Е. coli синтез фермен- х та кодируется фактором R, который зачастую несет детерминан- § ты устойчивости и к другим антибиотикам.
- ЛИНКОМИЦИН И КЛИНДАМИЦИН
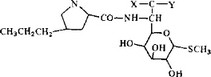
Линкомицин, выделенный в 1962 г. из культуральной жидкости S. lincolniensis, активен в отношении грамположительных бактерий. В химическом отношении (рис. 5.36) его можно рассматривать как аминосахар, ацилированный производным про- I лина. Его биологическая активность напоминает активность антибактериальных макролидов (он подавляет синтез белка, образуя комплекс с бОБ-субчастицами рибосом), и наблюдается частичная перекрестная устойчивость к линкомицину и к макролидам. Высказывалось предположение, что, несмотря на | очевидные отличия в структуре, трехмерная модель линкомици- на имеет некоторую общность с трехмерной моделью эритромицина. Среди многих метильных групп эритромицина три (при этильной группе, при С-2 и в положении 5 кладинозы) могут “• пространственно соответствовать трем метальным группам лин-
| МПК, мкг/мл | |||
| X | У Название | S. aureus 5. pyogenes S. pneumoniae | E. coli |
| он | Н Линкомидин | 0,5 0,05 0,5 | gt;100 |
| н | С1 Клиндамицин | ОД 0,02 0,05 | gt;100 |
|
Рис. 5.36. Линкомидин и клиндамицин. |
|||
комицина (S-метил, метильная группа в положении 8 и метиль- ная группа при пропильной группе). Кроме того, гидроксильная группа в положении 12 макролидо© может отвечать гидроксильной группе в положении 2 линкомицина. Благодаря простоте молекулы линкомицина получено несколько полусинтетических аналогов, которые позволили установить следующие закономерности.
- Ацильную группировку можно модифицировать, причем полученные производные сохраняют активность. Активность увеличивается при увеличении размера алкильной группы в положении 4 остатка цролина.
- Когда метильная группа при атоме серы замещается другой алкильной группой, получаются продукты, которые более активны in vitro, но не in vivo.
- Замещение гидроксильной группы в положении 7 атомом хлора вызывает значительное увеличение активности, если это замещение происходит с обращением конфигурации. Но если конфигурация сохраняется, активность остается прежней.
Путем такой модификации был получен клиндамицин (рис. 5.36), который используют в клинике благодаря большей активности в отношении грамположительных и анаэробных бактерий. Интересно также, что он обладает активностью в отношении Plasmodium berghei. Более высокая антибактериальная активность клиндамицина, по-видимому, обусловлена его лучшим проникновением в бактериальные клетки. В бесклеточных системах оба антибиотика обладают одинаковой активностью. Отсутствие активности у этих антибиотиков в отношении грамотрицательных организмов, вероятно, связано с меньшей чувствительностью к ним рибосом грамотрицательных бактерий.
Ограничения при использовании этих антибиотиков более или менее близки к таковым для эритромицина. Однако при нутримышечном введении линкомицин переносится лучше. Линкомицин и клиндамицин часто оказывают побочное действие, в основном на кишечник, которое иногда может носить серьезный характер (геморрагические колиты).
- НОВОБИОЦИН И КУМЕРМИЦИНЫ
Новобиоцин (рис. 5.37), открытый в 1956 г., активен в отношении грамположительных бактерий и некоторых штаммов Proteus. Этот антибиотик принимают внутрь, но в настоящее время он применяется менее широко, чем раньше, из-за некото-
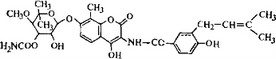
Рис. 5.37. Новобиоцин.
рых побочных эффектов и не слишком высокой эффективности.
Кумермицины по химическим и биологическим свойствам близки новобиоцину. Это семейство антибиотиков, (впервые описанное в 1965 г., послужило основой для получения значительного числа полусинтетических производных. Наиболее эффективное природное соединение, кумермицин А, исследовалось в клинике, но оказалось, что его трудно вводить и что оно не очень эффективно. Одно из полусинтетических производных более активное, но его нельзя использовать из-за гепатотоксиче- ского действия.
- ФУЗИДИЕВАЯ КИСЛОТА
Этот антибиотик активен в отношении грамположительных организмов. Он был выделен в 1962 г. из культуры гриба Fusi- dium coccineum. Фузидиевая кислота имеет стероидную структуру (рис. 5.38), как и некоторые другие антибиотики, образуемые грибами (например, цефалоспорин Р и гельволовая кислота). Получены производные фузидиевой кислоты, однако они не обладают какими-либо интересными свойствами. Фузидиевая кислота всасывается при приеме внутрь и часто используется в комбинации с пенициллином.
- ГРИЗЕОФУЛЬВИН
Этот продукт метаболизма Penicillium griseofutvum был выделен и описан и 1939 г. (рис. 5.39) и считался в течение нескольких лет неактивным. В 1947 г. было показано, что он идентичен «фактору скручивания гиф» — противогрибковому веществу, образуемому другими пенициллами.
Только в 1958 г. установили, что гризеофульвин эффективен при микозах кожи, и этот препарат получил применение в клинической практике. In vitro он активен в отношении дерматофи- тов (Microsporium, Epidermophyton, Trichophyton), но не действует на другие патогенные грибы. Гризеофульвин действует системно, концентрируясь в глубоких слоях кожи и в кератино- вых клетках. Обычно он хорошо переносится больными. Наиболее часто наблюдаемым побочным эффектом является преходящая головная боль.
Ни одно из многочисленных полусинтетических производных гризеофульвина не обладает такой же активностью, как исходный препарат.
- ВАНКОМИЦИН
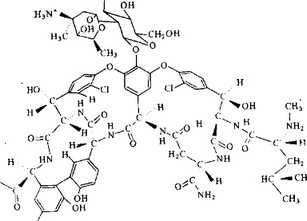
Ванкомицин был выделен из культуральной жидкости No- cardia orfientalis в 1956 г. Это сложный гликопептид, содержащий глюкозу и аминосахар ванкозамин, а также аминокислоты
ОН
ОН
Рис. 5.40. Ванкомицин.
N-метиллейцин, аспарагиновую кислоту, фенилглицин и хлор-р- окситирозин (рис. 5.40). Этот препарат обладает бактерицидным действием в отношении растущих бактерий. Никаких мутантов, устойчивых к ванкомицину, не обнаружено. Препарат вводят внутривенно при лечении опасных для жизни стафилококковых инфекций, устойчивых к действию других антибиотиков. Ванкомицин принимают также внутрь при лечении стафилококковых энтероколитов. Сравнительно недавно было показано, что он эффективен для лечения и профилактики колитов, вызываемых Clostridium difficile, связанных с применением других антибиотиков, в особенности линкомицина и клиндамицина.
Главными недостатками ванкомицина являются неактивность при приеме внутрь или при внутримышечном введении (если не считать лечения стафилококковых энтероколитов), а также появление флебитов на месте введения.
Другими членами этого семейства антибиотиков являются ристоцетины, ристомицины, маннопептины, авопарцин, актинзи- ден, тейхомицины. В химическом отношении они отличаются друг от друга типом и количеством сахарных остатков, типом аминокислот, числом атомо© хлора и общим зарядом молекулы.
Источник: Ланчини Д., Паренти Ф., «Антибиотики. Пер. с англ. — М.: Мир. — 272 с., ил.» 1985