БИОТОКСИН БОЛЬШЕГОЛОВА АТЛАНТИЧЕСКОГО
Расширение ассортимента вылавливаемых морских организмов с пищевыми целями, также как и освоение новых районов лова, ставит на повестку дня ряд специальных проблем, среди которых весьма актуальной представляется необходимость тщательного исследования новых объектов вылова на возможное наличие нежелательных веществ, и в первую очередь биотоксинов. Такая необходимость возникает в связи с довольно широким распространением биотоксинов в морских организмах как вследствие наличия гидробионтов, продуцирующих токсические соединения (например, в настоящее время обнаружено уже более 700 видов ядовитых рыб), так и возможной трансмиссии биотоксинов по пищевым цепям. В этом случае токсины, синтезируемые одними морскими организмами, после поедания их другими организмам могут заноситься в другие географические зоны. И наоборот, неядовитые гидробионты, мигрируя в различные регионы Мирового океана, могут поедать организмы, продуцирующие биотоксины, становясь в новых для неядовитых гидробионтов районах опасным источником биотоксинов. Быстрое определение наличия биотоксинов в новых объектах вылова или в объектах вылова в новых географических районах, где пищевой базой гидробионтов могут быть и ядовитые организмы, позволит избежать непроизводительных затрат и оперативно изменять промысловую обстановку в районе действия рыболовных судов. В связи с освоением отечественным рыболовным флотом новых районов Мирового океана и новых объектов вылова, необходимость разработки быстрых и надежных методов определения возможного наличия биотоксинов в гидробионтах, а также эффективных способов детоксикации и комплексной утилизации сырья становится важной задачей рыбохозяйственной науки.
С практической точки зрения особого внимания в сложившихся условиях требуют к себе объекты вылова в новых регионах тропической части Тихого и Индийского океанов, известных наличием большого числа ядовитых морских организмов (планктонные организмы, водоросли, беспозвоночные, членистоногие и рыбы), которые могут поедаться гидробионтами, в частности и мигрирующими из других областей Мирового океа-
w
на. В этом случае даже известные как заведомо неядовитые рыбы, находясь в новых условиях, требуют осторожного отношения и проведения соответствующих исследований. В качестве иллюстрации представляется целесообразным привести выполненное нами исследование промысловой рыбы большеголова атлантического (Hoplostethus atlanticus). Большеголов атлантический был выловлен летом 1977 г. в районе Новозеландского гцельфа. Предварительные биологические исследования, проведанные в другой лаборатории, указывали на наличие в тканях большеголова атлантического неизвестных токсических веществ, вызывающих диарею и задержку роста подопытных животных.
В лаборатории изучению подверглись особи обоего пола длиной 35—40 см и массой 1,0—1,3 кг, причем отдельно исследовали липиды, икру, молоки, внутренности, печень, плавники, головной и спинной мозг, мышечную ткань. Исследуемую ткань измельчали сначала на мясорубке, а затем гомогенизировали с двойным объемом метилового спирта в размельчителе тканей РТ-1 при 8000 оборотов в минуту в течение 3 мин (выбор метанола основывается на экспериментальных данных: вытяжки, полученные из указанных тканей с использованием эфира, хлороформа, бензола, этанола и других органических растворителей, не оказывали токсического действия на лабораторных животных). Полученный гомогенизат взбалтывали еще в течение 15 мин, после чего оставляли в покое на 4 ч. Надосадочную жидкость отфильтровывали, остаток отжимали, отфильтровывали и полученный фильтрат присоединяли к первому фильтрату. Объединенные фильтраты концентрировали в вакууме до 1/2 первоначального объема и полученную жидкость перемешивали с 5 объемами ацетона, после чего доводили pH ацетонового раствора до 6,8 с помощью разбавленной гидроокиси аммония. Образовавшуюся суспензию оставляли седиментироваться в течение 10 ч. Надосадочную жидкость декантировали, осадок суспендировали в 5-кратном количестве дистиллированной воды в течение 1 ч, затем суспензию фильтровали. Остаток отбрасывали, фильтрат доводили разбавленной гидроокисью аммония до pH 7,00±0,05. Очистку выделенного вещества осуществляли хроматографически, с использованием ионообменных смол КРК-1-5П, АРА-8П и КРК-1-12П. После перекристаллизации из метанола было выделено вещество, представляющее собой белого цвета кристаллический продукт, темнеющий при нагревании выше 326°С. Вещество не растворяется в хлороформе, эфире, хорошо растворяется в метаноле и воде. Водные растворы образуют с пикриновой кислотой характерные кристаллы, напоминающие пикрат тетродотоксина. Выделенное из большеголова атлантического вещество в опытах характеризуется весьма высокой токсичностью, вызывая быструю гибель подопытных животных с явлениями быстро наступающего паралича задних конечностей и последующим тетаническим сокращением всей поперечнополосатой мускулатуры тела животного. Это вещество в дальнейшем именуется «нейротоксином».
Анализ ИК- и ЯМР-спектров образцов изолированного иЗ большеголова нейротоксина указывает на наличие в его молекуле гидроксильных, карбонильных, метоксильных групп и ароматического кольца. Масс-спектрограмма не выявляет ионных пиков (ИК-спектр представлен на рис. 1). I
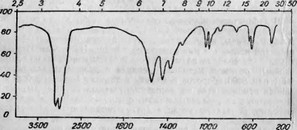
Рис. 1
ИК-спектр нейротоксина из Hoplostethus atlanticus
Хроматографические характеристики нейротоксина очень близки к характеристикам распространенного биотоксина — тетродотоксина. В качестве систем использовали смеси: изопропанол—уксусная кислота—вода (70:5:25), н-бутанол—уксусная кислота—вода (2:1:1). Однако нейротоксин, изолированный из большеголова атлантического, обладает значительно большей полярностью, чем тетродотоксин.
Эмиссионный анализ образцов выделенного нейротоксина (прибор ИСП-30) показал наличие следующих элементов: железо (0,001%), кремний (0,003%), магний (0,03—0,05%), алюминий (0,01%), кальций (0,01%), натрий (3%).
Все ткани и органы рыбы импрегнированы нейротоксином. Однако наибольшая концентрация нейротоксина установлена в печени, полостном жире, нервной ткани, плавниках и жабрах. Содержание нейротоксина в мышечной ткани относительно невелико и в среднем в 1—20 раз ниже его концентрации в печени рыбы (при общем содержании нейротоксина 50 ЕД на 1 кг массы рыбы, включая внутренние органы, только 3—5 ЕД приходятся на мышечную ткань). Характерны также значительные колебания концентрации нейротоксина в различных экземплярах рыбы от 15 до 1000 ЕД (на 1 цельный образец). Всего из 100 кг цельных рыб большеголова атлантического было изолиг
ровано около 8 г кристаллически чистого нейротоксина. Минимальная смертельная доза нейротоксина при внутрибрюшинном введении составляет для мышей 1,8—2,9 мкг/г.
Нейротоксин обладает центральным действием, характеризующимся двухфазностью. Преобладающий фон для первой фазы — развитие параличей (задние конечности, передние конечности, расслабление сфинктеров, сопровождающееся частой дефекацией, мочеиспусканием); эта фаза отмечается, начиная от конца первой минуты и длится до 6—9 мин после инъекции нейротоксина. Вторая фаза характеризуется неожиданным те- таническим сокращением мускулатуры животного и молниеносной его смертью.
Было предположено, что нейротоксин не является эндогенным для большеголова атлантического, а обусловлен замыканием цепи питания на ядовитых гидробионтах, которыми, по нашему мнению, могут быть токсичные моллюски, ядовитые водоросли или кораллы. Одним из возможных пищевых объектов для большеголова атлантического является моллюск На- palochlaena maculosa, известный своей токсичностью, так как содержит макулотоксин. Для проверки предположения было проведено сравнительное исследование макулотоксина и нейротоксина.
Макулотоксин был изолирован из цельного осьминога Octopus maculosus, выловленного летом 1977 г. Оба соединения (нейротоксин и макулотоксин), а также и тетродотоксин характеризуются близкими, но не совпадающими значениями Rf (ТСХ), близкими ИК-спектрами, отсутствием характерного максимума поглощения водных растворов в УФ-области и сигналов протонов в спектре ЯМР (растворы в дейтерированной воде).
При нагревании выше 300°С и нейротоксин из большеголова атлантического, и макулотоксин не плавятся, а обугливаются. В фармакологическом отношении оба биотоксина проявляют определенные черты сходства, хотя макулотоксин более активен и вызывает гибель подопытных животных с явными признаками асфиксии без явлений двигательного возбуждения и тетаниче- ских судорог, характерных для нейротоксина из большеголова атлантического. Токсическое действие тетродотоксина также отличается от эффектов смертельных доз нейротоксина. На основании проведенного исследования можно высказать предположение, что наличие значительных флюктуирующих от особи к особи концентраций нейротоксина в тканях большеголова атлантического связано с поеданием рыбой гидробионтов, содержащих биотоксины нейротропного действия типа описанных в литературе макулотоксина и тетродотоксина. Очевидно, в процессе метаболизма структура экзогенного биотоксина претерпела существенные изменения, что привело к изменению фармакологических свойств и к образованию нового биотоксина.
Одним из наиболее интересных БЛВ моря, несомненно, является тетродотоксин, различные эффекты которого находили применение еще в древней медицине. Современные исследования показали, что тетродотоксин, имеющий уникальную химическую структуру, обладает широким спектром физиологического действия: вызывает понижение артериального давления, изменение биопотенциалов, оказывает мощное обезболивающее действие, регулирует пассаж ионов натрия в клеточной мембране и т. д.
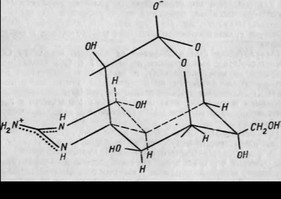
В то же время тетродотоксин — один из сильнейших ядов, синтез и накопление которого отмечаются у нескольких десятков видов рыб, причем у отдельных представителей концентрация тетродотоксина в тканях достигает поразительных величин. Например, содержание тетродотоксина в печени Fugu niphobles составляет 1 мг на 1 г веса (летальная доза для человека составляет 0,8 мг).
В настоящее время тетродотоксин (рис. 2) в ряде случаев применяется в качестве обезболивающего средства при нейрогенной форме проказы и неоперабельных формах опухолевых заболеваний. За рубежом разработаны различные сочетания тетродотоксина с местными анестетиками, а также инъекционные формы хлористоводородной соли тетродотоксина в качестве анестетика дюрантного типа действия.
В эксперименте установлено, что в дозе от 1 до 12 мкг при спинномозговом введении тетродотоксин обеспечивает обезболивание соответствующих областей тела в течение 1—5 суток.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. 1 г печени Fugu niphob- les гомогенизируют в 2 объемах метанола в размельчителе тканей РТ-1 при 8000 оборотов в минуту в течение 3 мин. Полученный гомогенизат разводят метанолом до 2,5 л и перемешивают в течение 5 мин, после чего подкисляют 16%-ным раствором серной кислоты в метаноле до образования суспензии с pH 1,67 и вновь перемешивают 2,5 ч при комнатной температуре. Суспензию фильтруют через складчатый фильтр, остаток реэкстрагируют 1,25 л подкисленного метанола и фильтруют.
Объединенные фильтраты перемешивают с 5 объемами ацетона при комнатной температуре и доводят pH разбавленной гидроокисью аммония до значения 6,8, после чего вновь перемешивают в течение 1 ч и оставляют отстаиваться на 10 ч. Надосадочную жидкость декантируют, а осадок суспендируют в 150 мл дистиллированной воды в течение 1 ч и фильтруют через складчатый фильтр. Осадок реэкстрагируют небольшим количеством воды. Водные фракции объединяют и доводят pH до 0,7.
ОЧИСТКА ТЕТРОДОТОКСИНА МЕТОДОМ ИОНООБМЕННОЙ КОЛОНОЧНОЙ ХРОМАТОГРАФИИ. Применяют слабокислотный катионит отечественного производства КРК-1-5П (ТУ 10П 403-70), фракция 0,25—0,50 мм, емкость по 0,1 н. раствору NaOH мг/экв/г не менее 9,5, удельный объем набухшего в воде катионита не менее 1,5—2,5 мг/г. Катионит применяют в солевой форме (NH+). Влажный катионит в стакане заливают дистиллированной водой и, размешав, переносят в два приема на стеклянную хроматографическую колонку (80X2).
Объединенные водные фракции, содержащие тетродотоксин, с pH 7,0 наносят на подготовленную колонку с ионообменной смолой, поддерживая скорость вытекания 2—3 капли в минуту, при этом pH вытекающей жидкости равно 7,1. После нанесения токсина колонку тщательно промывают дистиллированной водой. Элюируют БАВ 240 мл 10|%-ного раствора уксусной кислоты и затем 300 мл дистиллированной воды. Анализ фракций на содержание тетродотоксина осуществляют микрокристалло- скопическим методом. Микрокристаллы пикрата тетродотоксина имеют характерную форму. Фракции, содержащие токсин, концентрируют в вакууме до 150 мл.
К концентрату добавляют анионит АРА-8П (ОН-форма, фракция 0,25—0,50 мм, ТУ 6-09-846-73) до образования раствора с pH 6,5±0,05. Анионит затем отделяют на стеклянном фильтре № 4 и промывают небольшими аликвотными количествами дистиллированной воды, объединяют все жидкие фазы и наносят на колонку с катионитом. КРК-Ы2П в натриевой форме (йа+-форма). Слабокислотный катионит отечественного производства КРК-1-12П (ТУ 10П 542-71), фракция 0,25— 0,50 мм, емкость по 0,1 н. раствору NaOH мг/экв/г не менее
- удельный объем набухшего катионита в воде не менее
- 2,3 мг!г, применяют в натриевой форме.
Раствор тетродотоксина с pH 6,5+0,05 наносят на колонку в количестве 1/15 объема раствора на объем смолы в час, при этом pH выходящей жидкости составляет 7,3. После нанесения раствора БАВ колонку промывают 2,5 объемами дистиллированной воды и элюируют 1 н. раствором уксусной кислоты со скоростью, равно i скорости нанесения. Тетродотоксин элюируют в диапазоне pH от 6,5 до 4,0. Фракции на содержание тетродотоксина контролируют микрокристаллоскопическим методом с пикриновой кислотой. Фракции, содержащие тетродотоксин, концентрируют в вакууме до 50 мл и доводят pH концентрата до 6,0 с помощью анионита АРА-ЬП в гидроксильной форме. Анионит отделяют на стеклянном фильтре № 4 и промывают небольшими равными количествами дистиллированной воды; pH объединенных растворов доводят разведенным карбонатом^ натрия до 8,2 и оставляют осаждаться на 24 ч при комнатной температуре. Осадок отделяют центрифугированием и промывают небольшим количеством воды.
Осажденный тетродотоксин растворяют в небольшом количестве разведенной уксусной кислоты при pH 4,8—5,0. Нерастворимый осадок отделяют центрифугированием, pH супернатанта доводят до 7,0 разведенным карбонатом натрия. При появлении кристаллов тетродотоксина продолжают добавлять карбонат натрия до pH 8,2. Центрифугируют для отделения кристаллов тетродотоксина и промывают их небольшим количеством дистиллированной воды. Повторяют кристаллизацию 3—4 раза с целью более полной очистки тетродотоксина. Степень очистки тетродотоксина определяют с помощью хроматографии в тонком слое сорбента.
Многократно переосажденный кристаллический тетродотоксин идентифицируют по Mosher et al., (1964), Goto et al. (1965): Цл. — образцы темнеют начиная с 225—227°С и не плавятся при 300°С; тонкослойная хроматография в системе эта- нол—4%-ная ледяная уксусная кислота; проявитель — раствор 0,5 г йода в 100 мл хлороформа с последующим нагреванием при температуре 200°С в течение 5 мин (Rf 0,3), ИК-спектро- метрия и биологическое тестирование (назначение раствора тетродотоксина белым мышам вызывает гибель всех животных от асфиксии в течение 1—7 мин). Наименьшая доза токсина, убивающая^ белую мышь весом 20 а в течение 10 мин, равна 1 мышечной единице (ME). LD100 при подкожном введении — 0,005 мг/кг. Биологическая активность 1 мг тетродотоксина — не менее 7000 ME.