ГОЛОТУРИИ
Из индивидуальных БАВ морских организмов существенную научно-медицинскую значимость представляет голотурии. Голотурии -— тритерпеновый (стероидный) сапонин, содержащийся в кювьеровых органах многих видов морских огурцов: впервые был выделен в начале 50-х годов Nigrelli et al. (1952) (США).
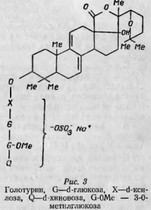
Это слабоокрашенный порошок, хорошо растворимый в воде, являющийся комплексом химически весьма близких генинов и сахаров (ксилоза, d-глюкоза, 3-0-метил-глюкоза и d-хиновоза) (рис. 3).
 Основное биологическое действие голотурина — влияние на рост и дифференциацию быстро пролиферирующих тканей и клеток (цитостатическое действие), а также стимулирование фагоцитоза, гемолитическое действие и блокирование нервно- мышечной передачи. Особый интерес представляет открытое еще в 50-е годы цитостатическое (противораковое) действие голотурина в отношении саркомы-180 и асцитной опухоли Кребс-2.
Основное биологическое действие голотурина — влияние на рост и дифференциацию быстро пролиферирующих тканей и клеток (цитостатическое действие), а также стимулирование фагоцитоза, гемолитическое действие и блокирование нервно- мышечной передачи. Особый интерес представляет открытое еще в 50-е годы цитостатическое (противораковое) действие голотурина в отношении саркомы-180 и асцитной опухоли Кребс-2.
Основным методом выделения голотурина является мацерация с последующей экстракцией кювьеровых органов е помощью воды или водных растворов с последующей хроматографической очисткой и идентификацией голотурина хроматографическим методом,
ИК-спектрометрией и биологическими опытами (рыбы, лабораторные животные).
Значительные запасы морских огурцов на Дальнем Востоке (за одно траление поднимают 12—15 ц голотурий) позволяют предположить возможность организации промышленной разработки этого весьма ценного БАВ гидробионтов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. 2,5 кг изрезанной и измельченной в размельчителе тканей при 8000 оборотов в минуту в течение 2 мин в среде горячей дистиллированной воды (общее количество воды — 5 л) голотурии японской (Stichopus japonica) кипятят в течение 15 мин, после чего фильтруют через промытый водой и ацетоном цилиндрический складчатый фильтр на большой воронке Бюхнера без вакуума. Скорость фильтрования — 75 мл)ч. Все операции по переливанию водного экстракта из одного сосуда в другой следует производить осторожно. По окончании фильтрования остаток на фильтре промывают небольшим (150—200 мл) количеством горячей дистиллированной воды и присоединяют к фильтрату. Последний упа-
* Выпарительную колбу заполняют не более, чем на 1,5 объема вслед- вие сильного ненообразования при упаривании. Упаривание проводят со стеклянной ловушкой.
ривают в вакууме* до объема 500 мл и смешивают с 96%-ным этиловым спиртом до достижения концентрации 63—64% (500 мл экстракта доводят спиртом до объема 1583 мл). При этом выпадает темный осадок, который отделяют фильтровав нием. Осадок на фильтре однократно промывают 300 мл слегка подогретого 64%-ного этилового спирта и присоединяют его к фильтрату. Спиртовый раствор сапониновой фракции упаривают в вакууме до объема 80—90 мл. Сгущенный (до сметанообразного состояния) раствор вливают в 2000 мл 96%-ного этилового спирта (вливают именно водный раствор в спирт, а не наоборот, во избежание комкования), при этом выпадает светло-бежевый осадок сапониновой фракции в количестве 18—20 г. Осадок отфильтровывают на стеклянном фильтре № 2, промывают 100 мл 96%-ного этилового спирта и высушивают в вакууме.
Сухой экстракт растворяют в 85%-ном этиловом спирте при 55°С и перемешивании и оставляют на сутки для кристаллизации сапонина, который выпадает из раствора при изогидричной кристаллизации в виде продолговатых частичек светло-желтоватого цвета. Их отделяют, промывают небольшим количеством спирта и высушивают в вакууме (масса образца — 3 г).
Анализ. Тонкослойная хроматограмма высушенного образца проводилась в системе н-бутанол—этанол—вода (4:1:2, Yasumoto et al., 1967).
С целью идентификации агликона (сапогенина) и сахаров выполняли гидролиз. С этой целью 1 г сухого образца растворяли в нескольких миллилитрах воды и доводили 1 н. НС1 до объема 80 мл. Полученный раствор нагревали на кипящей водяной бане в течение 4 ч, после чего отделяли выпавший хлопьевидный осадок сапогенина, промывали теплой водой и высушивали в вакууме. Раствор сахаров нейтрализовали 10%-ным раствором аммиака.
Раствор сахаров дает характерную реакцию с реактивом Фелинга: при кипячении 1 мл раствора с 5 мл реактива выпадает кирпично-красный осадок.
Тонкослойные хроматограммы раствора сахаров в системах бензол—ледяная уксусная кислота—метанол (2:2:6) и водный фенол (фенол—вода; 9:1) показывают наличие пятен с Rf 0,59 (ксилоза), 0,63 (глюкоза) и 0,67 (рамноза). В системе фенол— вода наблюдается четвертое пятно (З-О-метил-й-глюкоза).
Тонкослойная хроматограмма генина в системе бензол—ацетон (4:1) (Yasumoto et al., 1967) выявила голотуриногенин.
Определение температуры плавления с использованием нагревательного столика Кофлера дало следующие результаты: (пл. образца 255—257°С, tDJI. агликона 280—282°С.
Биологическое испытание на белых мышах показало, что внутрибрюшинное введение 1 мг образца в 0,2 мл воды для инъ-
екций вызывает гибель животного в течение 24 ч. Для идентификации был снят ИК-спектр голотурина.
Данные, полученные в результате применения ТСХ, ИК-спектрометрии, а также при измерении температуры плавления и биологическом испытании позволяют идентифицировать выделенное при экстракции голотурии японской вещество как голотурии А, а его гении как голотурогенин.
Это слабоокрашенный порошок, хорошо растворимый в воде, являющийся комплексом химически весьма близких генинов и сахаров (ксилоза, d-глюкоза, 3-0-метил-глюкоза и d-хиновоза) (рис. 3).
 Основное биологическое действие голотурина — влияние на рост и дифференциацию быстро пролиферирующих тканей и клеток (цитостатическое действие), а также стимулирование фагоцитоза, гемолитическое действие и блокирование нервно- мышечной передачи. Особый интерес представляет открытое еще в 50-е годы цитостатическое (противораковое) действие голотурина в отношении саркомы-180 и асцитной опухоли Кребс-2.
Основное биологическое действие голотурина — влияние на рост и дифференциацию быстро пролиферирующих тканей и клеток (цитостатическое действие), а также стимулирование фагоцитоза, гемолитическое действие и блокирование нервно- мышечной передачи. Особый интерес представляет открытое еще в 50-е годы цитостатическое (противораковое) действие голотурина в отношении саркомы-180 и асцитной опухоли Кребс-2.
Основным методом выделения голотурина является мацерация с последующей экстракцией кювьеровых органов е помощью воды или водных растворов с последующей хроматографической очисткой и идентификацией голотурина хроматографическим методом,
ИК-спектрометрией и биологическими опытами (рыбы, лабораторные животные).
Значительные запасы морских огурцов на Дальнем Востоке (за одно траление поднимают 12—15 ц голотурий) позволяют предположить возможность организации промышленной разработки этого весьма ценного БАВ гидробионтов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. 2,5 кг изрезанной и измельченной в размельчителе тканей при 8000 оборотов в минуту в течение 2 мин в среде горячей дистиллированной воды (общее количество воды — 5 л) голотурии японской (Stichopus japonica) кипятят в течение 15 мин, после чего фильтруют через промытый водой и ацетоном цилиндрический складчатый фильтр на большой воронке Бюхнера без вакуума. Скорость фильтрования — 75 мл)ч. Все операции по переливанию водного экстракта из одного сосуда в другой следует производить осторожно. По окончании фильтрования остаток на фильтре промывают небольшим (150—200 мл) количеством горячей дистиллированной воды и присоединяют к фильтрату. Последний упа-
* Выпарительную колбу заполняют не более, чем на 1,5 объема вслед- вие сильного ненообразования при упаривании. Упаривание проводят со стеклянной ловушкой.
ривают в вакууме* до объема 500 мл и смешивают с 96%-ным этиловым спиртом до достижения концентрации 63—64% (500 мл экстракта доводят спиртом до объема 1583 мл). При этом выпадает темный осадок, который отделяют фильтровав нием. Осадок на фильтре однократно промывают 300 мл слегка подогретого 64%-ного этилового спирта и присоединяют его к фильтрату. Спиртовый раствор сапониновой фракции упаривают в вакууме до объема 80—90 мл. Сгущенный (до сметанообразного состояния) раствор вливают в 2000 мл 96%-ного этилового спирта (вливают именно водный раствор в спирт, а не наоборот, во избежание комкования), при этом выпадает светло-бежевый осадок сапониновой фракции в количестве 18—20 г. Осадок отфильтровывают на стеклянном фильтре № 2, промывают 100 мл 96%-ного этилового спирта и высушивают в вакууме.
Сухой экстракт растворяют в 85%-ном этиловом спирте при 55°С и перемешивании и оставляют на сутки для кристаллизации сапонина, который выпадает из раствора при изогидричной кристаллизации в виде продолговатых частичек светло-желтоватого цвета. Их отделяют, промывают небольшим количеством спирта и высушивают в вакууме (масса образца — 3 г).
Анализ. Тонкослойная хроматограмма высушенного образца проводилась в системе н-бутанол—этанол—вода (4:1:2, Yasumoto et al., 1967).
С целью идентификации агликона (сапогенина) и сахаров выполняли гидролиз. С этой целью 1 г сухого образца растворяли в нескольких миллилитрах воды и доводили 1 н. НС1 до объема 80 мл. Полученный раствор нагревали на кипящей водяной бане в течение 4 ч, после чего отделяли выпавший хлопьевидный осадок сапогенина, промывали теплой водой и высушивали в вакууме. Раствор сахаров нейтрализовали 10%-ным раствором аммиака.
Раствор сахаров дает характерную реакцию с реактивом Фелинга: при кипячении 1 мл раствора с 5 мл реактива выпадает кирпично-красный осадок.
Тонкослойные хроматограммы раствора сахаров в системах бензол—ледяная уксусная кислота—метанол (2:2:6) и водный фенол (фенол—вода; 9:1) показывают наличие пятен с Rf 0,59 (ксилоза), 0,63 (глюкоза) и 0,67 (рамноза). В системе фенол— вода наблюдается четвертое пятно (З-О-метил-й-глюкоза).
Тонкослойная хроматограмма генина в системе бензол—ацетон (4:1) (Yasumoto et al., 1967) выявила голотуриногенин.
Определение температуры плавления с использованием нагревательного столика Кофлера дало следующие результаты: (пл. образца 255—257°С, tDJI. агликона 280—282°С.
Биологическое испытание на белых мышах показало, что внутрибрюшинное введение 1 мг образца в 0,2 мл воды для инъ-
екций вызывает гибель животного в течение 24 ч. Для идентификации был снят ИК-спектр голотурина.
Данные, полученные в результате применения ТСХ, ИК-спектрометрии, а также при измерении температуры плавления и биологическом испытании позволяют идентифицировать выделенное при экстракции голотурии японской вещество как голотурии А, а его гении как голотурогенин.