МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ФАРМАКОКИНЕТИЧЕСКИХ ПРОЦЕССОВ
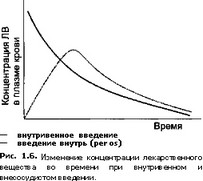
Величина и продолжительность фармакологического эффекта во многом определяется концентрацией лекарственного вещества (ЛВ) в тех органах или тканях, где оно оказывает свое действие. Поэтому очень важно поддерживать определенную (терапевтическую) концентрацию ЛВ в месте его действия. Однако в большинстве случаев концентрацию вещества в тканях определить практически невозможно, поэтому при фармакокинетических исследованиях определяют концентрации ЛВ в плазме крови, которые для большинства веществ коррелируют с их концентрациями в органах-мишенях.
В результате всасывания, распределения, депонирования и элиминации (биотрансформации и выведения) ЛВ его концентрация в плазме крови изменяется. Эти изменения могут быть отражены графически. Для этого концентрацию лекарственного вещества измеряют в плазме крови сразу и через определенные промежутки времени после его введения и на основании полученных данных строят кривую изменения концентрации Л В во времени, или так называемую фармакокинетическую кривую (рис. 1.6).
Для того чтобы количественно оценить влияние процессов всасывания, распределения депонирования и элиминации на концентрацию ЛВ в крови, используют математические фармакокинетические модели. Различают однокамерные, двухкамерные и многокамерные фармакокинетические модели.
В однокамерной модели организм условно представляют в виде камеры, заполненной жидкостью. Вещество может поступать в камеру постепенно, как при введении внутрь (или других внесосудистых путях введения), или мгновенно, как при;быстром внутривенном введении (рис. 1.7).
Выведение , r v Биотрансформация
Элиминация
Рис. 1.7. Однокамерная фармакокинетическая модель.
V^volume of distribution) - объем распределения вещества в камере; D - количество вещества, введенное в камеру; С0 - начальная концентрация вещества в камере.
После поступления вещества в камеру в количестве D оно распределяется мгновенно и равномерно и занимает объем камеры, при этом концентрация вещества, которая создается в камере, обозначается как начальная концентрация - Сс. Объем распределения вещества в камере - Vd (volume of distribution) = D/Cc.
В клинической практике используют параметр, который получил название кажущийся объем распределения (apparent volume of distribution, Vd).
Кажущийся объем распределения — гипотетический объем жидкости организма, в котором лекарственное вещество распределено равномерно и при этом находится в концентрации, равной концентрации данного вещества в плазме крови (Ср). Соответственно, кажущийся объем распределения Vd = Q/Cp где Q — количество вещества в организме при концентрации в плазме крови Ср.
Если допустить, что вещество после внутривенного введения в дозе D мгновенно и равномерно распределилось в организме, то кажущийся объем распределения Vd = D/Cc, где Сс - начальная концентрация вещества в плазме крови.
Кажущийся объем распределения позволяет судить о том, в каком соотношении распределяется вещество между жидкостями организма (плазмой крови, интерстициальной, внутриклеточной жидкостями). Так, если величина Vd какого- либо вещества имеет значение, приблизительно равное 3 л (средний объем плазмы
крови), это значит, что данное вещество преимущественно находится в плазме крови. Такой объем распределения характерен для крупномолекулярных соединений, которые практически не проникают в клетки крови и через эндотелий сосудов (не выходят за пределы сосудистого русла), например, для гепарина (Vd — около 4 л).
Если Vd равен 15 л (сумма средних объемов плазмы крови и интерстициальной жидкости), вещество преимущественно находится в плазме крови и интерстициальной жидкости (во внеклеточной жидкости), т.е. не проникает внутрь клеток. Предположительно это гидрофильное соединение, которое не проходит через клеточные мембраны. К таким веществам относятся аминогликозидные антибиотики (гентамицин, тобрамицин). Поэтому эти антибиотики практически не оказывают действие на микроорганизмы, находящиеся внутри клеток, т.е. неэффективны в отношении внутриклеточных инфекций.
Некоторые лекарственные вещества имеют объем распределения порядка 40 л (средний объем всех жидкостей организма). Это означает, что они находятся как во внеклеточной, так и во внутриклеточной жидкостях организма, т.е. проникают через мембраны клеток. В основном так распределяются в организме липофильные неполярные соединения.
Если величина Vd лекарственного вещества значительно превышает объем жид^ костей организма, это вещество скорее всего депонировалось в периферических тканях, и его концентрация в плазме крови чрезвычайно мала. Большие значения объема распределения характерны для трициклических антидепрессантов имипрамина и амитриптилина (Vd - порядка 1600 л ). Такие Л В не могут быть эффективно удалены из организма с помощью гемодиализа.
После мгновенного и равномерного распределения вещества в объеме камеры и достижения концентрации С0 концентрация вещества в камере постепенно снижается при участии двух процессов — биотрансформации и экскреции (см. рис. 1.7). Оба эти процесса объединяются термином элиминация.
Для большинства лекарственных веществ скорость элиминации зависит от концентрации вещества (чем меньше концентрация вещества, тем меньше скорость элиминации). При этом кривая изменения концентрации вещества во времени имеет экспоненциальный характер (рис. 1.8). Такая элиминация соответствует кинетике 1-го порядка (в единицу времени элиминируется определенная часть вещества!.
Основными параметрами, характеризующими процесс элиминации, являются константа скорости элиминации (ке1, ке) и период полуэлиминации (t1/2).
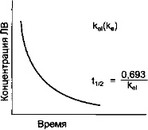
Рис. 1.8. Элиминация вещества, соответствующая кинетике первого порядка.
ке, (ке) - константа скорости элиминации 1-го порядка; tI/2 - период полуэлиминации.
Константа скорости элиминации 1-го порядка показывает, какая часть вещества элиминируется из организма в единицу времени (размерность мин-1, ч-1). Например, если keI какого-либо вещества, которое ввели внутривенно в дозе 100 мг, составляет 0,1 ч-1, то через 1 ч количество вещества в крови будет равно 90 мг, а через 2 ч - 81 мг и т.д.
Немногие лекарственные вещества (этанол, фенитоин) элиминируются в соответствии с кинетикой нулевого порядка. Скорость такой элиминации не зависит от концентрации вещества и является постоянной величиной, т.е. в единицу времени элиминируется определенное количество вещества (например, за 1 ч элиминируется 10 г чистого этанола). Связано это с тем, что при терапевтических концентрациях названных веществ в крови происходит насыщение ферментов, метаболизирующих эти вещества. Поэтому при увеличении концентрации таких веществ в крови скорость их элиминации не повышается.
Период полуэлиминации (tI/2, half-life) - время, за которое концентрация вещества в плазме крови снижается на 50% (рис. 1.9). Для большинства ЛВ (для тех, элиминация которых подчиняется кинетике 1-го порядка) период полуэлиминации — величина постоянная в определенных пределах и не зависит от дозы ЛВ. Поэтому, если за один период полуэлиминации из плазмы крови удаляется 50% внутривенно введенного ЛВ, то за 2 периода — 75%, а за 3,3 периода - 90% (этот параметр используют для подбора интервалов между введениями вещества, необходимых для поддержания его постоянной концентрации в крови).
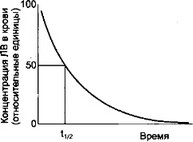
Рис. 1.9. Определение периода полуэлиминации. tl/t - период полуэлиминации.
Период полуэлиминации связан с константой скорости элиминации следующим соотношением:
t1/2 = In 2/keI = 0,693/kel.
Если сразу же после внутривенного введения вещества производить измерения его концентрации в плазме крови через короткие интервалы времени, то можно получить двухфазный характер изменения концентрации вещества в крови (см. рис. 1.11).
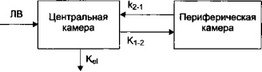
Такой же характер кривой можно получить с помощью двухкамерной фармакокинетической модели (рис. 1.10). В этой модели организм представляют в виде двух сообщающихся между собой камер. Одна из камер этой модели называется центральной и представляет плазму крови и хорошо перфузируемые органы (сердце, печень, почки, легкие), а другая, называемая периферической, представляет
Элиминация
Рис. 1.10. Двухкамерная фармакокинетическая модель.
ЛВ - лекарственное вещество.
плохо перфорируемые ткани (кожу, жировую, мышечную ткани). Вещество вводят в центральную камеру, где оно мгновенно и равномерно распределяется и откуда затем проникает в периферическую камеру. Этот период обозначается как фаза распределения, или a-фаза. Затем вещество перераспределяется из периферической камеры в центральную и удаляется из нее вследствие элиминации. Эта фаза (фаза элиминации) обозначается как р-фаза. ot-Фаза характеризуется параметром, который называется периодом полураспределения — t1/2(X, а характеристикой p-фазы является собственно период полуэлиминации, обозначаемый как t1/2p (рис. 1.11). Период полураспределения, как правило, меньше периода полуэлиминации, так как вещество распределяется из центральной камеры в периферическую быстрее, чем элиминируется.
Клиренс - фармакокинетический параметр, который характеризует скорость освобождения организма от лекарственного вещества.
Поскольку освобождение организма от ЛВ происходит за счет процессов биотрансформации (метаболизма) и экскреции, различают метаболический и экскреторный клиренс. Метаболический клиренс (Clmet) и экскреторный клиренс (Сехсг) в сумме составляют системный (общий) клиренс (Clt, total clearance):
Cl + С = Cl.
met excr t
Системный клиренс численно равен объему распределения, который освобождается от вещества в единицу времени (размерность — объем в единицу времени, например, мл/мин, л/ч, иногда с учетом массы тела, например, мл/кг/мин):
ц-w
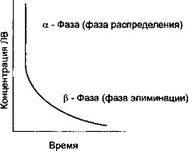
Рис. 1.11. Характер элиминации вещества в двухкамерной модели.
Значения клиренса прямо пропорциональны скорости элиминации вещества и обратно пропорциональны его концентрации в биологической жидкости (в крови, плазме крови, сыворотке):
_ Скорость элиминации вещества Ut С ’
где С - концентрация вещества.
В зависимости от путей элиминации Л В различают почечный клиренс (С1геп), печеночный клиренс (Clhep), а также клиренс, осуществляемый другими органами (легкими, слюнными, потовыми и молочными железами, внепеченочный метаболизм). Наиболее важными составляющими системного клиренса являются почечный и печеночный клиренс.
Почечный клиренс численно равен объему плазмы крови, который освобождается от ЛВ в единицу времени и зависит от интенсивности процессов клубочковой фильтрации, канальцевой секреции и реабсорбции. Почечный клиренс можно определить при постоянной концентрации вещества в плазме крови:
С1 = С V /С ,
геп и и' р’
где Си - концентрация вещества в моче, Ср — концентрация вещества в плазме крови и Vu - скорость мочеотделения.
Печеночный клиренс зависит от процессов биотрансформации ЛВ и экскреции неизмененного Л В с желчью. Значения почечного и печеночного клиренса следует учитывать при назначении ЛВ больным с недостаточностью почек или печени соответственно.
Оптимизация дозирования лекарственных веществ
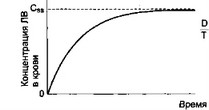
Для достижения оптимального терапевтического эффекта ЛВ необходимо постоянно поддерживать его терапевтическую концентрацию в крови. Постоянно поддерживаемый уровень вещества в плазме крови обозначается как стационарная концентрация (Css, С steady-state). Стационарная концентрация устанавливается при достижении равновесия между процессом поступления вещества в системный кровоток и процессом его элиминации (когда скорость поступления равна скорости элиминации). Наиболее простым способом достижения стационарной концентрации является внутривенное капельное введение (рис. 1.12). При внутривенном капельном введении величина Css зависит от скорости введения вещества, которую можно определить по формуле D/T = CssClt.
ЛВ необходимо вводить с такой скоростью, чтобы поддерживать его терапевтическую концентрацию в крови. Существует диапазон терапевтических концентраций (рис. 1.13). Нижняя граница этого диапазона — минимальная эффективная концентрация (С™п, ниже этой концентрации вещество не оказывает необходимого действия), верхняя граница - максимальная безопасная концентрация (С™\ выше которой находится область токсических концентраций). Обычно поддерживают среднюю концентрацию этого диапазона, т.е. среднюю терапевтическую концентрацию вещества в крови. Значения средних терапевтических концентраций лекарственных веществ приводятся в справочной литературе.

 Концентрация ЛВ в крови
Концентрация ЛВ в крови
Диапазон терапевтических концентраций лекарственного вещества в крови
Время достижения стационарной терапевтической концентрации вещества в крови зависит от его периода полуэлиминации. Через период полуэлиминации достигается 50%, через 2 периода полуэлиминации - 75% и через 3,3 периода — 90% от стационарного уровня вещества в крови. Поэтому при необходимости получения быстрого терапевтического эффекта, в особенности если вещество имеет достаточно большой период полуэлиминации, вначале вводят большую нагрузочную дозу препарата (для достижения стационарной терапевтической концентрации), а затем вещество вводят инфузионно с определенной скоростью для поддержания стационарной концентрации. Однако чаще всего вещества назначают отдельными дозами через определенные интервалы времени (наиболее часто вещества назначают внутрь). В таких случаях концентрация вещества в крови не остается постоянной, а меняется относительно стационарного уровня, причем эти колебания не должны выходить за пределы диапазона терапевтических концентраций. Поэтому после назначения нагрузочной дозы, которая обеспечивает быстрое достижение стационарной терапевтической концентрации, вводят меньшие по величине поддерживающие дозы, которые должны обеспечить лишь небольшие колебания концентрации вещества в крови относительно его стационарного терапевтического уровня (рис. 1.14). Нагрузочную и поддерживающую дозы ЛВ для каждого конкретного больного можно рассчитать по формулам, в которых использованы фармакокинетические параметры, представленные в этом разделе: объем распределения, период полуэлиминации и др. При введении веществ внутрь учитывается степень всасывания ЛВ из желудочно-кишечного тракта, которую характеризует такой параметр, как биодоступность (часть введенной дозы вещества, которая в неизмененном виде достигла системного кровотока).
Биодоступность веществ при введении внутрь зависит от многих факторов (см. стр. 33) и определяется следующим образом. Вещество вводят больному внут-
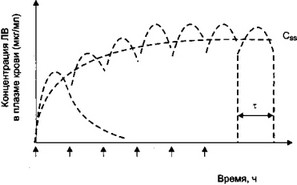
Рис. 1.14. Изменение концентрации лекарственного вещества в плазме крови при многократном введении (через равные промежутки времени вводятся поддерживающие дозы вещества).
Т - интервал времени между введением поддерживающих доз.
ривенно и измеряют его концентрацию в крови через определенные промежутки времени. На основании полученных данных вычерчивают кривую изменения концентрации вещества во времени при внутривенном введении. Затем тому же больному это вещество вводят внутрь в той. же дозе и определяют его концентрацию в крови через определенные интервалы времени. По результатам измерения строят кривую изменения концентрации вещества во времени при введении внутрь (рис. 1.15).
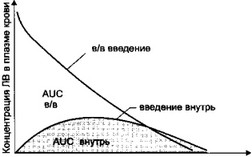
Рис. 1.15. Определение биодоступности лекарственного вещества при введении внутрь. AUC (Area Under the Curve) - площадь под кривой концентрация-время.
Затем измеряют площади под кривыми концентрация - время (AUC, Area Under the Curve). Биодоступность вещества определяют по формуле:
AUC ВНУП)Ь
F = внугр^ 1(Ю %
AUC „
где F — биодоступность (Fraction); AUC — площадь под кривой концентрация-время (Area Under the Curve).
Гл а в а 2.
ФАРМАКОДИНАМИКА
Фармакодинамика включает понятия о фармакологических эффектах, локализации действия и механизмах действия лекарственных веществ (т.е. представление о том, как, где и каким образом лекарственные вещества действуют в организме). К фармакодинамике относится также понятие о видах действия лекарственных веществ.
Источник: Р.Н. Аляутдин, «Фармакология» 2004
А так же в разделе «МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ФАРМАКОКИНЕТИЧЕСКИХ ПРОЦЕССОВ »
- А. Энтеральные пути введения
- В. Парентеральные пути введения
- РАСПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В ОРГАНИЗМЕ
- ДЕПОНИРОВАНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В ОРГАНИЗМЕ
- БИОТРАНСФОРМАЦИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
- ВЫВЕДЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ИЗ ОРГАНИЗМА
- ФАРМАКОЛОГИЧЕСКИЕ ЭФФЕКТЫ, ЛОКАЛИЗАЦИЯ И МЕХАНИЗМЫ ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ