Нейрогуморальная регуляция репродуктивной системы в периоды ее становления, функционирования и увядания
Регуляция репродуктивной функции осуществляется единой функциональной нейроэндокринной системой. Функциональная система должна обязательно включать в себя центральное — интегрирующее звено и периферические (эффекторные, исполнительные) органы с различным количеством промежуточных звеньев (рис. 14).
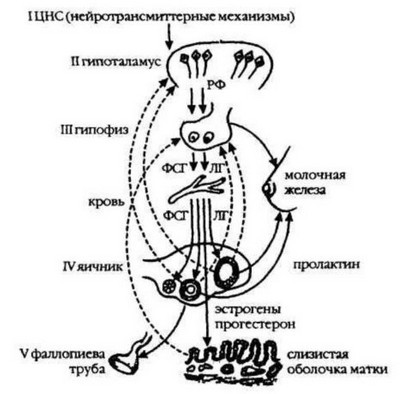
Рис. 14. Регуляция репродуктивной системы по уровням (I—V).
В нейроэндокринной системе регуляции репродуктивной функции выделяют пять звеньев, взаимодействующих между собой по принципу прямой и обратной отрицательной и положительной взаимосвязи, определяемой характером сигналов, поступающих с периферии. Ведущая роль в деятельности нейроэндокринных систем отводится отрицательным обратным связям. Физиология и патология менструального цикла в клиническом аспекте наиболее полно отражают состояние репродуктивной системы женщины.
Высшим уровнем регуляции репродуктивной системы являются структуры, составляющие акцептор результата действия. В них воспринимается результат действия всей системы и ее интеграция. К структурам акцептора результата действия относятся высшие отделы нервной системы, миндалевидный комплекс, гиппокамп и другие гипоталамические структуры Они влияют на функцию гипоталамуса и гипофиза, причем влияние может быть стимулирующим и ингибирующим. Различные участки указанных структур стимулируют или тормозят секрецию и выброс гонадолиберинов и гонадотропинов, ускоряют или блокируют овуляцию, ускоряют или задерживают половое развитие, повышают или снижают сексуальность. Физиологические эффекты структур высшего уровня регуляции осуществляются через нервные и гуморальные связи. Ведущее место в этих взаимосвязях отводится мозговым нейротрансмиттерам (катехоламины, серотонин, ацетилхолин, Г АМК, глютаминовая кислота, энкефалины), которые идентефицированы в экстрапирамидных образованиях. Церебральные нейротрансмиттеры регулируют гипоталамо-гипофизарно- яичниковый уровни репродуктивной функции. Так, они определяют циркадные и цирхоральные ритмы, которые являются ведущими в функционировании всей репродуктивной системы. Эндокринный гомеостаз организма поддерживается гипоталамо-гипофизарной системой, состояние которой регулируется нейротрансмиттерами. Основными из них являются биогенные амины и энкефалины.
Биогенные амины, в частности катехоламины (адреналин, норадреналин, дофамин) и серотонин, — высокоэффективные физиологические вещества, как нейромедиаторы и гормоны оказывают многогранное влияние на репродуктивную систему и на все органы и системы организма в физиологических и патологических условиях.
Открытие эндогенных опиоидных пептидов (ЭОП) в середине 1970-х годов позволило значительно расширить представления о нейроэндокринной системе регуляции репродуктивной функции. Выделяют три группы ЭОП: энкефалины, эндорфины и динорфины. ЭОП имеются в различных структурах мозга, вегетативной нервной системы, других тканях и органах (поджелудочной железе, ЖКТ, плаценте, сердце, желчном пузыре и др.), а также в биологических жидкостях организма (плазме, амниотической, фолликулярной, сперме и др.). ЭОП влияют на созревание фолликула, желтого тела, овуляцию, синтез и выброс гормонов гипоталамусом и гипофизом, а это свидетельствует об их многообразной роли в регуляции репродуктивной системы и участии в формировании различных ее патологических состояний. Так, с повышением уровня ЭОП связывается возникновение различных форм аменорей центрального генеза, синдрома поликистозных яичников, болезни Иценко—Кушинга, гирсутизма, ожирения. С помощью ингибиторов опиоидных рецепторов (ОР) налоксона и на- лтрексона устраняются угнетающие эффекты ЭОП на функцию гипофиза, овуляцию и другие процессы генеративной функции. Установлены и многие другие эффекты ЭОП: терморегуляция (способствуют гипертермии) и антиноцеп- тивное (обезболивающее) действие.
В то же время в клинической практике возможности использования ЭОП с целью регуляции репродуктивной системы до настоящего времени весьма ограниченны.
В структуре высшего звена регуляции репродуктивной функции рассматривается и эпифиз как важнейший нейроэндокринный передатчик, ранее известный как ингибитор развития половой системы. Метилиндолы и пептиды, содержащиеся в эпифизе, по месту их биосинтеза и физиологической роли разделяются на три группы: нейрогипофизарные (аргинин — вазопрессин, аргинин
- вазотонин, окситоцин, нейрофизин), воспринимающие информацию от мозга; аденогипофизарные (МСГ, ЛГ, ФСГ, СТГ, ПРЛ), передающие информацию о состоянии регуляторной способности эндокринной системы, собственный гормон эпифиза — мелатонин, ингибирующий уровень ЛГ и ПРЛ. Освобождается мелатонин ритмично с учетом времени суток (больше ночью) и сезонов года (больше зимой). Установлена роль эпифиза в регуляции полового созревания, функционального состояния гипоталамуса, гипофиза и яичников, беременности, лактации, а также в развитии ряда гинекологических заболеваний. Следовательно, эпифиз занимает важное место в нейроэндокринном гомеостазе организма.
Вторым уровнем регуляции репродуктивной функции является гипоталамус, в частности его гипофизотропная зона, состоящая из нейронов вентро- и дорсомедиальных аркуатных ядер, обладающих нейросекреторной активностью либеринов и статинов. Все 10 либеринов и статинов гипоталамуса участвуют в регуляции репродуктивной функции, взаимодействуя между собой. Особая роль при этом принадлежит люлиберину, фолиберину и пролактостатину— пролактинингибирующему фактору (ПИФ). Стимулируется выработка ПРЛ ти- ролиберином. Главная роль в регуляции выделения ПРЛ принадлежит дофами- нергическим структурам. Так, дофамин тормозит освобождение пролактина из лактофоров гипофиза, а его антагонисты (метилдофа, резерпин, аминазин) усиливают его выделение. Путем воздействия на адренергические структуры с помощью парлодела (бромкриптина) удается успешно лечить гиперпролактине- мию функционального и органического генеза.
Цирхоральная нейросекреторная функция гипоталамуса, которая модулируется импульсами из экстрагипоталамических структур и коры головного мозга, формируется в пубертатном возрасте и свидетельствует о зрелости нейросекреторных структур гипоталамуса. Регулируя гипофизарно-яичниковую подсистему, она запускает генеративную функцию. Следует также отметить, что определенную роль в выделении гипоталамусом гормонов, как и нейротрансмиттеров, играет уровень эстрадиола в крови.
Третьим уровнем регуляции репродуктивной функции является гипофиз. В нем вырабатываются тропные гормоны периферических эндокринных желез (ФСГ, ЛГ, ПРЛ, ТТГ, АКТГ) и другие. Г онадотропины, взаимодействуя между собой, оказывают влияние на функцию яичников. ФСГ стимулирует рост и созревание фолликулов, секрецию ими эстрогенов. Образование и деятельность желтого тела контролируются ЛГ и ПРЛ. ПРЛ также контролирует рост молочных желез и процесс лактации. В то же время эстрогены ингибируют синтез и выброс ФСГ, а прогестерон — ЛГ и ПРЛ. Таким образом, в зависимости от концентрации и соотношения половых стероидных гормонов угнетается или активируется продукция соответствующих тропных гормонов гипофиза.
Периферические эндокринные органы (яичники, щитовидная железа, надпочечники) представляют четвертый уровень регуляции репродуктивной функции. Главная роль в них принадлежит яичникам.
В них происходят процессы биосинтеза стероидов и развития фолликулов. Фолликулогенез начинается в антенатальном периоде, заканчивается в постменопаузальном. Большинство фолликулов претерпевают атретические изменения и только часть (до 10%) проходит полный цикл развития от примордиального до преовуляторного, затем после овуляции превращается в желтое тело. Доминантный фолликул в первые дни менструального цикла имеет диаметр 2 мм, к моменту овуляции увеличивается до 20—25 мм. Количество фолликулярной жидкости к овуляции увеличивается в 100 раз и более, а клетки грануле- зы — до 50 х 106 с 0,5 х 106. В фолликулярной жидкости резко возрастает уровень гормонов, особенно эстрадиола и ФСГ, за счет чего отмечается пик ЛГ и происходит овуляция — разрыв базальной мембраны доминантного фолликула и кровотечение из капилляров тека-клеток. Процесс овуляции совершается с участием простагландинов (F2 и E2), протеолитических ферментов, окситоцина и релаксина. На процесс овуляции влияют и внешние факторы (питание, стрессовые ситуации, световой и температурный режимы), но главными являются половые гормоны. Повышается уровень люлиберина, затем на фоне увели - ченной секреции эстрадиола и последующего пика ЛГ при повышенной чувствительности гипофиза к люлиберину и происходит овуляция. Накануне ее имело место снижение уровня ПРЛ. Затем начинается следующая фаза цикла — лютеиновая, или фаза желтого тела. Овуляция может сопровождаться кратковременными болями внизу живота. Вскоре увеличиваются слизистые выделения из влагалища, происходят падение базальной температуры с повышением ее уже на следующий день, увеличение уровня прогестерона и секреторная трансформация эндометрия, а также другие изменения в различных органах и системах организма. Все это лежит в основе методов диагностики овуляции и ряда патологических состояний — тестов функциональной диагностики.
Развитие фолликулов с созреванием яйцеклетки и в последующем желтого тела происходит одновременно с интенсивным процессом биосинтеза стероидных половых гормонов — эстрогенов, прогестерона и андрогенов. В первую фазу цикла в яичнике эстрадиола секретируется 50— 100 мкг/сут, прогестерона
- 2—5 мг/сут, во вторую фазу — соответственно 200—300 мкг/сут и 20— 25 мг/сут, а к моменту овуляции — 400—900 мкг/сут эстрадиола и 10—15 мг/сут прогестерона. В яичниках синтезируются и андрогены (андростендион) до 1,5 мг/сут (или 0,15 мг/сут тестостерона). Столько же его образуется и в надпочечниках. В меньшем количестве тестостерон секретируется в яичниках и в большем — в коре надпочечников из дегидроэпиандростерона и дегидроэпиандро- стерона сульфата. Тестостерон путем ароматизации с помощью энзимов превращается в дегидротестостерон — наиболее активный андроген, количество которого в женском организме составляет 50—75 мкг/сут. Андрогены синтезируются в тека-клетках, а эстрогены — в гранулезных клетках, в том числе из андрогенов, поступающих из тека-клеток
В гранулезных клетках фолликулов образуются также ингибин. тормозящий выделение ФСГ гипофизом, белковые вещества местного действия — ок- ситоцин и релаксин, а также простагландины. Окситоцин оказывает лютеоли- тическое действие на желтое тело, а релаксин — токолитическое на миометрий Максимальная гормональная активность структур всех четырех уровней отмечается в периовуляторный период (до, во время и после овуляции). Неоднозначные, а иногда и противоречивые данные о локализации и содержании рилизинг-гормонов, как и гормонов нижерасположенных структур, свидетельствуют о том, что функциональное состояние всех уровней регуляции следует рассматривать только в тесной взаимосвязи. Так, секреторная функция гипоталамуса по продукции рилизинг-гормонов зависит не только от ней- ротрансмиттерных механизмов, но и в значительной степени от информации, поступающей с периферии, об уровне циркулирующих в крови гормонов, от скорости их утилизации, что связано с активностью инактивирующих их ферментов. Поэтому наличие в гипоталамических нейроцитах и аденоцитах гипофиза эстрогенных рецепторов (с учетом уровня эстрогенов в крови) не только влияет на продукцию гонадолиберинов, но и модулирует чувствительность к ним у гонадотропинов гипофиза. Подобным же образом уровень стероидных гормонов определяет влияние рилизинг-гормонов на идентичные аденоциты гипофиза. При дефиците периферических гормонов клетки гипофиза становятся высокочувствительными и на аналогичную концентрацию рилизинг-гормона отвечают выбросом большого количества гонадотропинов. Нейротрансмиттер- ные механизмы (с учетом уровня гормонов в крови) регулируют не только функцию гипоталамуса, но и осуществляют контроль за тройными гормонами гипофиза.
Влияние надпочечников на регуляцию репродуктивной функции осуществляется через гормоны коры и мозгового вещества этих желез. Кора надпочечников имеет морфологическое сходство с корой яичников по происхождению из мезодермальных зачатков, что и определяет сходство их гормонов по химическому строению, а также по цикличности биосинтеза. Известно, что различные нарушения биосинтеза и метаболизма кортикостероидов приводят к патологии гормональной функции яичников и обусловливают многие гинекологические заболевания (синдром Иценко—Кушинга, склерополикистозных яичников и др.). С другой стороны, всевозможные нарушения генеративной функции сопровождаются патофизиологическими изменениями коры надпочечников. Не менее очевидна роль симпатоадреналовой системы в общей НЭС регуляции репродуктивной функции. С помощью катехоламинов можно воздействовать на процессы созревания фолликулов, желтого тела и овуляции.
Влиянием на адренергические структуры с помощью парлодела (бром- криптина) удается корригировать нарушения генеративной функции, наблюдающиеся при гиперпролактинемическом синдроме. Установлена также взаимосвязь структур регуляции функции яичников и надпочечников в гипоталамусе и гипофизе, а также через нейротрансмиттерные механизмы.
Роль щитовидной железы в регуляции репродуктивной функции отчетливо просматривается как в норме, так и особенно при ее функциональных нарушениях по типу гипер- и гипотиреоза. Избыток Т3 и Т4 приводит к увеличению ЛГ, подавлению овуляторного пика гормонов, недостаточности лютеиновой фазы, нарушениям менструального цикла и бесплодию. При дефиците тиреоидных гормонов снижается биосинтез ФСГ и ЛГ, угнетается функция яичников со всеми дальнейшими проявлениями их недостаточности.
Патология гипофизарно-тиреоидной системы особенно отражается на течении беременности, развитии плода. Если выраженные клинические формы заболеваний щитовидной железы вызывают различные нарушения менструального цикла и бесплодие, то при субклинических формах наблюдаются невынашивание и другие осложнения в течении беременности и развитии плода.
Пятым уровнем регуляции репродуктивной системы являются половые органы и молочные железы женщины, а также кожа, кости и жировая ткань. В них реализуют свое действие половые стероидные гормоны, в связи с чем эти органы являются органами-мишенями. Клетки этих тканей и органов имеют рецепторы половых гормонов. Выделяют цитоплазменные (цитозолре- цепторы) и ядерные рецепторы. Цитоплазменные рецепторы строго спе- цифичны к эстрогенам, прогестерону и тестостерону, а ядерные могут быть акцепторами (наряду со стероидными гормонами) аминопептидов, инсулина и глюкагона. Для прогестерона по рецепторному связыванию антагонистами считаются глюкокортикоиды.
Следует отметить, что, по мнению П.В Сергеева (1984,1987), первой структурой, взаимодействующей со стероидными гормонами в процессе реализации биологической активности на клеточном уровне, является не цитоплазма, а цитоплазматическая мембрана клеток-мишеней, в которой также содержатся рецепторы стероидных гормонов.
Рецепторы к половым гормонам обнаружены во всех структурах репродуктивной системы и в центральной нервной системе. Содержание стероидных рецепторов и их активность в половых органах, и особенно в эндометрии, изменяются с учетом фазы цикла, т.е. зависят от уровня гормонов в крови.
Рецепторы в клетках яичников (к гонадотропинам), гипофиза (к рили- зинг-гормонам) и гипоталамуса (к нейротрансмиттерам) локализуются на клеточной мембране.
Гормон-рецепторные комплексы взаимодействуют с различными структурами клетки-мишени и посредством метаболических реакций проявляют конечные гормональные эффекты. Благодаря им и совершаются многочисленные изменения в половых органах и во всех структурах репродуктивной системы, которые характеризуются по периодам жизни женщины при различных физиологических и патологических состояниях.
Функционирование клеточных рецепторных систем генетически детер- минированно, что и определяет как время полового созревания, так и продолжительность периодов жизни женщины и деятельности ее репродуктивной системы.
Характеризуя нейроэндокринную систему регуляции репродуктивной функции женщины, важно учитывать биоритмы (суточные, месячные, годовые, сезонные, многолетние и т.д.). Сущность сводится к тому, что колебания различных физиологических процессов, в том числе и генеративной функции, различаются по указанным периодам. Фазовая временная организация различных функций организма обеспечивается также регуляторными органами и системами. Многие суточные ритмы колебаний выделения гормонов связаны с деятельностью эпифиза, циркадные определяются гипоталамусом и т.д. Нарушение привычного режима жизни при стрессовых ситуациях, резких изменениях климатических условий приводит к состоянию десинхроноза. Хотя эндокринные функции относятся к инертным системам, десинхронозы возможны и в них. Это может привести к различным нарушениям репродуктивной способности и гинекологическим заболеваниям.
В заключение можно отметить высокую надежность и приспособляемость нейроэндокринной регуляции репродуктивной системы к постоянно меняющимся условиям внешней среды за счет многосторонних адаптационных механизмов.
Источник: Дуда В. И., «Гинекология» 2004
А так же в разделе «Нейрогуморальная регуляция репродуктивной системы в периоды ее становления, функционирования и увядания »
- Гипоталамо-гипофизарная система
- Половые железы женщин
- Щитовидная железа
- Надпочечники
- Другие эндокринные органы и гормоны
- Роль нейротрансмиттеров в регуляции репродуктивной функции
- Роль простагландинов в регуляции репродуктивной функции
- Нормальный менструальный цикл
- Развитие репродуктивной системы в антенатальном периоде
- Развитие репродуктивной системы в детском и подростковом возрастах
- Половое созревание и половая зрелость
- Патология полового развития
- Задержка полового развития
- Отсутствие полового развития (дисгенезия гонад)
- Половой гермафродитизм
- Преждевременное половое созревание
- Гипоталамический синдром периода полового созревания
- Нарушения менструального цикла
- Адреногенитальный синдром
- Аномалии развития женских половых органов