Детоксикационная терапия у детей с разлитым гнойным перитонитом
Основными задачами детоксикационной терапии являются:
- предотвращение попадания токсинов во внутреннюю среду организма;
- нейтрализация микробных токсинов и эндогенных токсичных продуктов (метаболитов воспаления, иммунных комплексов, продуктов деструкции тканей и др.);
- выведение токсичных продуктов из организма.
Первая задача решается хирургическими методами лечения,
зондовой декомпрессией и дренированием кишечника, борьбой с парезом кишечника, энтеросорбцией.
Нейтрализация эндогенных токсичных продуктов, являющихся метаболитами воспаления (биогенные амины, продукты активации калликреин-кининовой системы и ПОЛ), осуществляется назначением антигистаминных препаратов, ингибиторов протеаз, антиоксидантов. С целью связывания циркулирующих токсинов применяют такие инфузионные среды, как гемодез, реополиглюкин, альбумин, протеин и др. (из расчета 10—15 мл/кг массы тела в сутки). Связыванию и нейтрализации токсинов в кишечнике способствует энтеросорбция, которую производят через интубационный зонд.
Для адекватного выведения токсичных веществ прежде всего проводят поддержание функции органов, осуществляющих естественную детоксикацию (печень, почки, кишечник, легкие). Функцию почек стимулируют диуретиками (чаще лазик- сом). Активно применяют метод форсированного диуреза.
У 54 больных с осложненным РГП вышеуказанные методы детоксикации оказались практически неэффективными вследствие развития у этих детей симптомов полиорганной недостаточности. Это послужило основанием для проведения им экстракорпоральной детоксикации.
Из методов экстракорпоральной детоксикации мы отдаем предпочтение дискретному плазмаферезу, считая его наиболее эффективным и менее травматичным. В нашей клинике разработана и внедрена методика проведения ДПА у детей с тяжелыми формами ГСЗ, определены показания и противопоказания к нему, накоплен значительный опыт, подтверждающий его эффективность. Подробно методика ДПА и показания к его применению изложены в разделе 2.4.
Дискретный плазмаферез проведен у 53 больного в 1—3-й сутки после операции или же при поступлении больных в отделение, если необходимое оперативное пособие было оказано в больнице по месту жительства. Одной больной с прогрессирующим разлитым гнойным перитонитом ДПА применен в качестве предоперационной подготовки для ликвидации тяжелого эндотоксикоза перед оперативным вмешательством.
Показаниями для включения в комплекс интенсивных лечебных мероприятий ДПА явились:
- прогрессирующая тяжелая эндогенная интоксикация;
- прогрессирование гнойного процесса в брюшной полости;
- септическое состояние при обширных гнойно-гнилостных ранах и флегмонах брюшной стенки после вскрытия абсцессов брюшной полости;
- неэффективность инфузионной детоксикационной и иммунной терапии;
- стойкий парез кишечника.
Перед ДПА состояние 36 больных было очень тяжелым, 18 больных — тяжелым. Тяжесть состояния значительно усугубляла спаечная кишечная непроходимость на фоне перитонита у 22 больных и пневмония у 18 больных. Явления токсической энцефалопатии отмечены у 24 больных. Одна больная была в состоянии токсической мозговой комы, на ИВЛ. У всех больных отмечалась клиническая картина нарушений микроциркуляции в виде бледно-мраморного рисунка кожных покровов, акро- цианоза. Температура тела в среднем составила 37,8+0,2 °С. ЧСС составила 114,4+5,6 %, артериальное давление 95,1+1,3 % от возрастной нормы, ЦВД 55,4+3,9 мм водн. ст. Частота дыханий в 1 мин превышала нормальные значения на 46+5,6 %. Парез кишечника III степени был у 22 больных, II степени — у 15, I степени — у 3 больных. Изменения в моче, характерные для тяжелой интоксикации, отмечены у 20 больных.
В анализе крови наблюдались анемия и лейкоцитоз. Токсичность крови составила 40,3+2,2 усл.ед., ЛИИ — 5,06+0,77.
После ДПА у всех больных отмечалось улучшение состояния, кроме одного случая с летальным исходом. Признаки токсической энцефалопатии значительно уменьшились у 15 детей и практически исчезли у 9. Одна больная была выведена из мозговой комы и переведена с ИВЛ на самостоятельное дыхание. У всех больных отмечалась выраженная положительная динамика со стороны показателей гемодинамики. К концу сеанса ДПА у всех больных уменьшился парез кишечника, появилась перистальтика кишечника, уменьшилось количество застойного содержимого в желудке. У 8 больных в ближайшие часы после ДПА появился самостоятельный стул.
Группу сравнения (вторая группа) составили 30 детей, аналогичных по возрасту и тяжести состояния больным основной группы, но которым ДПА не проводился.
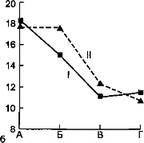
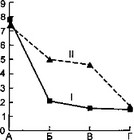
Динамика показателей до и после ДПА представлена на рис. 6.14.
После сеанса ДПА у детей (первой, основной, группы) отмечено значительное снижение температуры тела, достоверно более выраженное относительно больных группы сравнения (первая группа с 38,2+0,2 до 37,4+0,1 °С и вторая группа с 38,3+0,2 до 37,9+0,1 °С; t = 2,9). Через 3—5 сут у детей первой группы температура тела составила 37,1+0,1 °С, в то время как у больных второй группы — 37,8+0,2 °С (t = 3,2). Количество лейкоцитов у детей первой группы после ДПА снизилось с 18,4+1,3 • 10/л до 15,0±1,1 • 109/л, в то время как у больных второй группы за этот период времени снижения их практически не произошло (17,7+1,0 • 109/л и 17,6±1,0 • 109/л). Достоверной динамики СОЭ у детей сравниваемых групп не обнаружено.
Следует отметить резкое снижение ЛИИ после первого же сеанса ДПА (с 7,8+0,2 до 2,1+0,015 ед., в группе сравнения — с 7,4±0,3 до 5,0+0,3 ед.; t = 5,7), причем у детей первой группы ЛИИ оставался относительно низким и через 3—5 и 10 сут после ДПА (1,58+0,56 и 1,51±0,35 ед. — первая группа; 4,56+0,52 и 1,72+0,21 ед. — вторая группа).
Токсичность крови также значительно снизилась под влиянием ДПА (с 39,6± 1,2 до 25,8+0,7 усл. ед. — первая группа; с 37,4±2,5 до 36,6+2,5 усл. ед. — вторая группа; t = 3,85). дПа привел к выраженному снижению МСМ (Е254 с 0,37±0,04 до
- 27±0,01 усл. ед.; t = 2,5; Е280 — с 0,42±0,01 до 0,32+0,04 усл. ед.; t = 2,5).
Исследование уровней сывороточных иммуноглобулинов выявило достоверное различие только в содержании IgM через неделю после сеанса ДПА (первая группа — 1,4+0,05 г/л, вторая группа— 1,8+0,1 г/л; t = 3,5). В то же время в первой группе уровни IgM имеют выраженную тенденцию к снижению по сравнению с исходными данными. Такую динамику уровней IgM под влиянием ДПА следует считать благоприятной, так как IgM принимает активное участие, как было показано выше, в образовании иммунных комплексов. Кроме того, соответственно закону динамики иммунного ответа син-

 ед.
ед.

Усл. ед.
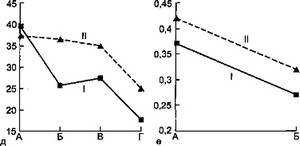
- Рис. 6.14. Динамика некоторых показателей интоксикации при плазмаферезе у детей с осложненным разлитым гнойным перитонитом.
'' . а — динамика температуры тела; б — динамика количества лейкоцитов; в —
- динамика СОЭ; г — динамика ЛИИ; д — динамика токсичности крови; е — динамика МСМ: I — первая группа, II — вторая группа, А — до ДПА, Б — после ДПА, В — через 3—5 сут, Г — через 10 сут.
тез IgM в эти сроки должен постепенно снижаться (перекрест с продукцией IgG).
После сеанса ДПА у детей отмечается достоверное повышение абсолютного и процентного числа Т-РОК (соответственно с 41,6+2,2 до 54,7+2,0% и с 1,16+0,12-109/л до 2,0+0,13х х 109/л), сохраняющееся до конца заболевания и абсолютного количества Т-РОК-акт. (с 0,27+0,02 • 109/л до 0,38+0,02 • 109/л). Отмечен также достоверный рост процентного содержания фагоцитирующих нейтрофилов при отсутствии увеличения абсолютного количества фагоцитов. Существенной динамики числа В-РОК под действием ДПА не обнаружено. Абсолютное и процентное содержание этих лимфоцитов оставалось достоверно выше нормальных величин.
Ниже приводится наблюдение, иллюстрирующее эффективность плазмафереза.
Больной А., 5 лет, 20.04.86 г. оперирован на 3-й день заболевания в районной больнице по поводу гангренозно-перфоративного аппендицита, перитонита. Брюшная полость дренирована, через 2 сут появилась клиническая картина прогрессирующего перитонита и ранней спаечной кишечной непроходимости. Релапаротомия 23.04.86 г. — санация брюшной полости, разделение спаек. Проводилась детоксика- ционная, инфузионная и антибактериальная терапия. Несмотря на это, состояние ребенка ухудшалось, 28.04.86 г. произведена повторная релапаротомия консультантом МОНИКИ в районной больнице по поводу разлитого гнойного перитонита, спаечной кишечной непроходимости, высокой интоксикации, безуспешности лечения. Произведена санация брюшной полости и интубация кишечника.
Для интенсивной терапии переведен в МОНИКИ 29.04.86 г. Состояние тяжелое, бледен, адинамичен. Температура тела 38,4 °С, пульс 138 уд/мин, АД 100/60 мм рт.ст., ЦВД 60 мм водн. ст., в легких влажные хрипы (пневмония). Живот вздут, печень выступает из подреберья на 3 см. Рентгенологически — мелкоочаговая пневмония.
НЬ 98 г/л, лейкоцитоз 18,210Л/л, токсичность крови 27 усл.ед., ЛИИ - 7,54 ед.
В этот же день проведен ДПА, за 5 эксфузий взято 1100 мл крови, отмыто 400 мл эритроцитной массы, которая возвращена. 700 мл плазмы больного замещены 450 мл антипротейной плазмы, 100 мл антистафилококковой плазмы, 150 мл крови, 100 мл альбумина.
После ДПА через сутки: НЬ 116 г/л, лейкоцитоз 14,5 • 109/л, токсичность крови 7 усл. ед., ЛИИ — 0,67 ед. Температура тела нормализовалась на 6-е сутки, самостоятельный стул на 3-й день, кишечный зонд удален. Продолжалась детоксикационная, инфузионная, антибактериальная и общая терапия. В удовлетворительном состоянии на 15-е сутки после поступления в МОНИКИ выписан домой.
Дискретный плазмаферез является весьма эффективным способом детоксикации у детей с осложненными формами РГП, что подтверждается значительной положительной динамикой температуры тела, лейкоцитоза, СОЭ и особенно такими критериями эндотоксикоза, как ЛИИ, токсичность крови, уровни МСМ. Высокоинформативным показателем детоксика- ционного эффекта ДПА является значительное снижение количества ЦИК (высоко- и низкомолекулярных).
Энергичное лечение, в том числе с применением ДПА, приводит к желаемому исходу заболевания при тяжелой форме перитонита.
Иммунологические исследования при перитоните показали, что ДПА не оказывает отрицательного влияния на гуморальное звено иммунитета, вместе с тем он устраняет дисиммуногло- булинемию, снижая уровни IgM до оптимальных значений, близких к адекватному иммунному ответу. При этом снижение концентрации IgM сопровождается уменьшением количества ЦИК.
Значительное увеличение абсолютного и процентного количества Т-РОК и абсолютного числа Т-РОК-акт. указывает на модулирующее влияние ДПА на клеточное звено иммунитета. Несколько парадоксальным является действие ДПА на нейтро- фильный фагоцитоз. Повышая, с одной стороны, процентное число фагоцитирующих клеток, он несколько снижает их абсолютное количество. Вероятно, эта обратная зависимость связана с компенсаторным механизмом фагоцитарных реакций.
Механизм действия ДПА при перитоните следует объяснять следующими факторами.
- Связыванием, разведением (инфузионными средами) и удалением токсичных продуктов из сосудистого русла вместе с плазмой больного.
- Удалением токсинов с поверхности клеточных мембран (в том числе и иммунокомпетентных клеток), что приводит к восстановлению функциональной и митотической активности клеток. Этот эффект усиливается отмыванием клеток крови.
- Снижением антигенной нагрузки на иммунную систему больного.
- Поддержанием, а в ряде случаев и замещением органов и систем естественной детоксикации. Снимая или уменьшая токсическое влияние на системы детоксикации организма, ДПА разрывает тем самым порочный круг, являющийся главным фактором в танатогенезе.
- Возможностью экстренного управления гомеостазом путем комбинаций инфузионных сред и целенаправленного влияния на иммунобиологическую защиту организма.
А так же в разделе «Детоксикационная терапия у детей с разлитым гнойным перитонитом »
- Характеристика поступивших больных
- Классификация перитонитов
- Операционные доступы и санация брюшной полости
- Кишечные сто мы и парентеральное питание при перитоните
- Ультразвуковое исследование в диагностике и лечении осложнений перитонита
- Ультразвуковой мониторинг при перитоните и после больших реконструктивных операций на органах брюшной полости
- Малые инвазивные вмешательства при интрапаренхиматозных и межпетельных абсцессах брюшной полости УЗИ в лечении абсцессов паренхиматозных органов
- УЗИ в лечении межпетельных абсцессов при помощи микролапаротомии
- Общие принципы консервативной терапии детей с разлитым гнойным перитонитом и его осложнениями Предоперационная подготовка
- Энтеросорбция при помощи дезинтегрированного активированного угля
- Борьба с парезом желудочно-кишечного тракта
- Ультрафиолетовое облучение крови при перитоните
- Дифференцированная иммунотерапия у детей с осложненными формами разлитого гнойного перитонита
- Некоторые особенности воспалительного процесса у детей с осложненными формами разлитого гнойного перитонита
- Летальность при перитоните