Детоксикация организма у детей с острой гнойной деструктивной пневмонией
Успешное лечение эндотоксикоза возможно лишь при решении трех основных задач: а) выведение токсичных продуктов из кровяного русла; б) связывание и нейтрализация токсинов; в) устранение нарушений гомеостаза, вызванных токсикозом. Все задачи требуют экстренного и одновременного решения.
Основой решения двух последних задач является инфузи- онная терапия. В качестве инфузионных сред наиболее часто применяют нативную или гипериммунную плазму (10—20 мл/кг массы тела), гемодез и реополиглюкин (10—20 мл/кг), альбумин 5—20 % (10 мл/кг), протеин (10—20 мл/кг), растворы аминокислот (альвезин, нефрамин и др.), электролитные растворы (изотонический раствор хлорида натрия, раствор Рингера—Локка, лактосол, ацесоль, трисоль, хлосоль, дисоль и др.), 5—10 % раствор глюкозы, глюкозокалиево-новокаиновая смесь. Вид инфузионных сред, их количество и соотношение определяются возрастом больного, степенью и формой токсикоза.
При ликвидации нарушений гомеостаза мы придерживаемся принципа синдромной терапии: коррекция водно-электролитного баланса, борьба с нарушением микроциркуляции и ДВС-синдромом, стабилизация КОС, энергетического баланса, борьба с легочно-сердечной недостаточностью.
Существенную помощь при детоксикации оказывает метод форсированного диуреза, который должен быть строго контролируемым и управляемым.
При крайне выраженном токсикозе, сопровождаемом нарушениями ЦНС, токсическим гепатитом, септическим шоком с нарушением гемодинамики, значительными аллергическими и анафилактическими реакциями, считаем целесообразным применение гормонов коркового вещества надпочечников (преднизолона гидрохлорид или гидрокортизона гемисукци- нат). Курс лечения продолжается не более 2—7 дней. Суточные и разовые дозы гормонов зависят от тяжести состояния больного. В остальных случаях к назначению кортикостероидов мы не прибегаем.
В лечении ДВС-синдрома основной задачей является нормализация периферического кровообращения. Это осуществляется с помощью круглосуточной инфузионной терапии, направленной на ликвидацию гиповолемии, электролитных расстройств и гемоконцентрации. Одновременно назначают гепарин в дозах 100—150—200 ЕД/кг массы тела каждые 6 ч внутривенно вплоть до ликвидации токсикоза под контролем коагулограммы. Отмена гепарина производится постепенно, в течение- 2—3 сут. Вместе с тем применяются сосудорасширяющие средства (но-шпа, папаверин, эуфиллин) и препараты, вызывающие нейровегетативную блокаду (симпатолитический эффект) и оказывающие антигистаминное действие (аминазин, пипольфен, димедрол, тавегил и др.).
В коррекции КОС большое внимание уделяют борьбе с гипогидратацией, нарушением микроциркуляции, оксигена- ции тканей, которые приводят к повышению содержания не- доокисленных продуктов метаболизма в тканях и крови. С этой целью назначают АТФ, кокарбоксилазу, 10—20 % раствор глюкозы, аскорбиновую кислоту, витамины группы В. При выраженном ацидозе под контролем показателей КОС назначают 4 % раствор гидрокарбоната натрия из расчета 0,5хВЕх массу тела. Большое значение в устранении нарушений КОС имеет ликвидация легочно-сердечной недостаточности. При развитии алкалоза основное внимание уделяют ликвидации гипока- лиемии. Необходимое количество калия рассчитывают по формуле Хартига (см. с. 116). Иногда при метаболическом алкалозе назначают диакарб (5 мг/кг 3 раза в сутки).
В лечении синдрома дыхательной недостаточности применяют различные виды оксигенотерапии. Как наиболее эффективный из них зарекомендовало себя СДППД — спонтанное дыхание под повышенным давлением (2—10 см водн. ст.). При прогрессирующей дыхательной недостаточности, когда естественное дыхание не поддерживает адекватный газообмен, нарастает децентрализация кровообращения, больного переводят на ИВЛ. Лабораторными критериями перевода больного на ИВЛ являются: рН — 7,25, PQ — 50 мм рт.ст., Р с — 65 мм рт.ст.
Большое значение предают усиленному энтеральному и парентеральному питанию, которое должно превышать необходимый калораж на 20—30 %. В ассортимент продуктов обязательно вводят жиры, способные возместить потери сурфактанта, и комплекс витаминов.
Сотрудники института В.И. Щербина и Л.И. Юновидова провели исследования эндобронхиальных смывов, изучив степень снижения поверхностного натяжения в смывах при деструктивной пневмонии. Исследования проведены у 25 детей, из них 18 имели двусторонний и 7 односторонний процессы. Возраст детей от 2 до 15 лет. Исследование проводилось путем бронхоскопии при помощи бронхоскопа Фриделя. Левый и правый бронхи промывались стерильным 0,9 % раствором хлорида натрия. Через 1 мин раствор отсасывался и центрифугировался. О поверхностной активности смыва судили по степени снижения полярографического максимума основного раствора (солей кобальта) после добавления к нему надосадочной жидкости.
Поверхностное натяжение в исследуемой жидкости при двусторонних поражениях оказалось значительно сниженным в смывах из обоих легких. Разница между эндобронхиальными смывами правого и левого легких была незначительна (34,0±3,8 и 34,6±3,4 %). При односторонних деструктивных пневмониях показатели были следующими: пораженное легкое — 31,4±1,7 %, здоровое легкое 42,3± 1,06 %. При исследовании 3 детей с инородными телами бронхов поверхностное натяжение было от 49,4±3,4 до 56,8±3,8 %.
Полученные данные свидетельствуют о понижении поверхностной активности эндобронхиальных смывов при деструктивной пневмонии, что указывает на нарушение в сурфактантной системе легких — ее дефицит.
Проведенные аналогичные исследования выдыхаемого воздуха у 11 детей с двусторонними пневмониями показали невозможность использования этого метода для объективной оценки результатов из-за малой разницы показателей у больных и здоровых детей (соответственно 12,8±2,6 и 15±3,4 %), при этом разброс показателей находился в диапазоне от 6,6 до 22,3 %.
В течение многих лет в борьбе с эндотоксикозом мы применяем ДПА, который успешно решает задачу не только выведения токсинов из кровяного русла, но и устранения ряда нарушений гомеостаза. Показаниями к ДПА у детей с ОГДП являлись: 1) резко выраженный эндотоксикоз; 2) прогрессирование гнойного деструктивного процесса в легких, несмотря на интенсивную терапию; 3) неэффективность традиционных методов детоксикации.
Для оценки эффективности ДПА у 38 детей с ОГДП в возрасте от 6 мес до 15 лет исследованы в динамике некоторые клинико-лабораторные показатели. Исходное состояние 18 детей было тяжелым, 11 — крайне тяжелым. Результаты исследований отражены на рис. 7.7.
После ДПА отмечено более быстрое снижение температуры тела относительно группы сравнения. Токсичность крови через сутки после сеанса ДПА снизилась с 37,3±2,7 до 26,6±2,0 усл.ед., затем через 3 сут незначительно (недостоверно) повысилась, а к концу заболевания снизилась до 21,7±0,5 усл.ед.
У детей, которым проводился ДПА, наблюдалось более быстрое снижение лейкоцитоза, но достоверного различия в содержании гемоглобина и эритроцитов в исследуемых группах не наблюдалось.
Общее состояние больных после сеанса ДПА значительно улучшилось. Практически у всех исчезли или уменьшились явления токсической энцефалопатии, улучшилась микроциркуляция, снизились частота сердечных сокращений (на 17,5 %) и частота дыхания (на 15 %). Показатели артериального давления и ЦВД достоверно не изменились.
Таким образом, применение ДПА в комплексном лечении ОГДП позволяет значительно снизить проявления эндотоксикоза и улучшить состояние больных. Благодаря ДПА сроки дренирования плевральной полости сократились на 4—5 дней,
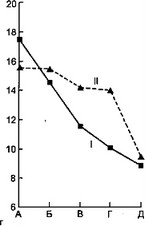
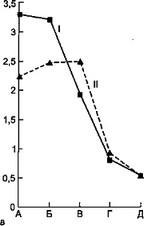
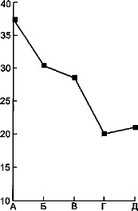
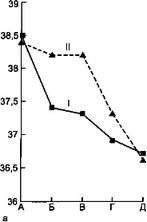 Рис. 7.7. Динамика некоторых показателей эндотоксикоза у детей с острой гнойной деструктивной пневмонией под влиянием дискретного плазмафереза.
Рис. 7.7. Динамика некоторых показателей эндотоксикоза у детей с острой гнойной деструктивной пневмонией под влиянием дискретного плазмафереза.
а — динамика температуры тела; б — динамика токсичности плазмы; в — динамика ЛИИ; г — динамика количества лейкоцитов: I — первая группа, II — вторая группа, А — до лечения, Б — 1-е сутки, В — 3-й сутки, Г — 7-е сутки, Д — выздоровление.
а продолжительность стационарного лечения — на 5 сут. Каких-либо осложнений и неблагоприятных исходов в исследуемой группе не отмечалось.
А так же в разделе «Детоксикация организма у детей с острой гнойной деструктивной пневмонией »
- Клинико-лабораторная характеристика наблюдавшихся больных
- Зависимость контаминации от состояния системы антиинфекционной резистентности организма
- Общие принципы комплексной терапии у детей с острой гнойной деструктивной пневмонией и ее осложнениями
- Местное лечение детей с острой гнойной деструктивной пневмонией
- Результаты лазерной терапии при осложненных формах деструктивной пневмонии