Генерализация воспалительного процесса. Сепсис
Наиболее целесообразным нам представляется в настоящем разделе главы, посвященной остеомиелиту, высказать свою точку зрения на критерии генерализации воспалительного процесса при ГСЗ и изложить собственные взгляды на понятие "сепсис", которые сформировались на основании многолетней работы с такими больными и синтетического анализа многочисленных литературных источников, посвященных этой проблеме. Считаем, что сепсис всегда обусловлен гнойным очагом и сам обусловливает его развитие. Поэтому существование понятия "септицемия", т.е. сепсис без воспалительного очага (макро- или микроскопического), является не вполне корректным, отражающим лишь общую реакцию организма на экзо- и эндотоксичные продукты, поступающие из первичных воспалительных очагов.
Развитие гнойно-септических процессов мы связываем с наличием воспалительных очагов трех порядков.
А Очаг 1-го порядка — возникает, как правило, в области входных ворот инфекции, латентных очагов (кожа, слизистые оболочки дыхательных путей, желудочно-кишечного тракта, мочевыводящих путей), т.е. на границе внешней и внутренней среды организма.
А Очаг 2-го порядка — возникает при проникновении инфекции лимфогематогенным путем во внутреннюю среду организма (различные органы и ткани). В подавляющем большинстве случаев формирование очагов 2-го порядка проходит через стадию преходящей бактериемии. Генерализации воспалительного процесса на этой стадии не происходит, так как потенциальные возможности системы АИР еще не исчерпаны, организм еще в состоянии локализовать инфекцию. Развиваются гнойно-деструктивные процессы в различных органах, особенно в тех, для которых характерно замедление кровотока в терминальных отделах сосудистого русла (кости, легкие, кожа и др.).
А Очаг 3-го порядка возникает в результате прогрессирующего размножения и бессистемного распространения микроорганизмов по органам и тканям. Этому способствует полная декомпенсация системы АИР организма. Бактериемия становится более постоянным признаком. Следует отметить, что не все воспалительные очаги проходят стадию нагноения. Эта стадия воспалительного процесса и является собственно сепсисом, а наличие очагов 3-го порядка служит его постоянным признаком.
Септикопиемические очаги (очаги 3-го порядка) у 12 детей первой группы располагались следующим образом: 1) в других костях — 10; 2) в легких — 12; 3) в коже и мягких тканях — 9;
- в сердце (эндокардит) — 4; 5) в почках — 4; 6) в мозговых оболочках — 2.
По нашему мнению, сепсис — это осложнение любого инфекционного процесса, выражающееся в его генерализации, наступившей вследствие декомпенсации системы АИР организма и характеризующееся:
а) течением, независимым от состояния гнойного очага 1-го и 2-го порядка;
2) наличием метастатических очагов 3-го порядка (обсеменением организма микробами);
в) наличием полиорганной недостаточности;
г) глубоким нарушением и декомпенсацией всех звеньев системы АИР организма (возможно, в ряде случаев обусловленной иммунологической толерантностью);
д) распространенным декомпенсированным дисбиозом.
Следует подчеркнуть, что у всех наблюдаемых больных с
сепсисом отмечалось поражение как минимум пяти различных органов. На высокую частоту поражения многих органов при септикопиемической форме остеомиелита указывают и другие авторы [Gammon G.M. et al., 1986]. По частоте вовлечения в токсико-септический процесс внутренние органы распределяются следующим образом:
- легкие — 12 больных;
- кишечник — 12 больных (энтероколит);
- печень — 10 больных (токсический гепатит);
- селезенка — 10 больных (спленомегалия);
- почки — 10 больных (токсическая нефропатия);
- сердце — 8 больных (токсический миокардит);
- головной мозг — 5 больных (токсическая энцефалопатия).
В данный список не вошли органы иммунной системы, поражение которых при сепсисе обязательно и несет, как правило, декомпенсированный характер.
У всех детей исследованы показатели периферической крови в динамике. Сроки исследований строго соответствовали в обеих группах и были одинаковыми от начала заболевания.
Обращает на себя внимание, что у детей с генерализацией инфекционного процесса (первая группа) имело место выраженное снижение лейкоцитоза в разгар болезни (до 9,5+ + 1,6109/л) по сравнению с исходными данными (15,7+2,3109/л) и данными группы сравнения (14,1+1,0109/л, t=2,4), где, наоборот, в этот период болезни наблюдалось увеличение лейкоцитоза. К моменту выписки эти различия выравнивались. Такая же тенденция к снижению процентного содержания сегментоядерных нейтрофилов' имела место у детей первой группы в разгар заболевания с последующим повышением их к периоду выздоровления. Однако абсолютное число сегментоядерных нейтрофилов в разгар болезни у детей первой группы не отличалось от такового в группе сравнения, но к концу заболевания становилось значительно больше.
Процентное и абсолютное число палочкоядерных нейтрофилов в начале болезни у детей первой группы достоверно выше, чем у больных второй группы. В разгар болезни эти различия сохранялись, и только к выздоровлению данные показатели достоверно не различались в исследуемых группах. У детей с сепсисом абсолютное и процентное количество базофилов в разгар болезни в 2 раза меньше по сравнению с больными второй группы. К концу болезни эта тенденция сохранялась. Количество эозинофилов в обеих группах больных существенно не различалось на протяжении всего заболевания. Отмечено низкое число лимфоцитов (абсолютное и процентное) во все периоды заболевания у детей с сепсисом.
Абсолютное количество моноцитов в начале болезни у детей первой группы значительно превосходило таковое во второй группе больных. Однако в середине заболевания, наоборот, отмечалась тенденция к снижению их числа с последующим ростом к периоду выздоровления. Вероятно, это связано с тем, что среди детей с сепсисом наблюдается больше случаев хро- низации остеомиелитического процесса, который, как показано выше, характеризуется относительным моноцитозом.
Показатели эритроцитов и гемоглобина у детей первой группы также невыгодно отличались от таковых в группе сравнения.
У больных с генерализацией воспалительного процесса отмечалось значительное повышение СОЭ в середине болезни по сравнению со второй группой (соответственно 44,5+5,0 и 35,5±2,0; t=l,7). При этом относительно высокая СОЭ у них оставалась и к выписке (26,8±4,3 и 16,2±2,0 мм/ч; t=2,2).
Низкие уровни IgG у детей первой группы наблюдались в начале заболевания и в его разгар. Их значения более чем в 2 раза ниже по сравнению с таковыми у больных второй группы. Но к концу болезни, наоборот, уровни IgG у детей первой группы достоверно превосходили этот показатель в группе сравнения.
Исходные значения IgM у детей первой группы были очень низкими относительно группы сравнения. К середине заболевания у детей с сепсисом отмечен значительный рост уровня IgM, который продолжался до периода выздоровления, в то время как во второй группе наблюдалось постепенное снижение IgM в течение всего заболевания.
При сепсисе у детей имели место сравнительно низкие уровни сывороточного IgA в процессе всего заболевания, причем в острый период болезни концентрация IgA в сыворотке не превышала 0,7—0,8 г/л.
На фоне относительного снижения уровней иммуноглобулинов всех классов у детей с сепсисом имело место резкое угнетение синтеза антител к стафилококковому ос-токсину. Количество В-РОК у этих больных также относительно ниже, чем у детей второй группы.
Снижение числа Т-РОК наблюдалось в обеих группах в течение всей болезни. Но у детей с сепсисом дефицит Т-РОК выражен в большей степени, особенно в острый период заболевания. Уровень гемолитического комплемента у детей первой группы достоверно снижен по сравнению с таковым у больных второй группы, причем эти различия наиболее выражены в разгар болезни. Концентрация лизоцима в сыворотке крови у детей первой группы достоверно ниже с самого начала болезни до выздоровления. Минимальные значения лизоцима наблюдались в разгар заболевания.
Обнаружено чрезвычайно низкое количество фагоцитирующих нейтрофилов (ФА) у детей с сепсисом в процессе всего заболевания. В группе сравнения ФА также снижена, но не в такой степени. ФИ нейтрофилов у детей первой группы также имел относительно низкие значения.
Таким образом, генерализация воспалительного процесса у детей с ОГО обусловлена глубокими нарушениями системы АИР организма, причем эти нарушения касаются практически всех изученных звеньев иммунобиологической защиты.
В наибольшей степени выражено угнетение в Т-системе иммунитета. С самого начала заболевания до периода клинического выздоровления имеет место значительный дефицит Т-РОК.
В остром периоде заболевания у детей с сепсисом отмечается значительное снижение синтеза сывороточных IgG, IgM, IgA одновременно с угнетением антителогенеза к стафилококковому ос-токсину.
Генерализация воспалительного процесса сопровождается глубокими нарушениями в системе фагоцитирующих нейтрофилов. В течение всего заболевания отмечаются чрезвычайно низкие показатели ФА и ФИ. Кроме того, у детей с сепсисом выявлен существенный дефицит гуморальных факторов неспецифической резистентности организма. Так, снижение концентрации гемолитического комплемента у них обнаружено в течение всего заболевания, особенно в остром периоде. Вместе с тем в сыворотке крови больных сепсисом значительно снижен уровень лизоцима от начала болезни до периода выздоровления.
Интересные данные получены при исследовании показателей периферической крови у детей с сепсисом. Так, в разгар заболевания у них, как правило, обнаружено снижение лейкоцитоза, в то время как в группе сравнения он достигает максимальных значений. Одновременно со снижением лейкоцитоза у детей с сепсисом в разгар болезни наблюдается снижение процентного содержания сегментоядерных нейтрофилов и повышение количества (абсолютного и процентного) палочкоядерных нейтрофилов.
Следует обратить внимание на резкое снижение абсолютного и процентного числа лимфоцитов, как правило, сопровождающее генерализацию остеомиелитического процесса в течение всего заболевания.
У таких больных отмечена тенденция к повышению ко-
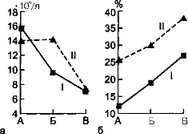
Рис. 8.7. Динамика лейкоцитоза и количества лимфоцитов в периферической крови у детей с сепсисом и детей группы сравнения, а — динамика лейкоцитоза; б — динамика количества лейкоцитов: I — первая группа, II — вторая группа, А — начало болезни, Б — разгар болезни, В — выздоровление.
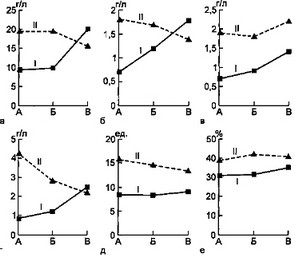
Рис. 8.8. Динамика показателей системы АИР у детей с сепсисом и детей группы сравнения.
а — динамика IgG; б — динамика IgM; в — динамика IgA; г — динамика титров антител к стафилококковому а-токсину; д — динамика лизоцима; е — динамика гемолитического комплемента: I — первая группа, II — вторая группа, А — начало болезни, Б — разгар болезни, В — выздоровление.
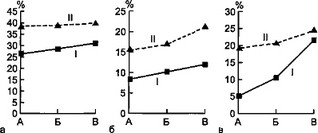
 Рис. 8.9. Динамика некоторых показателей системы АИР у детей с сепсисом и детей группы сравнения.
Рис. 8.9. Динамика некоторых показателей системы АИР у детей с сепсисом и детей группы сравнения.
а — динамика количества Т-РОК; б — динамика количества В-РОК; в — динамика фагоцитарной активности нейтрофилов; г — динамика фагоцитарного индекса: I — первая группа, II — вторая группа, А — начало болезни, Б — разгар болезни, В — выздоровление.
личества моноцитов в начале и конце болезни. У них практически постоянно имеет место снижение гемоглобина и количества эритроцитов в периферической крови. Довольно постоянным признаком при сепсисе являются относительно высокие показатели СОЭ во второй половине заболевания (рис. 8.7-8.9).
Таким образом, критериями генерализации воспалительного процесса при ОГО являются следующие показатели:
- Резкое снижение абсолютного и процентного числа лимфоцитов в разгар болезни (lt;15—17 % и lt;1,5—1,7±10 ул).
- Тенденция к снижению лейкоцитоза в остром периоде заболевания вместе с уменьшением количества палочкоядерных нейтрофилов.
- Постоянная, трудно поддающаяся лечению анемия.
- Повышение СОЭ в середине болезни или отсутствие тенденции к ее нормализации.
- Дефицит практически всех факторов системы АИР организма.
- Резкое снижение количества Т-РОК в процессе заболевания.
- Чрезвычайно низкие показатели ФА нейтрофилов (lt;10 %) и ФИ (lt;2,4) в остром периоде заболевания.
Основным правилом в лечении детей с ОГО, определяющим исход и течение болезни, считают раннее вскрытие и дренирование костномозгового канала. Оптимальными сроками оперативного вмешательства являются первые 6—8 ч от начала заболевания, до развития поднадкостничной флегмоны. К сожалению, условия работы нашей клиники (в пределах Московской области) не позволяют нам в полной мере осуществлять этот принцип. Большинство больных, госпитализированных в отделение, были оперированы в ЦРБ по месту жительства в среднем на 2—7-е сутки от начала заболевания. Только в 8 случаях операция произведена в пределах 1-х суток. В последующем у 6 из них практически отсутствовали признаки деструкции костной ткани, а у 2 изменения были минимальными. Кроме того, у этих детей не наблюдался переход остеомиелита в хроническую форму. Результаты оперативных вмешательств, выполненных в более поздние сроки, оставляют желать лучшего.
Операцией выбора являются остеоперфорация с санацией и дренированием костномозгового канала и вскрытие и дренирование остеомиелитической флегмоны.
Следует подчеркнуть, что к остеоперфорации мы прибегаем и в более поздние сроки, когда по месту жительства уже была вскрыта флегмона. Так, в 9 случаях остеоперфорация была сделана на 8—25-е сутки от начала заболевания, при наличии вскрытой флегмоны. При этом во всех случаях из костномозгового канала получено много гноя под давлением.
Операцию производят следующим образом. Перед операцией в палате определяется и отмечается область наибольшей болезненности путем пальпации и легкой перкуссии. При отсутствии изменений в мягких тканях (визуально или после их пункции) остеоперфорацию производят чрескожно. При наличии флегмоны ее вскрывают широким разрезом (до здоровых тканей) с контрапертурами при гнойных затеках.
Первую перфорацию производят в центре измененного участка кости, который обычно лишен надкостницы. Отверстия просверливают с помощью электродрели сверлами диаметром от 2 до 5 мм в зависимости от вида кости и возраста ребенка, в количестве от 2 до 6—8 и более.
Следует отметить, что мы не являемся сторонниками мелких решетообразных перфораций, которые, во-первых, снимая внутрикостное давление сразу после операции, в дальнейшем не выполняют этой функции, так как обычно эти точечные отверстия закрываются фибрином и детритом. Во-вторых, они практически не обеспечивают дренажной функции, и основная масса гноя, костномозгового детрита и фибрина остается в кости, поддерживая в ней гнойно-деструктивный процесс. В-третьих, точечные остеоперфорации не позволяют полно
ценно санировать костномозговой канал и проводить внутри- костную лазеротерапию.
-Для определения размеров гнойного очага в кости через первое отверстие, сделанное в центре поражения, вводят раствор метиленового синего. Прокрашенный участок будет служить ориентиром объема поражения кости. Остеоперфорации, произведенные по периферии очага, должны быть вне распространения метиленового синего.
В верхнее и нижнее отверстия вводят двухпросветные силиконовые или пластиковые трубки, через которые производят промывание гнойной полости антибиотиками или антисептиками и вводят проводник для лазеротерапии. Мы не сторонники проточного промывания кости, так как оно приводит к разрушению биологического барьера, формирующегося гнойного очага или препятствует его образованию, способствуя обсеменению костномозгового канала.
Промывание кости производят с помощью шприца (после отсасывания гноя из полости) до чистых вод, не создавая большого давления. Заканчивается промывание введением антибиотиков. В качестве промывных сред применяют растворы антисептиков (диоксидин, хлоргексидин, гипохлорид натрия, эктерицид и др.) или антибиотиков (в зависимости от чувствительности микрофлоры). Дренажи из костномозгового канала удаляют после прекращения отделяемого, в среднем на
- 10-е сутки после операции.
После прекращения общей и местной антибактериальной терапии проводят курс электрофореза антибиотиков и Са2+. Когда гнойный очаг достаточно санирован (освобожден от гнойного содержимого), назначают УВЧ-терапию ежедневно
- 8 сеансов, мощностью 15—30 Вт в зависимости от возраста и объема пораженной конечности.
Кроме того, назначают УФО послеоперационной раны в дни, когда УВЧ-терапию не проводят. УФО начинают с V2 биодозы и доводят до 1. В более позднем периоде назначают электрофорез 20 % раствора хлорида кальция. Сила тока зависит от возраста ребенка и составляет от 1,5 до 2 мА или от 4 до 6 мА. Курс лечения — от 10 до 15 процедур по 15 мин. Электрофорез сочетается с инфракрасным лазерным облучением очага, частотой 80 Гц, временем воздействия от 32 с до
- мин в зависимости от возраста.
В ближайшие дни после операции мы, как правило, назначаем магнитотерапию с постоянным слабым магнитным полем при напряжении 2 Гс. В результате действия магнитного поля у детей быстрее исчезает отек (в среднем на 2—5 дней) и на
- 5 дней раньше заживает рана.
В комплексное лечение ОГО обязательно входит ГБО курсом от 7 до 12 сеансов. Этот метод оказывает не только мощное воздействие на воспалительный очаг, являясь одним из эффективных профилактических мероприятий хронизации остеоми- елитического процесса, но и обладает значительным общим влиянием на иммунобиологическую резистентность организма.
После окончания лечения и выписки из стационара дети подлежат повторной госпитализации через 1 мес для проведения противорецидивного курса лечения. В последующем эти курсы повторяют каждые 2—3 мес. Такое превентивное лечение включает в себя, помимо общей терапии (витаминотерапия, иммунокоррекция, препараты кальция и фосфора, мумие, массаж, ЛФК), и местное лечение: курс электрофореза (фоно- фореза) антибиотиков, хлорида кальция, УВЧ, ГБО, инфракрасный лазер.
Местное лечение хронических форм остеомиелита в стадии
обострения ограничивается вскрытием и дренированием флегмоны, физиотерапией. При ликвидации острого воспаления радикальную операцию производят, как правило, при сформировавшемся хроническом остеомиелите. Считаем, что диагноз "хронический остеомиелит" правомерен при наличии следующих признаков: 1) рецидива воспалительного процесса; 2) наличия гнойного свища и сформировавшегося секвестра с сек- вестральной полостью или только формирующихся секвестров;
- наличии костных полостей на фоне выраженных склеротических изменений костной ткани.
Формирование хронических очагов в кости происходит, по нашем наблюдениям, на 30—80-е сутки от начала заболевания.
Оперативному лечению подвергают детей, если имеют место признаки хронизации. При наличии костных полостей без секвестров и рецидивов продолжают консервативное лечение, проводя 1 раз в 1—2 мес вышеуказанные противорецидивные курсы. Рентгенологический контроль в таких случаях проводят
- раз в 2 мес.
Операция заключается в иссечении свища, остеотрепанации, секвестрэктомии, санации костной полости и ее дренировании.
При таких осложнениях остеомиелита, как патологические переломы, ложные суставы и обширные дефекты костной ткани, мы применяем с 1991 г. способ лечения хронического остеомиелита с дефектом кости (патент на изобретение № 1503775, 1996 г.), заключающийся в пересадке аутокостного мозга в очаг дефекта кости.
Способ осуществляется посредством хирургической операции. Рассекают мягкие ткани. Выделяют область дефекта костной ткани (патологического перелома, ложного сустава). Концы костных фрагментов и прилегающие ткани очищают от рубцов и грануляций. В обоих фрагментах кости ближе к дефекту толстой иглой Киршнера или тонким сверлом создают костные каналы диаметром 1—2 мм в количестве 3—5 на 1 см2 в различных направлениях, в которые вводят свежий костный
Рис. 8.10. Внутрикостная трансплантация костного мозга при ложном суставе.
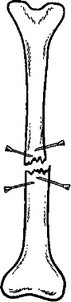 мозг, взятый у больного во время этой же операции из крыла подвздошной кости, пяточной кости, метафиза бедра ц др. Дополнительно аутологичный костный мозг вводят и в область дефекта, вне костной ткани.
мозг, взятый у больного во время этой же операции из крыла подвздошной кости, пяточной кости, метафиза бедра ц др. Дополнительно аутологичный костный мозг вводят и в область дефекта, вне костной ткани.
В целом для операции необходимо от 5,0 до 30,0 мл костномозгового пунктата в зависимости от размеров кости и дефекта. Производят надежную иммобилизацию или фиксацию костных фрагментов.
В ряде случаев операцию можно выполнить закрытым способом. Остеоперфорации (каналы) формируют чрескожно спицей Киршнера с введением по ней иглы, через которую по извлечении спицы в проделанный канал вводят костномозговой пунктат (рис. 8.10).
Данный способ имеет значительные преимущества перед другими методами. Во- первых, используется свежий костный мозг, взятый во время той же операции у этого же больного и не подвергающийся культивированию и консервации. Во-вторых, аутологичный костный мозг вводят непосредственно в костную ткань через каналы, сформированные в кости во время операции. В-третьих, способ осуществляется без применения костных трансплантатов. В-четвертых, оперативное лечение проводят в один этап. В-пятых, в ряде случаев операцию можно выполнить закрытым способом (без рассечения мягких тканей).
Положительный эффект аутотрансплантации костномозгового пунктата непосредственно в кость, пораженную остеоми- елитическим процессом, связан с введением генетически однородной ткани, производной мезодермы, усилением остеогенеза, вызванного реакцией фибробластов костного мозга, а также — с нормализацией воспалительных и деструктивных изменений в кости вследствие введения в нее стволовых клеток иммунобиологической защиты (клеток нейтрофильного и лимфоцитарного ростка). Кроме того, внутрикостное введение костномозгового пунктата способствует восстановлению циркуляции крови в кости и развитию механоцитов. Приводим клинический пример.
Больная А., 5 лет, болела хроническим гематогенным остеомиелитом левой бедренной кости (свищевая форма) с 1990 г. Многократно
оперирована. При поступлении в клинику выявлен гигантский секвестр, занимающий практически весь диафиз бедренной кости (рис. 8.11, а). Произведена операция — секвестрэктомия, санация и дренирование секвестральной полости. В результате образовался значительный дефект костной ткани. В последующем костный дефект сократился, однако сформировался ложный сустав. Попытки консервативного и хирургического лечения (на аппарате Илизарова) в течение
- мес были безуспешными. Отмечено укорочение левого бедра на 10 см, отставание в развитии левой нижней конечности с выраженной мышечной гипотрофией (рис. 8.11, б). Произведена операция согласно описанному выше способу — резекция ложного сустава с фиксацией отломков спицей Киршнера и аппаратом Илизарова и введением аутологичного костного мозга в каналы, созданные в проксимальном и дистальном фрагментах кости. Каналы сделаны толстой спицей Киршнера в количестве 4 на 1 см2 в различных направлениях. Костномозговой пунктат взят из пяточной кости здоровой ноги (всего 15 мл). Рана зажила первичным натяжением. Отмечена полная консолидация дефекта кости. Выписана домой через 4 мес в удовлетворительном состоянии с полным заживлением ложного сустава и укорочением левого бедра на 10 см. Через 10 мес укорочение бедра уменьшилось и составило 7 см. Признаки мышечной гипотрофии выражены значительно меньше. Девочка ходит без костылей, ее ожидают ортопедические мероприятия по удлинению конечности. Результат после ортопедической операции представлен на рис. 8.11, в.
Хорошие результаты получены при лечении деструкции костей при ОГО при помощи миакальцика. Миакальцик регулирует обмен кальция и обменные процессы в костной ткани. Примером результатов такого лечения может служить следующее наблюдение.
Больная К. в возрасте 4 лет заболела острым гематогенным остеомиелитом. Первая хирургическая помощь была оказана в районной больнице. В МОНИКИ ребенок поступил с деструкцией левой большеберцовой кости в нижней трети, патологическим переломом и небольшим подвывихом со значительным ограничением пассивных движений вЛголеностопном суставе (рис. 8.12, а, б). Ростковый хрящ частично разрушен.
Была наложена глубокая лонгета. Начато физиотерапевтическое лечение: магнито-, УВЧ-терапия, электрофорез кальция, комплекс витаминов А, В, С, D, Е, антибактериальная и общеукрепляющая терапия. Желаемого эффекта не получено. Консолидация кости не наступала. Начато лечение миакальциком. Препарат вводился внутримышечно и внутривенно по 50 ME ежедневно 2 раза в сутки первые дни, а затем с 7-го дня 1 раз в сутки в течение 4 нед. Одновременно ребенок ежедневно получал препараты кальция по 250 мг внутрь и витамины А, В, С, D.
Проведено 2 курса лечения, после чего наступило сращение в области патологического перелома (рис. 8.12, в), но оставалось искривление по оси дистального метаэпифиза, по поводу чего произведена хирургическая коррекция путем остеотомии. Кость срослась. Наступило практически полное восстановление кости.
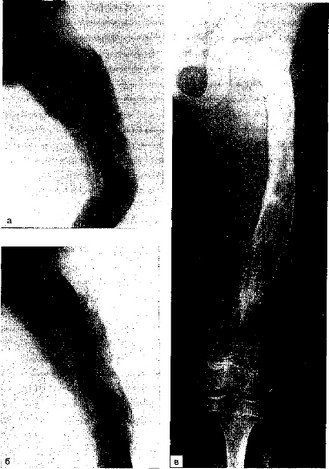
Рис. 8.11. Рентгенограммы. Острый гематогенный остеомиелит у больной А.
а — секвестр, занимающий весь диафиз левого бедра; б — результат 6-месячного оперативного и консервативного лечения. Укорочение бедра на 10 см; в — состояние после пересадки костного мозга и ортопедической операции по удлинению кости.
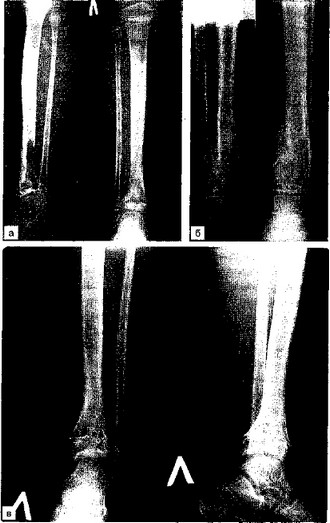
Рис. 8.12. Рентгенограммы. Острый гематогенный остеомиелит у больной К.
Ребенок осмотрен через 2 года — отставания левой конечности в росте нет, движения в голеностопном суставе в полном объеме, походка не затруднена.
В заключение данной главы следует отметить, что остеомиелит у детей развивается на фоне глубоких нарушений системы АИР организма.
Закономерным для ОГО является резкое угнетение В-сис- темы иммунитета, выражающееся в снижении синтеза антител к этиологическому фактору и продукции сывороточных иммуноглобулинов классов G, М, А.
Хронизация остеомиелитического процесса уже на ранних стадиях развития (в доклинический период) сопровождается характерными изменениями в иммунограмме. Закономерными признаками в иммуногенезе хронического остеомиелита являются активация гуморального звена на фоне угнетения Т-сис- темы иммунитета.
Ретроспективный анализ клинико-иммуномикробиологи- ческих исследований позволил определить ранние критерии хронизации остеомиелита и основные принципы превентивных мероприятий, которые следует проводить еще в остром периоде заболевания.
Грубые нарушения системы АИР у детей с ОГО определяют высокий риск развития у них генерализации воспалительного процесса, основные критерии которой подробно изложены в данной главе.
В комплексном лечении ОГО большое значение имеет ДПА, позволяющий эффективно бороться с эндотоксикозом и значительно улучшить результаты лечения.
В качестве модулятора системы АИР патогенетически обосновано применение тактивина. Посредством активизирующего влияния на Т-лимфоциты тактивин вызывает положительную реакцию других звеньев АИР (синтез IgM и IgA, гемолитического комплемента, В-РОК, ФА и ФИ, продукцию антител).
Чрезвычайно важным компонентом в лечении ОГО является ГБО, которая не только влияет положительно на течение заболевания, но и является превентивным мероприятием, снижающим вероятность хронизации воспалительного процесса в костной ткани. Эффект модулирующего влияния ГБО на воспалительный процесс связан с сокращением (угнетением) сосудисто-экссудативной фазы воспаления, определяющей интенсивность альтеративных и деструктивных процессов в очаге, и lt;
а — боковая и прямая проекции. Деструкция левой большеберцовой кости в нижней трети; б — патологический перелом в месте деструкции с подвывихом; в — прямая и боковая проекции. Окончательный результат лечения.
стимуляцией пролиферативной фазы, характеризующейся преобладанием репаративных реакций. Отчетливый эффект стимуляции фагоцитоза, Т-РОК и продукции IgG делает ГБО патогенетически обоснованным лечебным мероприятием у детей с ОГО.
Наиболее оптимальным методом хирургического лечения ОГО являются ранние множественные остеоперфорации с полноценным дренированием и санацией гнойного очага.
Следует подчеркнуть, что остеоперфорации (первичные или повторные) показаны и в более отдаленные сроки заболевания.
При хроническом остеомиелите, осложненном патологическими переломами, дефектами костной ткани, ложными суставами, весьма эффективным является применение аутотрансплантации костномозговой ткани.
А так же в разделе «Генерализация воспалительного процесса. Сепсис »
- Некоторые особенности этиологической структуры и течения воспалительного процесса у детей с острым гематогенным остеомиелитом
- Состояние гуморального иммунитета у детей с острым гематогенным остеомиелитом
- Общие принципы лечения детей с острым гематогенным остеомиелитом
- Применение тактивина в комплексном лечении детей с острым гематогенным остеомиелитом
- Влияние гипербарической оксигенации на течение воспалительного процесса при остром гематогенном остеомиелите
- ЗАКЛЮЧЕНИЕ
- СПИСОК ОСНОВНОЙ ЛИТЕРАТУРЫ