Некоторые особенности воспалительного процесса у детей с осложненными формами разлитого гнойного перитонита
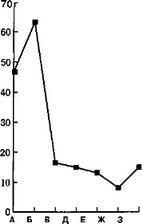
В начале заболевания в этиологической структуре РГП преобладает Е. coli (61,7 %). Вторым микроорганизмом по частоте идентификации является Ps. aeruginosa (36,6 %). Staphylococcus занимает третье место (20,0 %). Остальные микроорганизмы имеют второстепенное значение в этиологии РГП. Отрицательные посевы имели место в 11,7 % случаев (рис. 6.15).
В разгар болезни отмечается снижение высеваемости Е. coli до 46,7 % при нарастании удельного веса Ps. aeruginosa (63,3 %). Несколько уменьшилась идентификация Staphylococcus (16,6 %). Динамика высеваемости остальных микроорганизмов незначительна. Наблюдается рост числа отрицательных посевов (до
- %).
При реконвалесценции (перед удалением дренажа из брюшной полости) Е. coli встретилась в 35 % случаев, при росте высеваемости Ps. aeruginosa до 71,7 %. Staphylococcus высеян в
- % наблюдений. Количество отрицательных посевов возросло до 18,3 %.
Следует отметить, что в этиологической структуре РГП значительно преобладают грамотрицательные микроорганизмы (в начале заболевания — 64,7 %, в разгар болезни — 83,4 %, в конце заболевания — 85,0 %). В большинстве случаев из брюшной полости наблюдаемых больных выделены ассоциации микробов (76,7 %). Чаще всего отмечались ассоциации Е. coli с Ps. aeruginosa (66,7 %), Е. coli с Staphylococcus (46,7 %), Ps. aeruginosa с Staphylococcus (43,3 %), E. coli с НГОБ (31,6 %).
Столь значительный удельный вес грамотрицательной микрофлоры и микробных ассоциаций объясняется тем, что подавляющее большинство больных поступили в клинику с довольно запущенным, осложненным " перитонитом и многие из них оперированы повторно.
Для оценки состояния системы АИР у всех наблюдаемых больных с РГП изучен ряд гуморальных и клеточных факторов иммунобиологической защиты.
Уровень IgG у детей с РГП с высокой достоверностью превышает нормальные показатели в начале заболевания, значительно повышаясь в разгар болезни, и остается относительно высоким к периоду реконвалесценции. Концентрация IgM высока в течение всего заболевания и не имеет тенденции к нормализации при клиническом выздоровлении.
Следует отметить, что выраженной реакции IgA не наблюдается в течение всей болезни. Это может быть косвенным признаком эндогенного распространения инфекции.
Изучение динамики количества Т-РОК показало значительное снижение абсолютного и процентного количества этих

 б
б
 %
%
,Рис. 6.15. Состав аэробной микрофлоры содержимого брюшной полости при разлитом гнойном перитоните.
В
а —. в начале болезни; б — в разгар болезни; в — в период реконвалесценции: А — Е. coli, Б — синегнойная палочка, В — стафилококк, Г — стрептококк, Д — клебсиелла, Е — НГОБ, Ж — энтерококк, 3 — роста не обнаружено.
лимфоцитов в остром периоде болезни с нормализацией к периоду выздоровления. Число Т-активных лимфоцитов снижено в остром периоде болезни, но повышается к концу заболевания. Количество В-РОК значительно повышено в остром периоде болезни с тенденцией к нормализации при выздоровлении. При этом изменение абсолютного и процентного содержания Т- и В-лимфоцитов происходит на фоне резкого снижения общего количества лимфоцитов в остром периоде заболевания.
Сниженное количество теофиллинрезистентных Т-РОК позволяет косвенным образом иметь представление о количестве Т-хелперов. Число теофиллинчувствительных Т-РОК дает общее представление о содержании Т-супрессоров. Их количество также несколько снижено относительно нормальных значений.
Следует подчеркнуть, что у детей с РГП в течение всего заболевания имеет место значительное угнетение ФА нейтрофилов, особенно в остром периоде. При этом показатели ФИ повышены во все периоды болезни. Вероятно, это является компенсаторным механизмом фагоцитарной реакции грануло- цитов.
В остром периоде заболевания отмечается достоверное снижение уровня гемолитического комплемента (СН50). При выздоровлении имеется небольшая тенденция к его повышению. Дефицит СН50 может быть связан с усиленным его потреблением при нарастании интенсивности гуморальных реакций, в частности образовании ИК.
Обращает на себя внимание достоверное повышение уровней ЦИК — как высокомолекулярных, так и низкомолекулярных — в остром периоде заболевания с последующей их нормализацией к периоду выздоровления. Известна биологическая активность ИК, которая обусловливается такими эффектами, как повреждение клеток крови (гранулоцитов), повышение проницаемости мембран, пролиферация эндотелия, дегенерация тканей, сокращение гладких мышц. Эти явления сопровождаются, как правило, повышением температуры тела, токсикозом, аллергическими реакциями различных типов. Известно также, что у-глобулины, агрегированные в результате химических реакций или нагревания, приобретают свойства, аналогичные иммунным комплексам. Патогенность ИК зависит от их размеров. Крупные ИК, образованные преимущественно IgM, проявляют более высокую активность по сравнению с небольшими ИК, образованными в основном IgG.
Эти обстоятельства побудили нас изучить зависимость уровней сывороточных IgG, IgM, IgA от содержания ЦИК у детей с разлитым гнойным перитонитом. Результаты этих исследований отражены на рис. 6.16.
Как видно на рис. 6.16, стабильно высокие уровни ЦИК (высокомолекулярных и низкомолекулярных) были связаны с повышением концентрации IgG (t = 2,0) и стабильно высокой концентрацией IgM. Снижение концентраций IgG и IgM к концу заболевания сопровождалось достоверным падением уровней ЦИК обеих фракций.
Количество ЦИК находится в прямой зависимости от уровней IgG и IgM. Это обстоятельство необходимо учитывать при проведении заместительной иммунотерапии. Создание избытка иммуноглобулинов (или антител) в крови может привести к повышению количества ЦИК. При угнетении фагоцитоза или снижении уровня комплемента (основных факторов элиминации ИК) возможно развитие патологических реакций острого и хронического характера. Поэтому терапия гипериммун- ными препаратами при РГП требует строгого обоснования и осторожности. Мы рекомендуем проводить пассивную иммунотерапию детям, у которых уровень IgG меньше 10,0—12,0 г/л, a IgM — меньше 1,0 г/л. При преимущественном повышении IgG следует применять гипериммунную плазму, а при высокой концентрации IgM — иммуноглобулины или у-глобулины. Избыточное количество иммуноглобулинов можно удалить из кровотока при помощи плазмафереза. При этом необходим иммунологический контроль.
Следует отметить, что при РГП наблюдается нарушение соотношения Т-хелперы/Т-супрессоры (2:1, при норме 3:1), что свидетельствует о нарушении Т-системы иммунитета. Это обстоятельство необходимо учитывать при иммунотерапии, в состав которой необходимо включать тимомиметики.
Таким образом, состояние системы АИР у детей с РГП характеризуется активацией гуморального звена иммунитета (синтеза иммуноглобулинов всех классов и количества В-РОК) на фоне значительного угнетения Т-системы иммунитета. Большую роль в патогенезе РГП играют глубокие нарушения активности нейтрофильного фагоцитоза. Определенное значение в развитии РГП имеет снижение уровня гемолитического комплемента.
Известно, что основным патогенетическим фактором, определяющим течение и исход заболевания, является эндотоксикоз. Для изучения степени и динамики эндотоксикоза у 60 детей с РГП изучены некоторые показатели интоксикации. Полученные данные свидетельствуют о высоком уровне токсикоза в остром периоде РГП (реактивной и токсической стадии). В разгар болезни и вплоть до клинического выздоровления наблюдаются высокие показатели гидроперекиси сыворотки и эритроцитов. Гидроперекись является промежуточным продуктом свободнорадикального окисления, одним из факторов, оказывающих влияние на развитие синдрома эндогенной интоксикации. Повышение гидроперекиси при РГП указывает на недостаточность эндогенной антиоксидантной системы.

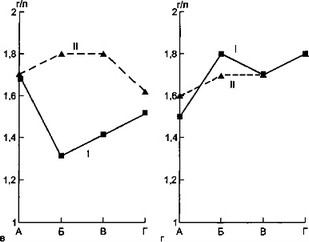
Рис. 6.16. Динамика сывороточных иммуноглобулинов классов G, М, А и ЦИК у детей с разлитым гнойным перитонитом под влиянием плазмафереза.
Содержание МДА в конце болезни достоверно ниже, чем в остром периоде. МДА эритроцитов в разгар болезни имеет четкую тенденцию к увеличению по сравнению с другими периодами заболевания. МДА является конечным продуктом ' свободнорадикального окисления. Он так же, как и другие продукты ПОЛ, приводит к структурной перестройке клеточных мембран вплоть до их полного разрыва, к необратимой инактивации ферментов, развитию диссеминированного внут- . рисосудистого свертывания крови. Столь незначительная динамика МДА с полной нормализацией в конце заболевания свидетельствует об адекватной терапии (детоксикационной и антиоксидантной). На это указывает постоянный рост сс-токо- ферола в процессе лечения.
Показатель МДА более информативен в качестве оценки уровня токсикоза, степени деструктивного процесса в брюшной полости, эффективности антиоксидантной (детоксикационной) терапии по сравнению с показателями гидроперекисей, являющихся начальными продуктами ПОЛ и менее стойкими. Установлено, что одной из причин активации ПОЛ при различных патологических процессах служит тканевая гипоксия.
А так же в разделе «Некоторые особенности воспалительного процесса у детей с осложненными формами разлитого гнойного перитонита »
- Характеристика поступивших больных
- Классификация перитонитов
- Операционные доступы и санация брюшной полости
- Кишечные сто мы и парентеральное питание при перитоните
- Ультразвуковое исследование в диагностике и лечении осложнений перитонита
- Ультразвуковой мониторинг при перитоните и после больших реконструктивных операций на органах брюшной полости
- Малые инвазивные вмешательства при интрапаренхиматозных и межпетельных абсцессах брюшной полости УЗИ в лечении абсцессов паренхиматозных органов
- УЗИ в лечении межпетельных абсцессов при помощи микролапаротомии
- Общие принципы консервативной терапии детей с разлитым гнойным перитонитом и его осложнениями Предоперационная подготовка
- Детоксикационная терапия у детей с разлитым гнойным перитонитом
- Энтеросорбция при помощи дезинтегрированного активированного угля
- Борьба с парезом желудочно-кишечного тракта
- Ультрафиолетовое облучение крови при перитоните
- Дифференцированная иммунотерапия у детей с осложненными формами разлитого гнойного перитонита
- Летальность при перитоните