Операционные доступы и санация брюшной полости
В зависимости от оценки перитонита рекомендуются и различные оперативные доступы. Если при первичной операции при остром аппендиците и сопутствующем местном перитоните или "диффузном", как его трактуют некоторые авторы, вполне достаточно разреза Волковича — Дьяконова или лапароскопической аппендэктомии, то при перитоните, захватывающем практически всю брюшную полость, тяжелом состоянии ребенка, выраженном парезе желудочно-кишечного тракта или при прогрессирующем перитоните возникает необходимость в лапаротомии или релапаротомии.
Срединной лапаротомии при выраженном перитоните отдают предпочтение многие детские хирурги уже при первичной операции [Кущ Н.Л. и др., 1986; Прутовых Н.Н. и др., 1989]. Имеется сообщение [Каплин В.Н., Гаслова А.А., 1980], что использование локального доступа в подобной ситуации приводило к наибольшему числу осложнений. Предпочтение срединной лапаротомии при повторных вмешательствах отдается большинством хирургов [Пулатов А.Т., 1989; Птицин А.И. и др., 1989].
Вся экстренная хирургическая помощь в Московской области оказывается в ЦРБ или ЦГБ, и дети поступали в нашу клинику уже после произведенных в районных больницах первичных операций: лапаротомии, ликвидации очага перитонита и санации брюшной полости. Таким образом, мы практически не встречались с перитонитами, требующими первичной операции. Но при прогрессировании перитонита или возникновении послеоперационных осложнений в соответствии с существующей в Московской области практикой двухэтапного лечения тяжелобольных (ЦРБ — МОНИКИ) и методическими указаниями такие дети переводятся в клинику. Именно поэтому наш опыт располагает таким большим числом наблюдений тяжелых форм перитонита.
При релапаротомии мы используем старый разрез или при необходимости производим средне-срединную лапаротомию, которая позволяет санировать всю брюшную полость, вплоть до сальниковой сумки (при остром панкреатите), устранить источник перитонита любой локализации, что без срединной лапаротомии не всегда возможно. Кроме того, необходимо интубировать кишечник.
В редких случаях, когда перитонит в результате лечения локализовался или сформировались абсцессы, проводятся локальные лапаротомии, возможно и через разрез Волковича — Дьяконова или при помощи малых инвазивных вмешательств под контролем УЗИ (о чем говорится ниже в специальном разделе).
Неоднозначно отношение детских хирургов и к санации
- брюшной полости. По мнению некоторых, промывание ее во время операции ведет к усилению резорбции токсинов во время лаважа или к увеличению патологических потерь. В свя- . зи с этим при перитоните, осложнившем острый аппендицит, брюшную полость вообще не промывают [Долецкий С.Я., Щи- тинин В.Е., 1986].
Большинство хирургов считают промывание брюшной по, лости при перитоните обязательным элементом ее санации. Санация брюшной полости начинается с удаления гнойного экссудата из области расположения очага, инфицирующего брюшную полость, устранения его и последующей последовательной санации остальных областей, их осмотра и ощупыва- . ния с обязательной ревизией поддиафрагмальных пространств. Для промывания брюшной полости применяют стандартные растворы гемодеза, 0,9 % раствор хлорида натрия. У большинства детей промывание брюшной полости в основном осуществляется изотоническим раствором хлорида натрия до чистых вод, а заканчивается однократным промыванием раствором гемодеза, хлоргексидином или гипохлоридом натрия. Удаление экссудата проводится при помощи электроотсоса, фибринозные наложения по возможности удаляют инструментами или тампонами. При случайном десерозировании кишки края брюшины над этим местом ушивают атравматическим узловым швом в поперечном направлении. В брюшную полость вводят 10—20 мл 1 % раствора диоксидина, разведенного в изотоническом растворе хлорида натрия.
Другие хирурги рекомендуют вводить в брюшную полость растворы метронидазола [Долецкий С.Я., Щитинин В.Е., 1986],
, различных антисептиков или ингибиторов протеаз [Нико- 1 нов В.М. и др., 1988].
Во время промывания брюшной полости некоторые хирурги проводят ультразвуковую кавитацию из расчета 1 Вт мощности ультразвукового потока на 1 см2 в 1 с [Круглый В.И., 2003].
. Пропагандируемый ранее перитонеальный диализ при перитоните, судя по современным публикациям, практически не применяют. Не применяли его и мы.
При релапаротомии обязательно проводят интубацию ки. шечника, находящегося в паретическом состоянии. Мы поль- 1 зуемся трансназальным методом интубации желудочно-кишеч- ; ного тракта двумя зондами, один из которых вводится в желу- ' док. Техника интубации кишечника и показания к ее применению описаны ниже.
' Брюшную полость дренируют двухпросветными силиконо- • выми дренажами (рис. 6.1). Один из них подводят к очагу и перитонита, другой — к месту наибольшего скопления гноя ¦¦ (правый латеральный канал и подпеченочное пространство или ¦елевый латеральный канал и поддиафрагмальное пространство). ", При необходимости дренируют оба латеральных канала. Таким
. 99
' 7*
Рис. 6.1. Схема постановки дренажей при разлитом гнойном перитоните в зависимости от места скопления гноя.
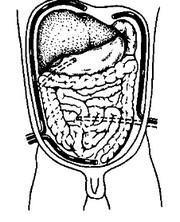 образом, брюшная полость дренируется двумя или тремя дренажами. По мере уменьшения отделяемого из них дренажи удаляют. Но всегда надо следить, чтобы сроки удаления дренажей на нарушались. В процессе лечения дренажи промывают растворами антибиотиков.
образом, брюшная полость дренируется двумя или тремя дренажами. По мере уменьшения отделяемого из них дренажи удаляют. Но всегда надо следить, чтобы сроки удаления дренажей на нарушались. В процессе лечения дренажи промывают растворами антибиотиков.
- Интраоперационная интубация кишечника
Ряд хирургических заболеваний и тяжелые оперативные вмешательства на органах брюшной полости у детей нередко сопровождаются таким грозным осложнением, как функциональная кишечная непроходимость. Парезы кишечника в послеоперационном периоде при перитоните встречаются практически у всех больных. Вследствие пареза задерживается пассаж содержимого и в просвете кишечника скапливается большое количество жидкости и газов, что приводит к значительному перерастяжению стенки кишки и нарушению интрамуральной гемодинамики. Повышенное давление в просвете кишечника уменьшает емкость сосудистого русла стенки кишки, повышает сосудистое сопротивление кровотоку, понижает приток крови и приводит к венозному застою, что вызывает гипоксию клеток, отек всех слоев, некробиотические изменения в стенке кишки и увеличение транссудации жидкости в просвет кишки. Кишечная стенка и просвет кишки превращается в депо крови, выключенное из кровообращения. Сгущение крови, возникающее в результате плазмопотери, ведет к
гипогидратации тканей, азотемии, гипокалиемии и метаболическим нарушениям, определяющим интоксикацию. В результате транссудации в просвет кишки жидкости, богатой белками и солями, изменяется кислотность внутрикишечной среды и создается благоприятная среда для размножения микроорганизмов, развития дисбактериоза, активации и выхода микробов из кишки в свободную брюшную полость. Нарастание интоксикации, особенно при перитоните, в свою очередь ведет к угнетению перистальтики кишечника, а консервативными методами купировать это не удается. С целью профилактики и лечения тяжелых парезов предложена механическая декомпрессия кишечника.
Существует много методов интраоперационной эвакуации кишечного содержимого: выдавливание, пункционная декомпрессия во время операции, подвесная энтеростомия, которая ввиду малоэффективное™, травматичности и частых осложнений в настоящее время практически не применяется.
Наибольшую популярность приобрела интраоперационная интубация кишечника: назогастральная, ретроградная через прямую кишку или через сформированный кишечный свищ.
Показания к интраоперационной декомпресии кишечника,
принятые в детском хирургическом отделении МОНИКИ.
- Парез кишечника И—III степени.
- Резкое переполнение и перерастяжение кишечника содержимым.
- Разлитой гнойный перитонит.
- Острая кишечная непроходимость.
- Рецидивирующая спаечная кишечная непроходимость.
- Наличие перфорационных отверстий и межкишечных анастомозов, особенно в условиях инфицированной брюшной полости.
- Значительная отечность стенки кишки и брыжейки.
- Травма кишечника и брыжейки, забрюшинные гематомы.
- Операции, связанные с рассечением большого числа спаек и десерозированием обширных участков кишки.
Зонды, применяемые для интраоперационной декомпрессии кишечника. Зонды условно можно разделить на три группы: одноканальные, двухканальные и многоканальные. В детской хирургической практике наибольшее распространение получили зонды двух первых видов. Промышленностью практически не выпускаются зонды для декомпрессии кишечника у новорожденных и детей младших возрастных групп. В связи с этим хирурги готовят зонды из силиконовых трубок, размягчающихся под действием температуры тела. Они должны быть достаточно эластичны, упруги, инертны по отношению к кишечной среде, достаточной длины и диаметра. Боковые отверстия лучше вырезать не ножницами, а кусачками Люэра. Расстояние между боковыми отверстиями должно составлять 5—8 см, а внутренний диаметр не должен превышать V4""V3 наружного диаметра зонда во избежание перегибов.
В табл. 6.3 приводятся размеры (длина и диаметр) зондов для назогастральной интубации кишечника; для ретроградной интубации (через прямую кишку) зонды должны быть длиннее на 20—50 см.
Таблица 6.3
Характеристика зондов для трансназальной интубации кишечника у детей
|
Возраст ребенка |
Диаметр, мм |
Длина, см |
Длина перфорированной части, см |
|
Новорожденные |
2-3 |
70 |
40 |
|
1—3 мес |
3 |
80 |
50 |
|
3—6 мес |
3 |
100 |
60 |
|
6—12 мес |
4 |
120 |
80 |
|
1—3 года |
4 |
150 |
90 |
|
3—7 лет |
5 |
180 |
100 |
|
7-11 лет |
6 |
200 |
120 |
|
11-14 лет |
7 |
250 |
150 |
Техника интубации кишечника. Перед операцией проводят эвакуацию содержимого желудка через желудочный зонд, который остается и на время операции. Выполняют срединную лапаротомию. При перитоните устраняют причину, осуществляют санацию и промывание брюшной полости растворами антисептиков. При механической кишечной непроходимости последняя устраняется только после интубации кишечника и эвакуации содержимого выше уровня непроходимости во избежание поступления и массивного всасывания токсичного кишечного содержимого через неизмененную кишку ниже уровня непроходимости.
При назогастральной интубации кишечника после эвакуации содержимого из желудка желудочный зонд удаляют и в корень брыжейки вводят 0,25 % раствор новокаина в возрастной дозировке. Зонд для интубации кишки смазывают вазелиновым маслом и через носовой ход вводят в желудок, где укладывают по большой кривизне и через пилорический отдел проводят в двенадцатиперстную кишку. Дальнейшее его продвижение по двенадцатиперстной кишке является наиболее сложным этапом интубации кишечника. Необходимо следить, чтобы зонд при введении не сворачивался в желудке. Хирург правой рукой продвигает зонд по большой кривизне желудка в двенадцатиперстную кишку, а пальцами левой руки, расположенными левее и ниже нисходящей и горизонтальной частей двенадцатиперстной кишки, направляет его конец. Ассистент правой рукой приподнимает поперечную ободочную кишку, а левой подтягивает начальный отдел тощей кишки, тем самым выпрямляет изгиб кишки в области связки Трейтца. После введения зонда в тощую кишку дальнейшее его продвижение не представляет трудности. Кишка при этом гофрируется, а зонд проводится в дистальном направлении до слепой кишки. При этом осуществляется аспирация кишечного содержимого. По окончании интубации конец зонда удерживается в слепой кишке, тонкая кишка расправляется с незначительным гофрированием и укладывается в брюшную полость, как при операции Нобля. Мы не рекомендуем плотное гофрирование, приводящее к укорочению длины кишки и более позднему восстановлению перистальтики. После укладки кишечника проверяют проходимость зонда и устраняют возможные его перегибы. Необходимо следить, чтобы боковые отверстия на зонде не располагались в желудке во избежание попадания кишечного содержимого в желудок с последующим развитием тяжелого гастрита, а располагались ниже связки Трейтца. По окончании манипуляции в желудок дополнительно вводят зонд для эвакуации желудочного содержимого. Во избежание случайного удаления кишечного зонда производят маркировку зондов и фиксацию лейкопластырем.
В послеоперационном периоде не реже 4—6 раз в сутки осуществляют промывание кишечного зонда изотоническим раствором хлорида натрия. С целью энтеральной детоксикации через зонд в кишку вводят на 30 мин раствор энтеродеза, гемодеза, мелкодисперсный активированный уголь, которые удаляются самотеком или легкой аспирацией шприцем.
На 2—3-й сутки после операции больных можно кормить бульоном, кефиром, киселями через рот или энтеральный зонд, при этом кишечный и желудочный зонды перекрываются на 1—2 ч. Длительность нахождения зонда в кишечнике определяется восстановлением перистальтики, появлением самостоятельного стула и отсутствием застойных масс в желудке. Пассаж по кишечнику восстанавливается в течение 3—5 сут.
Для медикаментозной стимуляции перистальтики кишечника через 8—12 ч после операции больным назначают прозерин или церукал 3 раза в сутки в возрастной дозировке. При их неэффективности дополнительно назначают внутривенное введение гипертонических растворов хлорида натрия, глюкозы, плазмы. В случае болевой реакции на медикаментозную стимуляцию применяют спазмолитики, а при сохраняющемся болевом синдроме они отменяются. На 3—4-е сутки после операции кишечный зонд перекрывают и при получении стула зонд удаляет только врач, так как возможно развитие ряда осложнений. Перед удалением больному дают выпить 10—30 мл вазелинового масла и через зонд дополнительно вводят еще 10—30 мл, затем зонд медленно извлекают. При возникновении болевого синдрома тракции временно прекращают. В этом случае нельзя прибегать к активной аспирации кишечного содержимого, так как возможно всасывание слизистой оболочки кишки в зонд с последующей ретроградной инвагинацией или эрозией слизистой оболочки и возможным кровотечением.
При извлечении половины длины зонда необходимо помнить, что через отверстия в нем поступает кишечное содержимое и может развиться аспирация в дыхательные пути. В связи с этим дети старшего возраста должны сделать глубокий вдох и задержать дыхание до извлечения зонда. Затем необходимо промыть желудок изотоническим раствором хлорида натрия и удалить желудочный зонд.
Относительные противопоказания для назогастральной интубации кишечника. К ним относятся инфекционный процесс в полости среднего уха и носоглотки, острый бронхит, ларин- готрахеит, пневмония, эзофагит, стеноз пищевода.
Возможные осложнения назогастральной интубации кишечника. Их составляют кровотечение из травмированной слизистой оболочки желудка, пищевода и кишечника; пролежень и перфорация кишечника, синусит, отит, эзофагит, пневмония. Большинство этих осложнений возникает при несоблюдении техники интубации, неправильном послеоперационном уходе и очень длительном нахождении зонда в кишечнике.
Ретроградная интубация кишечника через прямую кишку. Этот вид интубации применяют как самостоятельный метод, а также при изолированном парезе толстой кишки, безуспешности и наличии противопоказаний для назогастральной интубации кишечника. Для ретроградной интубации используют зонды того же диаметра, что и при назогастральной декомпрессии. Перфоративные отверстия на зонде должны быть расположены только в тощей кишке, так как аспирация кишечного содержимого предотвращает его поступление в дистальные отделы кишечника и, кроме того, отверстия, расположенные в толстой кишке, легко закрываются плотными каловыми массами, что приводит к закупорке зонда. При проведении зонда значительные трудности встречаются в области левого изгиба ободочной кишки и илеоцекального клапана баугиниевой заслонки. Зонд необходимо провести до связки Трейтца. Дополнительно трансназально устанавливают зонд в желудок. В послеоперационном периоде также осуществляют промывание зонда изотоническим раствором хлорида натрия и аспирацию кишечного содержимого. После исчезновения застойных масс в желудке, восстановления перистальтики и появления самостоятельного стула зонд удаляют (нередко выходит самостоятельно). -
При ретроградной интубации кишечника возможны следующие осложнения: раннее отхождение зонда, завязывание его в узел, пролежни и кровотечение из слизистой оболочки кишечника, перфорация кишки, инвагинация при извлечении зонда. Противопоказания: язвенный колит, проктит с болевым синдромом, кишечные инфекции.
При неудачных попытках назогастральной и ретроградной интубации кишечника для его декомпрессии необходимо создать цекостому или цекоаппендикостому и через нее выполнить интубацию тонкой кишки.
Если во время операции требуется создание кишечной сто- мы, то интубация кишки осуществляется через свищ. Зонд обязательно проводят до связки Трейтца. Перфорационные отверстия должны быть не ближе, чем 15 см от стомы. Противопоказаний для данного вида интубации нет. Осложнения могут возникнуть те же, что и при ретроградной интубации через прямую кишку.
Применение интраоперационной декомпрессии кишечника позволяет полностью разгрузить тонкую кишку при тяжелых формах пареза, улучшить ее кровообращение, уменьшить интоксикацию организма, осуществить энтеральную детоксикацию, предупредить эвентрацию кишечника, развитие ранней спаечной кишечной непроходимости, а раннее эктеральное зондовое питание способствует нормализации всасывательной способности кишечника.
При ухудшении общего состояния, нарастании симптомов интоксикации, прогрессировании перитонита, пареза желудочно-кишечного тракта и ухудшении лабораторных показателей ставятся показания к повторной релапаротомии, после которой брюшную полость вновь ушивают наглухо. Программных санационных релапаротомии мы не делаем, но в силу вынужденных обстоятельств брюшная полость несколько раз не ушивалась и у детей проводились программные санации брюшной полости. Большого опыта в таком лечении перитонита у нас нет.
Метод "открытого ведения" брюшной полости небезуспешно используется общими хирургами уже в течение длительного времени. Его применяют и детские хирурги с хорошими результатами, проводя плановые релапаротомии до 2—3 раз [Григорьев Е.Г. и др., 1982; Юдин Я.Б. и др., 1986].
При таком способе брюшную полость уже при первичной операции при разлитом перитоните не зашивают наглухо, накладывают или не накладывают провизорные швы. Брюшную полость дренируют, в латеральные каналы вводят марлевые выпускники, которые наряду с дренажами выполняют дренажную функцию (но у детей постановка марлевых выпускников не применяется).
Для предотвращения высыхания кишечника открытую рану и прилежащие к ней петли покрывают полиэтиленовой пленкой с небольшими перфорационными отверстиями и марлевой повязкой, смоченной растворами антибиотиков и антисептиков.
При тяжелом течении перитонита повторные релапаротомии и санации брюшной полости проводят на следующий день. В некоторых случаях релапаротомию можно проводить через день. В дальнейшем, как правило, достаточно еще одной- двух релапаротомий, после чего брюшную полость ушивают наглухо.
Лапароскопическое лечение перитонита. Лапароскопия и лапароскопические операции достигли такого уровня, что, с одной стороны, заменяют ряд диагностических методов, а с другой — способны заменить практически все операции в брюшной полости, выполняемые при лапаротомии. Но при гнойных перитонитах их возможности ограничиваются самим характером процесса. Если источник перитонита до лапароскопии не удален, то в этих случаях проводят операцию по его устранению и санацию брюшной полости. Но чаще всего это делают при первичной лапаротомии.
При перитоните, когда его характер и распространенность установлены при первичной операции, роль лапароскопии сводится к возможной дополнительной, повторной санации брюшной полости, контролю за положением дренажей, что происходит чрезвычайно редко. При подозрении на раннюю спаечную кишечную непроходимость лапароскопическое исследование поможет устранить эти спайки. Разлитой перитонит и его осложнения, которые были практически у всех наших больных, сопровождаются парезом желудочно-кишечного тракта, что не только затрудняет, но и делает опасным введение лапароскопа. И только при ограниченном процессе возможно его введение в контралатеральной области.
Основным показанием для лапароскопии в наших условиях была спаечная непроходимость, при которой разделялись склеенные фибрином петли и удалялись спайки. Осуществление лапароскопии при перитоните у наших больных при острой непроходимости и соблюдении указанных выше условий было возможно, так как брюшная полость у них всегда была ушита (к программным лапаростомиям мы не прибегали). Но выполнено это было в единичных случаях, что объясняется развитием осложнений уже самого разлитого перитонита, происходившего на фоне прогрессирования процесса и требовавшего релапаротомий, при которой санировалась вся брюшная полость и разъединялись спайки.
На основании своего скромного опыта мы формулируем показания к лапароскопии при перитоните следующим образом.
- Ранняя спаечная кишечная непроходимость.
- Контроль за положением дренажа при подозрении на его перегиб или смещение.
- Возможность санации брюшной полости при отграниченных формах перитонита.
- Появление признаков послеоперационного перитонита.
- Подозрение на внутрибрюшное кровотечение.
Противопоказаниями к проведению лапароскопии служат:
- Резкое вздутие кишечника.
- Ранний послеоперационный период после операции по поводу кишечной непроходимости на почве спаечной болезни.
- Наружные свищи, в том числе искусственные.
- Нагноение послеоперационной раны.
Технические условия проведения лапароскопии при перитоните остаются теми же, что и при "спокойной" брюшной полости. Эта манипуляция значительно облегчается, если исследование было повторным, а при первом в брюшной полости оставлена гильза.
Обезболивание при лапароскопии проводят под внутривенным наркозом, так как при перитоните всегда канюлирована вена. При длительной манипуляции целесообразно прибегать к интубационному наркозу с релаксантами.
В связи с появляющимися работами по лечению перитонита у детей при помощи лапароскопии мы хотим высказать и свое мнение по поводу этого метода лечения. С нашей точки зрения, лапароскопическое удаление червеобразного отростка при остром аппендиците или перфорации кишечника и одновременное дренирование брюшной полости отличается только доступом при оказании стандартной хирургической помощи, но не принципиальным изменением самого метода лечения. Естественно, что такой метод является менее травматичным и в одинаковой мере эффективным, как и открытая лапарото- мия, тем более что при лапароскопии возможна обработка брюшины ультразвуком с помощью растворов антибиотиков через 6—12, 24 и 48 ч с последующим облучением ее гелий- неоновым лазером.
Ситуация кардинально меняется при разлитом гнойном перитоните, при котором уже был удален источник перитонита, санирована и дренирована брюшная полость, а перитонит прогрессирует, да еще дает осложнения. Именно о таких больных, поступающих для повторных операций, идет речь в нашей работе, о чем уже было сказано раньше.
Наше отношение к лапароскопическим операциям при разлитом аппендикулярном перитоните разделяют В.И. Котлобов- ский и соавт. (2001), обладающие большим опытом лечения перитонита при помощи лапароскопии. К числу противопока
заний для лапароскопического метода лечения перитонита авторы относят: плотный аппендикулярный инфильрат, абсцесс, тяжелые запущенные формы разлитого гнойно-фибринозного перитонита, сопровождающиеся выраженным парезом кишечника, плотными сращениями, образующими конгломерат с множеством внутрибрюшных абсцессов, нарушением целостности стенок полых органов в результате их гнойно-некротического расплавления. Перечислены почти все встречающиеся ситуации при релапаротомиях по поводу прогрессирующего перитонита у детей.
Таким образом, лапароскопическое лечение перитонита возможно проводить при локальных и нераспространенных формах (например, при остром аппендиците с развитием перитонита в правой подвздошной области, правом латеральном канале и малом тазе).
Эндоскопия при стрессовых желудочно-кишечных кровотечениях. Эндоскопические методы диагностики у детей достаточно полно разработаны и в свое время освещены в монографии С.Я. Долецкого и соавт. в 1984 г. Но роль этого метода при перитоните не освещена в полной мере.
При гнойно-септических осложнениях роль эндоскопии сводится не только к диагностике, но и к возможности лечебных манипуляций. По нашим наблюдениям, чем меньше возраст ребенка, тем чаще у него в стрессовых ситуациях возникают желудочно-кишечные кровотечения, особенно на фоне разлитого гнойного перитонита. Выявление источника кровотечения, оценка состояния слизистой оболочки желудка и двенадцатиперстной кишки возможно только при фиброгастроду- оденоскопии. При множественных кровоточащих эрозиях визуально оценивается зона кровоточивости, а в дальнейшем контролируется эффективность местной и инфузионной терапии. В случае изъязвления слизистой оболочки мы проводили электрокоагуляцию этих мест разработанным нами лопатообразным электродом или производим обкалывание спиртоновокаиновым раствором малой кривизны желудка, что расценивается как фармакологическая блокада блуждающего нерва (вводят 0,25 % раствор новокаина по 1—1,5 мл, затем 1 мл 70 % спирта), или в подслизистую основу места локализации эрозий вводится раствор адреналина после разбавления 1:10 (общая доза не превышала допустимой возрастной).
Эрозивные желудочно-кишечные кровотечения при перитоните в острой стадии процесса мы наблюдали более чем у 20 % больных. Порой они были значительными с резким снижением гемоглобина и требовали, кроме гемостатической терапии, анацидных препаратов, местного лечения и заместительного переливания крови. При эрозивных желудочных кровотечениях через зонд в желудок вводили охлажденный раствор аминокапроновой кислоты, в который добавлены по несколько капель 0,1 % раствора адреналина и 0,1 % раствора атропина. В связи с тем что эрозивные кровотечения не бывают одномоментными, а длятся часы и дни, вместо раствора аминокапроновой кислоты в желудок вводили нативную плазму. Одновременно повышали коагуляционную способность крови внутривенным введением растворов хлорида кальция, викасола, блокаторов Л-рецепторов (гастроцепина и др.), подкожно вводили дицинон по 10—15 мг/кг массы тела 3 раза в день. Следует отметить тот факт, что желудочные кровотечения бывают длительными (несколько дней) и могут рецидивировать. Эти кровотечения, по нашим наблюдениям, почти всегда связаны со стрессом и ДВС-синдромом, что подтверждалось данными коагулограммы (положительными этаноловым и Р-нафтоловым тестами).
При тяжелых формах ГСЗ возникает гиперкоагуляция, которая может привести к ДВС-синдрому. Профилактикой этого осложнения является улучшение реологических свойств крови: введение реополиглюкина, трентала, курантила и гемодилю- ция. О гиперкоагуляции свидетельствуют: укорочение свертываемости крови, рекальцификация плазмы, повышение концентрации фибриногена, уровня тромбоцитов и показателей тромбоэластограммы. При появлении подозрения на развитие первой гиперкоагуляционной фазы ДВС-синдрома, о чем свидетельствует снижение антитромбина, порой до 50—60 %, необходимо проводить гепаринотерапию. Гепарин вводят под кожу живота в дозе 100—150 ЕД на 1 кг массы тела, а при выраженной гиперкоагуляции — внутривенно в дозе 50—100 ЕД на 1 кг массы тела при отсутствии возможного кровотечения. Для профилактики или уже развившейся гепаринорезистент- ности необходимо вводить нативную плазму из расчета 10— 15 мл на 1 кг массы тела.
Ранняя спаечная кишечная непроходимость. Возникая в условиях РГП, она требует широкой лапаротомии, во время которой производят разделение спаек, интубацию кишечника, санацию и дренирование брюшной полости. При возникновении спаечной непроходимости без признаков воспалительного процесса в брюшной полости прибегают к лапароскопическому рассечению спаек.
При лечении кишечных свищей мы придерживаемся активной тактики только при высоких губовидных свищах, сопровождающихся большими потерями кишечного содержимого с выраженной мацерацией кожи вокруг свища. Такая ситуация чаще складывается у детей раннего возраста. В этих случаях прибегаем к ранней радикальной операции. Опыт показывает, что риск подобных операций всегда меньше, чем риск осложнений, возникающих в результате больших потерь жидкости, электролитов и белков.
Дети с губовидными кишечными свищами, не приводящими к значительным потерям кишечного содержимого, оперируются позднее, в плановом порядке, через 2—6 мес после выписки из стационара. Трубчатые свищи чаще закрываются самостоятельно.
Следует отметить, что к лапаростомиям и программным релапаротомиям мы практически не прибегаем, но довольно активно относимся к повторным экстренным релапаротомиям, показания к которым, по нашему мнению, следующие.
- Отсутствие положительной динамики со стороны общего состояния больного и местных клинических проявлений перитонита через 2—3 сут после правильно выполненной операции на фоне интенсивной терапии и при исключении сопутствующей патологии, объясняющей состояние. Данную ситуацию расцениваем как отрицательную динамику и ставим вопрос о релапаротомии.
- Неэффективность методов экстракорпоральной детоксикации на фоне патогенетически обоснованной терапии.
- Значительное количество отделяемого по дренажу из брюшной полости на фоне отсутствия перистальтики кишечника (или резкого ее угнетения) даже при относительно "спокойном" животе является относительным показанием к повторной операции.
Широкое применение УЗИ брюшной полости позволило нам несколько по-иному взглянуть на проблему программных лапаротомий. Квалифицированное применение УЗИ брюшной полости, обеспечивающее ежедневную объективную информацию о наличии (или отсутствии) свободной жидкости или коллекторов жидкости в брюшной полости, признаков начинающейся механической кишечной непроходимости, динамике состояния стенок кишечника и перистальтики, часто избавляет нас от необходимости в программных лапаротомиях, потребность в которых, очевидно, и возникла из-за отсутствия таких объективных данных о наличии минимальных доклинических признаков патологии брюшной полости. С другой стороны, такая информация дает возможность провести раннее оперативное вмешательство до развития более глубоких изменений.
А так же в разделе «Операционные доступы и санация брюшной полости »
- Характеристика поступивших больных
- Классификация перитонитов
- Кишечные сто мы и парентеральное питание при перитоните
- Ультразвуковое исследование в диагностике и лечении осложнений перитонита
- Ультразвуковой мониторинг при перитоните и после больших реконструктивных операций на органах брюшной полости
- Малые инвазивные вмешательства при интрапаренхиматозных и межпетельных абсцессах брюшной полости УЗИ в лечении абсцессов паренхиматозных органов
- УЗИ в лечении межпетельных абсцессов при помощи микролапаротомии
- Общие принципы консервативной терапии детей с разлитым гнойным перитонитом и его осложнениями Предоперационная подготовка
- Детоксикационная терапия у детей с разлитым гнойным перитонитом
- Энтеросорбция при помощи дезинтегрированного активированного угля
- Борьба с парезом желудочно-кишечного тракта
- Ультрафиолетовое облучение крови при перитоните
- Дифференцированная иммунотерапия у детей с осложненными формами разлитого гнойного перитонита
- Некоторые особенности воспалительного процесса у детей с осложненными формами разлитого гнойного перитонита
- Летальность при перитоните