РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
А. Заболеваемость раком молочной железы значительно увеличилась за последние 10 лет: заболевание возникает у одной из девяти женщин. Наиболее частая лcкализаnия — верхне-наружный квадрант.
Б. Факторы риска
- Наличие семейного рака молочной железы (особенно рака в пременопаузе у прямых родственников).
- Раннее менархе.
- Позднее наступление менопаузы.
- Поздние первые роды (после 30 лет) и нерожавшие женщины.
- Фиброкистоз и участки атипической гиперплазии в молочной железе.
- Инвазивный или неинвазивный рак молочной железы (внутрипротоковый или дольковый рак in situ) в анамнезе.
- Мутации генов BRCA-L BRCA-2w BRCA-3
В. Патологическая анатомия. Раки молочной железы — преимущественно аденокарциномы; различают протоковый и дольковый раки, представленные инфильтрирующими и
неинфильтративными формами.
- Формы опухолей молочной железы
а. Папиллярный рак (1% всех случаев рака молочной железы) — внутрипротэковое неинвазивное новообразование низкой степени злокачественности.
б. Медуллярный рак (5-10%) — чаще большая объёмная опухоль со слабой спэсоб- ностью к инвазивному росту, окружённая лимфоцитарным валом. Прогноз (по сравнению с инфильтрирующим протоковым раком) более благоприятный.
в. Воспалительный рак (маститоподобный, 5-10%) распространяется по лимфатическим сосудам кожи, что сопровождается её покраснением, уплотнением и рожеподоб- ным воспалением, повышением температуры тела.
г. Инфильтрирующий протоковый скиррозный рак (70%) характеризует образование гнёзд и тяжей опухолевых клеток, окружённых плотной коллагеновой стромой.
д. Болезнь Пёджета (рак соска и ареолы молочной железы) — разновидность рака молочной железы; характерно экземоподобное поражение соска. В глубоких слоях эпидермиса выявляют происходящие из эпителия апокриновых желез крупные клетки со светлой цитоплазмой. Существенное значение имеет цитологическое исследование мазка, взятого с изъязвлённой поверхности.
- Состояние эстрогеновых рецепторов (ЭРц). Раки молочной железы классифицируют по наличию или отсутствию ЭРц. Состояние ЭРц может целиком изменить течение болезни.
а. ЭРц-позитивные опухоли чаще встречают в постменопаузе. Около 60-70% первичных раков молочной железы характеризует наличие ЭРц.
б. ЭРц-негативные опухоли чаще встречают у больных в пременопаузе. У одной трети больных с ЭРц-негативными первичными раками молочной железы в последующем наблюдают развитие рецидивных ЭРц-позитивных опухолей.
Г. Классификация: опухоль, узлы, метастазы (TNM)
Первичная опухоль (Т)
TIS: карцинома in situ
Т0: первичную опухоль не выявляют
Т,: первичная опухоль менее 2 см в диаметре
Т2: первичная опухоль 2-5 см в диаметре
Т3: первичная опухоль более 5 см в диаметре
Т4: прорастание стенки грудной клетки
Вовлечение лимфатических узлов (N)
N,: подвижные подмышечные лимфатические узлы N2: спаянные подмышечные лимфатические узлы Отдалённые метастазы (М): метастазы за пределами молочной железы и подмышечной области
- Клинические стадии основаны на классификации TNM.
Стадия I: опухоль менее 2 см в диаметре, нет вовлечения лимфатических узлов и отдалённых метастазов. Пятилетний уровень выживаемости составляет 85%.
Стадия II: опухоль 2~5 см в диаметре, пальпируются подвижные подмышечные лимфатические узлы, отсутствие отдалённых метастазов. Пятилетний уровень выживаемости составляет 66%.
Стадия III: опухоль более 5 см в диаметре, возможно локальное прорастание; пальпируются лимфатические узлы за пределами подмышечной области, отсутствие отдалённых метастазов. Пятилетняя выживаемость — 41%.
Стадия IV характеризуются отдалёнными метастазами и 10% 5-летним уровнем выживаемости.
2. Степень излеченности определяют только по прошествии 10 лет после проведённого лечения.
Д. Диагностика
- Симптомы
а. Пальпируемое образование, единичное или множественное, плотное, иногда с втя- жением кожи в виде «лимонной корочки».
б. Боли в области молочной железы.
в. Увеличенные плотные подмышечные лимфатические узлы.
- Среди пациенток с увеличением подмышечных лимфатических узлов у 1/3-1/2 находят рак молочной железы. Исключают болезнь Хдджкена, рак лёгкого, яичников, поджелудочной железы и плоскоклеточную карциному кожи.
- Показана слепая мастэктомия (удаление молочной железы без предварительного цитологического исследования).
- Ранняя диагностика. Обычное самообследование молочной железы и маммография обеспечивают раннее обнаружение раковых опухолей. Самостоятельный осмотр рекомендуется выполнять ежемесячно по окончании менструации.
а. Самообследование молочной железы. Все женщины должны владеть техникой самообследования молочной железы (см. I В 3). Обследование необходимо выполнять ежемесячно после менструаций, когда набухание железы меньше препятствуют обнаружению опухоли.
б. Маммография. Всем женщинам в возрасте от 35 до 40 лет рекомендовано проведение маммографии.
- При наличии факторов риска женщины в возрасте 40-50 лет должны проходить маммографию ежегодно или один раз в два года, а в возрасте старше 50 лет — ежегодно.
- Женщинам, относящимся к группам риска, рекомендована ежегодная маммография, начиная с максимально раннего возраста.
- УЗИ проводят для определения солидного или кистозного характера образования (пальпируемого или непальпируемого).
- Аспирационная биопсия (рис. 25-2) с последующим цитологическим исследованием аспирата подтверждает диагноз.
- Эксцизионная биопсия — метод выбора в диагностике заболеваний молочной железы. Проведение биопсии не всегда возможно при глубоко расположенных образованиях.
а. В биоптате определяют эстрогенные и прогестероновые рецепторы. Рецептор- позитивные опухоли чаще поддаются гормональной терапии и имеют лучший прогноз.
б. Цитометрия в протоке проводится для определения диплоидности (ДНК-индекс равен 1,00) или анеуплоидности (ДНК-индекс не равен 1,00) и фракции клеток в S-фазе митоза. Анеуплоидные опухоли с высокой фракцией S-фазы имеют худший прогноз.
Е. Лечение карцином молочной железы — комбинированное (хирургическое, химио-, лучевая и гормональная терапия); поэтому для выбора наиболее рациональной схемы лечения больные должны быть осмотрены хирургом, лучевым и химиотерапевтом (рис. 25-3).
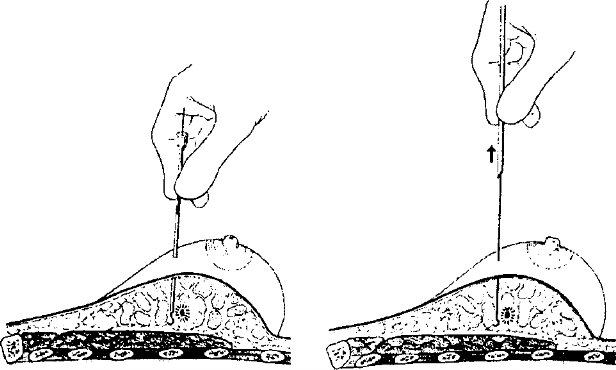
Рис. 25-2. Аспирационная биопсия молочной железы
I Стадия II Стадия III Стадия IV Стадия
Лампэктомия, Модифицированная Химиотерапия, Химиотерапия
подмышечная радиальная оперативное лечение, лимфаденэктомия мастэктомия и/или
лучевая терапия лучевая терапия
Рис. 25-3. Тактика ведения больных в зависимости от стадии процесса
- Предоперационная подготовка
а. Определяют критерии неоперабельности по Хаагенсену.
- Обширный отёк молочной железы.
- Наличие узлов-сателлитов.
- Воспалительная карцинома лимфатических сосудов и лимфатических узлов молочной железы; связок, поддерживающих молочную железу.
- Метастазы в надключичные лимфатические узлы.
- Отёк верхней конечности.
- Отдалённые метастазы.
б. Инструментальное исследование наличия отдалённых метастазов
- Сканирование костей.
- Печёночные функциональные тесты.
- Рентгенография грудной клетки.
- КТ грудной клетки выполняют для обследования надключичной области и средостения.
- Радиоизотопное или КТ-сканирование мозга показано при наличии неврологической симптоматики.
- КТ брюшной полости проводят для исключения поражения надпочечников, яични- кав, печени.
в. Беременность на момент установления диагноза карциномы не является противопоказанием к мастэктомии. Химиотерапия не показана. В некоторых случаях прибегают к лучевой терапии и сохранению молочной железы. Вопрос о сохранении беременности решают вместе с женщиной.
- Хирургическое лечение
а. Оптимальный хирургический подход определяют следующие факторы:
- стадия болезни,
- размер опухоли,
- локализации опухоли в молочной железе,
- размер и форма молочной железы,
- число опухолевых очагов в молочной железе,
- имеющиеся в распоряжении технические возможности для лучевой терапии и хирургического вмешательства,
- желание больной сохранить молочную железу.
В большинстве случаев применяется модифицированная радикальная мастэктомия. Операции с сохранением молочной железы (например, тилэк- томия) позволяют правильно оценить распространённость опухолевого процесса и улучшают косметический результат; однако, возможность сохранения железы имеется не у всех больных (табл. 25-1).
б. Операция может быть радикальной или паллиативной.
- Удаление всей поражённой молочной железы необходимо по причине мно- гофокусности заболевания. Примерно у 30-35% пациенток находят предраковые или раковые поражения в участках, соседних с поражённым первичной опухолью.
- Удаление подмышечных лимфатических узлов необходимо для определения поражения узлов и стадии заболевания.
в. Виды операций
- Лампэктомия (секторальная резекция), лимфаденэктомия подмышечных лимфатических узлов (1-го и 2-го уровня) и послеоперационное облучение применяются при небольших первичных опухолях (менее 4 см) и при интра- дуктальных карциномах.
- Простая мастэктомия (операция Мадена) включает удаление молочной железы с околососковым пространством совместно с удалением лимфатических узлов 1-га уровня.
- Модифицированная радикальная мастэктомия (операция Пэйти). Удаляют кожу вокруг железы, молочную железу, малую грудную мышцу и жировую
Таблица 25-1. Противопоказания для органосохраняющих операций на молочной железе
Крупная опухоль в маленькой молочной железе
(повышается вероятность негативного косметического результата)
Расположение первичных опухолей вблизи соска Более одной опухоли в мелочной железе Противопоказания к лучевой терапии Запущенность заболевания {например, стадия II и белее)
Большая зона внутрипротокового поражения или наличие микрокальцификатов
клетчатку с лимфатическими узлами подмышечной, подключичной и подлопаточной областей.
(а) Уровень выживаемости и частота рецидивов при этой операции сравнимы с такими же при радикальной мастэктомии (операция Хддстеда).
(б) Косметический дефект меньший, чем после мастэктомии по Холстеду. Реконструктивная операция — субпекторальное протезирование.
- Радикальная мастэктомия Холстеда. Вместе со всеми тканями, указанными выше, удаляют и большую грудную мышцу.
(а) Длинный грудной нерв сохраняют во избежание денервации передней зубчатой мышцы и развития симптома крыловидной лопатки.
(б) Операция Холстеда приводит к выраженной деформации грудной клетки. Эффективна в предотвращении рецидивов заболевания. N
- Обширная радикальная мастэктомия включает удаление лимфатических узлов средостения. Операция показана при больших или медиально расположенных опухолях с наличием внутригрудных (парастернальных) метастазов. Высокий риск интраоперационной летальности.
- Операции по реконструкции молочной железы (см. V) выполняют одновременно с мастэктомией либо вторым этапом после полного заживления первичной операционной раны.
- Лучевая терапия
а. Предоперационная. Больные раком молочной железы после установления диагноза получают курс предоперационной лучевой терапии на молочную железу и зоны регионарного метастазирования.
б. Послеоперационная. Больные, перенесшие удаление опухоли и подмышечных лимфатических узлов и не прошедшие курс предоперационной лучевой терапии, должны получать заключительную лучевую терапию на область молочной железы и лимфатических узлов (при обнаружении в них метастазов).
в. Облигатная послеоперационная. Больные раком молочной железы должны полу
чать послеоперационное облучение при наличии любого из нижеперечисленных факторов риска. (
- Размер первичной опухоли более 5 см.
- Метастазирование более чем в четыре подмышечных лимфатических узла.
- Опухоль достигает резекционной линии, проникает в грудную фасцию и/или мышцу, либо распространяется из лимфатических узлов в подмышечную жировую клетчатку.
г. Больные с высоким риском отдалённого метастазирования могут получать лучевую терапию до завершения адъювантной химиотерапии либо её можно проводить совместно с облучением. Послеоперационное облучение подмышечной впадины повышает риск отёка верхней конечности.
- Адъювантная химиотерапия замедляет или предупреждает рецидив, улучшает выживаемость больных с метастазами в подмышечные лимфатические узлы, а также у части больных без подмышечных метастазов.
а. В табл. 25-2 даны рекомендации для адъювантной химиотерапии. Химиотерапия наиболее эффективна у пациенток в пременопаузе с метастазами в подмышечные лимфатические узлы (наблюдают снижение пятилетней летальности на 30%).
б. Комбинированная химиотерапия предпочтительнее монотерапии, особенно в группе больных с метастатическим раком молочной железы. Приём препаратов шестью курсами либо в течение шести месяцев — оптимальный по эффективности и по длительности метод лечения.
Таблица 2 5 2 Показания для адъювантной химиотерапии и гормональной терапии рака молочной железы
|
|
Метастазы в лимфатические узлы |
ЭРд |
Лечение |
|
Больные в пременопаузе |
- |
- |
Адъювантная химиотерапия для опухолей диаметром белее 3 см или имеющих большое число клеток в S-фазе меточного цикла |
|
|
+ |
+ или - |
Комбинированная химиотерапия |
|
Больные в постменопаузе |
+ |
+ |
Тамоксифен с химиотерапией или без неё |
|
|
+ |
|
Химиотерапия Адъювантная химиотерапия с некоторым положительным результатом |
+ — есть; нзт
в. Схемы введения препаратов. При отсутствии значительных токсических реакций
следует использовать максимальные дозы.
- Чище применяют сочетание циклофосфамида, метотрексата и 5-ФУ.
- Больные с высоким риском развития рецидивов или метастазов могут получить циклофосфимид, доксорубицин и 5-ФУ. Эффект терапии больных с метастатическим раком молочной железы составляет 65-80%.
- Альтернативные схемы для больных с метастазирующим раком включают доксорубицин, тиоТЭФ и винбластин; высокие дозы цисплитини; митомицин; внутривенные инфузии винбластина или 5-ФУ; циклофосфимид, метотрексат и 5-ФУ; тиксол.
- Адъювантная гормональная терапия
а. Подавление функций яичников облучением или овариоэктомией приводит к неоднозначным результатам; в отдельных подгруппах больных отмечают продолжительные периоды улучшения состояния.
б. Гормональное лечение. Позитивный ответ на гормональную терапию вероятен при следующих условиях: длительный период без метистазировиния (gt;5 лет), пожилой возраст, наличие метастазов в костях, региональные метастазы и минимальные метастазы в лёгких, гистологически подтверждённая злокачественность I и II степени, длительная ремиссия в результате предшествующей гормонотерапии.
- Антагонист эстрогенов тамоксифен задерживает наступление рецидивов, улучшает выживаемость и предпочтительнее для больных в постменопаузе с ЭРц-позитивной опухолью (см. табл. 25-2).
(и) Эффективность тамоксифена более выражена у больных с ЭРц-позитивными опухолями.
(б) Препарат неэффективен либо оказывает слабое воздействие при ЭРn-негагив- ных опухолях.
- Гормональное лечение метастазирующего рака молочной железы (табл. 25-3)
(и) Гормональное лечение применяют у больных с подкожными метастазами, вовлечением в процесс лимфатических узлов, наличием плеврального выпота, метастазами в кости и нелимфогенными лёгочными метастазами. Больным с метастазами в печень, лимфогенными метастазами в лёгкие, перикард и другими опасными для жизни метастазами следует проводить химиотерапию.
(б) Больные с ЭРц-позитивными первичными опухолями положительно реагируют ни гормональное лечение по меньшей мере в 30% случаев. Наличие в опухоли
Таблица 25-3. Гормональные препараты, применяемые при метастазирующем раке молочной железы
Больные в пременопаузе Тамоксифен
Антагонисты люлиберина (гозерелин ацетат, леупролвд ацегат)
Аминоглюгегимиц и гидрокортизон Флюоксимесгерон Больные в постменопаузе Тамоксифен Мегестрол ацетат Аминотютетимвд Флюоксиместерон
Высокие дозы эстрогенов (диэтилстильбэстрол)
Антагонисты люлиберина
одновременно эстрогеновых и прогестероновых рецепторов повышает лечебный эффект до 75%.
(в) Больные с неизвестным статусом гормональных рецепторов в опухолях могут реагировать на лечение гормонами при хорошо дифференцированных опухолях или при наличии интервала в 1-2 года между появлением первичной опухоли молочной железы и развитием метастазов.
- Особенности лечебных рекомендаций
а. Наилучший прогноз имеет внутрипротоковый рак молочной железы, т.к. эта опухоль неинвазивная (располагается только в протоках);
- Возможно проведение полной мастэктомии либо тилэктомии с последующим облучением, хотя подобный подход связан с увеличением риска развития вторичных опухолей молочной железы.
- Предметом дискуссии остаётся целесообразность удаления подмышечных лимфатических узлов; большинство экспертов считают процедуру необязательной.
б. Дольковый рак in situ. Больных с подобной неинвазивной формой рака отличает очень высокий риск развития инвазивного рака в обеих молочных железах. Лечение: двусторонняя мастэктомия или тщательное наблюдение и контроль за течением заболевания.
в. I и II стадии рака. При I и II стадиях рака молочной железы можно проводить модифицированную радикальную мастэктомию либо лампэктомию с сохранением железы, подмышечную лимфаденэктомию и послеоперационную лучевую терапию.
г. III стадия рака молочной железы. Выбор лечения определяет возможность резекции опухоли.
- Больные с операбельными опухолями требуют проведения расширенной мастэктомии и лучевой терапии. Также можно проводить предоперационную и послеоперационную адъювантную химиотерапию.
- Больные с неоперабельными опухолями III стадии имеют высокий риск возникновения местных рецидивов и отдалённых метастазов; прогноз — неблагоприятный.
(а) Необходим комбинированный подход с проведением хирургического вмешательства и облучения, дополненных системной химиотерапией.
(б) В большинстве случаев активную комбинированную химиотерапию начинают сразу после биопсии для уменьшения опухолевой массы, облегчения местного лечения и разрушения отдалённых микрометастазов.
#С. Прогноз
- Гистологический тип карциномы значительно влияет на прогноз. Карциномы разделяют по способности клеток к метастазированию.
а. Неметастазирующие карциномы неинвазивны и составляют 5% всех карцином. Уровень 5-летней выживаемости — 95%.
- Внутрипротоковая папиллярная карцинома in situ не метастазирует, но может переродиться в дуктальную карциному в 50% случаев в течение 5 лет. Лечение — такое же, как при инвазивной дуктальной карциноме.
- Неинвазивная долевая карцинома (карцинома in situ) имеет 15-30% риск развития аденокарциномы в течение 20 лет. В процесс вовлекается контралатеральная молочная железа. Приемлемое лечение — профилактическая двусторонняя мастэктомия или длительное динамическое наблюдение, т.к. долевая неоплазия (долевая карцинома in situ) в 50% случаев носит двусторонний характер.
б. Болезнь Педжета молочной железы — карцинома, поражающая сосок, происходит из подлежащих протоков. Клетки Педжета инфильтрируют эпидермис соска, вызывая экзематозный дерматит. Лечение то же, что и для инвазивной карциномы.
в. Метастазирующие карциномы
- Слабо метастазирующие карциномы составляют 15% всех случаев. Уровень 5-летней выживаемости — 80%. Виды:
(а) коллоидная карцинома с преобладанием продуцирующих муцин клеток,
(б) медуллярная карцинома представлена лимфоцитарной инфильтрацией с чёткими краями, скудной фиброзной стромой;
(в) хорошо дифференцированная аденокарцинома (I степень),
(г) тубулярная карцинома с редким метастазированием в лимфатические узлы,
(д) комедокарцинома.
- Умеренно метастазирующие карциномы высоко инвазивны, рано метастази- руют в региональные лимфатические узлы, составляют 65% всех карцином. Уровень 5-летней выживаемости — 60%. Виды:
(а) инфильтративная аденокарцинома дуктального происхождения, наиболее часто встречающаяся среди всех карцином;
(б) внутрипротоковая карцинома с прорастанием в строму;
(в) инфильтративная долевая карцинома, характеризующаяся мелкоклеточной инфильтрацией долек.
- Быстро метастазирующие карциномы составляют около 15% всех карцином. Характеризуются прорастанием в сосуды, быстрым недифференцированным клеточным ростом в межпротоковое пространство. Уровень 5-летней выживаемости — 55% (III степень или анеуплоидные опухоли).
- Размер первичной опухоли, как и размеры, количество и локализация пораженных лимфатических узлов влияют на прогноз.
а. Размер первичной опухоли
- У пациенток с опухолью размером менее 1 см в диаметре уровень 10-летней выживаемости — 80%.
- При опухоли размером 3-4 см в диаметре уровень 10-летней выживаемости — 55%.
- При опухоли размером 5-7,5 см в диаметре уровень 10-летней выживаемости — 45%.
б. Размеры и структура лимфатических узлов, поражённых метастазами.
- При отсутствии пальпируемых лимфатических узлов уровень 10-летней выживаемости — 60%.
- При наличии пальпируемых подвижных лимфатических узлов уровень 10-летней выживаемости — 50%.
- При спаянных лимфатических узлах уровень 10-летней выживаемости снижается до 20%.
в. Количество лимфатических узлов, поражённых метастазами, при клиническом обследовании может быть определено ошибочно. В 25% случаев непальпируемых лимфатических узлов микроскопически обнаруживают опухолевые клетки. У 25% больных с пальпируемыми лимфатическими узлами при патологоанатомическом исследовании содержимого аксиллярной области не обнаруживают опухолевых клеток.
- У больных с непоражёнными лимфатическими узлами уровень 10-летней выживаз- мости — 65%.
- При 1-3 поражённых лимфатических узлах уровень 10-летней выживаемости —
38%.
- При количестве поражённых лимфатических узлов более 4 уровень 10-лётней выживаемости снижается до 13%.
г. Локализации метастатически поражённых лимфатических узлов (рис. 25-1).
- Подмышечные лимфатические узлы первого уровня находятся между малой грудной мышцей и широчайшей мышцы спины. В этой группе 5-летняя выживаз- мость — 65%.
- Подмышечные лимфатические узлы 2-го уровня располагаются кзади ст места прикрепления малой грудной мышцы. 5-летняя выживаемость при поражении данной группы лимфатических узлов — 45 %.
- Подмышечные лимфатические узлы 3 го уровня располагаются медиально к верхнему краю малой грудной мышцы. 5-летняя выживаемость при поражении узлов 3-го уровня — 28%.
3. Рецидивы
- Типы
а. Местные рецидивы возникают в области первичной опухоли у 15% больных после радикальной мастэктомии и у более 50% при метастазах в подмышечные лимфатические узлы. Рецидивы возникают в течение 2 лет. Лечение — иссечение, облучение или их комбинации.
б. Вторичная карцинома молочной железы — лечение таксе же, чтс и первичного рака. Критерии дифференцировки вторичной карциномы и метастатического поражения железы:
- гистологическое несоответствие говорит в пользу вторичной опухоли,
- вторичная карцинома возникает по истечении 5 лет после лечения первичной опухоли; развитие метастазов происходит в течение первых 5 лет;
- локализация в толще ткани молочной железы говорит в пользу вторичной опухоли,
- опухоль чаще бывает одиночная, метастазы — множественные.
в. Отдалённые метастазы развиваются обычно в костях, печени, лёгких, реже — в ЦНС и надпочечниках.
г. Динамическое наблюдение за больными с карциномой.
- Врачебные осмотры каждые 3-4 мес.
- Ежемесячный самостоятельный осмотр.
- Ежегодная маммография, сканирование костей, рентгенография (КТ) грудной клетки и обследование печени.
- Лечение. Подтверждённые гистологически рецидивы лечат химио- и гормональными
препаратами.
а. Гормональная терапия основана на составе гормональных рецепторов в опухоли.
- 64% ЭРц-позитивных опухолей поддаются гормональной терапии.
- У ЭРц-позитивных пациенток в пременопаузе выполняют овариоэктомию; в постменопаузе применяют эстрогенную терапию.
- Тамоксифен, мужские половые гормоны используют в пре- и постменопаузе.
б. Химиотерапия применяется при рецидивах у больных с ЭРц-негативными опухолями и при неэффективности гормональной терапии. В таких случаях используют комбинацию циклофосфамида, метотрексата, 5-ФУ и доксорубицина. У 60-80% больных с IV стадией наблюдают временное улучшение в виде уменьшения размеров опухоли и уменьшения болевого синдрома.
- Прогноз. При отсутствии адъювантной химиотерапии или гормонального лечения примерно у 50% больных с операбельным раком молочной железы в последующем развивается рецидив заболевания. Прогностические факторы:
а. Состояние подмышечных лимфатических узлов — важнейший прогностический фактор рецидива и выживаемости. У 70% больных без метастазов в подмышечные лимфатические узлы не наблюдают рецидивирования в течение десяти лет. Показатель снижается до 40% в группе больных с метастазами в три (не более) узла и до 15% в группе больных, имеющих четыре (и более) поражённых метастазами лимфатических узлов.
б. Патогистологические данные. Низкодифференцированные опухоли с выраженным ядерным полиморфизмом характеризует наивысший показатель рецидивирова- ния. Размер опухоли — не менее важный прогностический фактор, не зависящий от поражённости лимфатических узлов метастазами. Размер опухоли, превышающий 5 см, снижает выживаемость и увеличивает риск рецидива.
в. Состояние гормональных рецепторов. 60-70% первичных ракав малачнай железы имеют ЭРц и 40-50% — рецепторы прогестерона. Больные с ЭРц-позитивными опухолями имеют более низкие показатели рецидивирования и длительные сроки выживаемости по сравнению с больными, имеющими ЭРц-негативные опухоли.
г. Фракция клеток в S-фазе и индекс ДНК. Фракция клеток в S-фазе (процент опухолевых клеток в S-фазе клеточного цикла) соразмерна интенсивности роста опухоли. У больных с анеуплоидными опухолями или с высокой фракцией клеток в S-фазе (определяемой с помощью проточной цитометрии) прогноз значительно хуже по сравнению с больными, имеющими медленно растущие опухоли.
д. Выделение онкогенов. Наличие онкогена HER-2 (c-erb-2, пей) связывают с неблагоприятным прогнозом. Уменьшение экспрессии гена пт23 (из группы генов-супрессоров опухолевого роста) ведёт к увеличению метастатического потенциала опухоли, учащению рецидивирования и уменьшению показателей выживаемости. По показателям экспрессии онкогенов формируют группу больных, имеющих неблагоприятный прогноз и требующих проведения адъювантной химиотерапии и гормонального лечения.
Источник: Лопухин Ю.М., Савельев В.С., «Хирургия» 1997