РЕЗЕКЦИЯ КИШКИ В ЛЕЧЕНИИ ТОНКОКИШЕЧНОЙ НЕПРОХОДИМОСТИ
Резекция тонкой кишки как компонент оперативного вмешательства при острой кишечной непроходимости заслуживает особого рассмотрения. Многие вопросы, связанные с этим этапом, остаются сложными и не получили еще своего окончательного разрешения.
Прежде всего это относится к трудностям определения жизнеспособности кишки и объема ее резекции. На эти трудности указывали многие хирурги [Юдин С. С., 1938; Джанелидзе Ю. Ю., 1938; Перельман М. И., 1947; Стручков В. И., 1959; Скрипниченко Д. Ф., 1966; Сигал М. 3., Розенгартен М. Ю., 1976, и др.]. С неправильной оценкой жизнеспособности кишки и неадекватным вследствие этого определением объема резекции связаны многие послеоперационные осложнения при ОК.Н и прежде всего несостоятельность швов анастомозов [Стручков В. И., 1959; Вишневский А. А., Левит В. С., 1963; Потапенко В. Г., Максимов С. С., 1982; Кравчук Н. П., 1985, и др.].
Наиболее распространенные критерии определения жизнеспособности кишки — пульсация сосудов брыжейки, наличие перистальтики кишки, цвет серозного покрова — нельзя считать достоверными даже при наблюдении в течение нескольких минут в условиях согревания сомнительной кишки салфетками, смоченными теплым стерильным раствором. В литературе представлены многочисленные наблюдения, когда внешние признаки относительного благополучия сочетались с обширным некрозом слизистой оболочки [Скрипниченко Д. Ф., 1966; Сигал 3. М., Розенгартен М. Ю., 1982; Gerota D., 1972, и др.].
Не привело к существенному улучшению положения применение функциональных, медикаментозных проб [Иванов В. В., 1966] или введения в сосудистое русло красителей [Кочиев О. С., 1967, 1984; Dineen L., 1966, и др.]. В связи с этим в неотложной абдоминальной хирургии существует правило, диктующее необходимость выполнения резекции кишки не только в случае ее явной нежизнеспособности, но и при обоснованных сомнениях в ее жизнеспособности [Норенберг-Чарквиани А. Е., 1956; Стручков В. И., 1981, и др.]. Это правило применимо, когда речь идет о резекции относительно небольшого участка кишки без тяжелого разлитого перитонита у больного с сохраненными компенсаторными резервами. Если же вопрос стоит об обширной или субтотальной резекции тонкой кишки, да еще у пожилого ослабленного больного, то при
отсутствии безусловных признаков необратимых изменений в кишечной стенке риск выполнения такого пособия нередко конкурирует с риском выжидательной тактики. В подобной ситуации в некоторых, особенно зарубежных работах, рекомендуется тактика запланированной релапаротомии через 10—12 ч («Second look operation»), во время которой изменения в кишке оценивают с большей достоверностью [Buel М., 1957; Rob R., 1957; Girvin L., 1966, и др.]. В. М. Буянов и соавт. (1984) с этой целью используют лапароскопию через специально оставляемую в брюшной стенке металлическую гильзу.
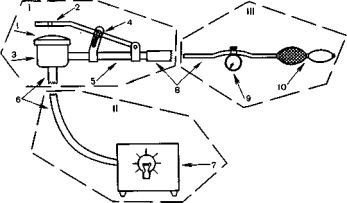
Рис. 4. Схема устройства для трансиллюминационной тензометрии. Объяснение в тексте.
Не менее сложным, чем установление показаний к резекции кишки, является вопрос об определении границ резекции. Даже небольшие изменения в состоянии мик-роваскулярного ложа кишечной стенки могут решающим образом неблагоприятно сказаться на заживлении межкишечного соустья. В настоящее время для профилактики несостоятельности шва анастомоза при некрозе кишки большинство авторов рекомендуют производить резекцию, отступя 30—40 см в проксимальном направлении и 15—20 см в дистальном [Румянцева В. В., 1958; Астапенко В. Г., Максимов С. С., 1982; Савельев В. С. и др., 1986, и др.]. При небольших по объему резекциях в среднем отделе тонкой кишки выполнение этого правила в большинстве случаев не вызывает затруднений. Однако, когда речь идет об обширных и субтотальных резекциях тонкой кишки или когда резекцию необходимо производить в непосредственной близости от илеоцекального угла, могут возникнуть значительные трудности. Тогда методы объективной оценки состояния внутристеночного кровотока приобретают особое значение. Одним из таких методов, доступность и практическая рациональность которого получала подтверждение в последние годы, является метод трансиллюминационной тензометрии, предложенный в 1971 г. 3. М. Сигалом. Мы применяем модифицированный метод Сигала, используя источник холодного света, что упростило подготовку прибора к работе и повысило объективность результатов исследования [Ерю-хин и др., 1982].
Аппарат состоит из трех основных узлов (рис. 4): I — рабочая головка; II — система подсветки; III — система регулируемого давления.
Рабочая головка прибора представляет собой цилиндр (3), покрытый сверху тонкой резиновой мембраной (1). Сбоку к цилиндру припаяна трубка (5), на которой укреплена прижимная рабочая бранша со стеклом (2). Для установления бранши в определенном положении имеется фиксатор (4). К нижней части цилиндра фиксируется стекловолоконный световод (6) от источника света (7). В качестве последнего можно использовать аппарат ОС-100. С помощью резиновой соединительной трубки (8) рабочая головка аппарата соединяется с системой давления, состоящей из манометра с краном для снижения давления (9), шкала которого градуирована в миллиметрах ртутного столба, и резиновой груши для нагнетания воздуха — баллон Ричардсона (10). Все части аппарата, соприкасающиеся с операционным полем, легко стерилизуются погружением на 4—5 мин в раствор первомура.
Для выполнения ангиотензометрии исследуемый участок кишки помещают противобрыжеечным- его краем между прижимной браншей и цилиндром с мембраной. Стекло с браншей опускают на стенку кишки до плотного соприкосновения и фиксируют в таком положении. Включают подсветку. По мере нагнетания воздуха давление в камере повышается, а кровь вытесняется из венозных и артериальных сосудов кишечной стенки. При постепенном снижении давления сосуды начинают медленно наполняться. Появление первой пульсовой волны соответствует систолическому давлению, а прекращение видимой пульсации артериальных сосудов — диастолическому. На высоте венозного давления заполняются кровью вены.
В практических целях — для определения показаний к дренированию кишки, ее резекции и
уточнения допустимых границ резекции кишки — мы использовали трансиллюминационную ангиотензометрию у 66 больных с механической тонкокишечной непроходимостью. Соответствие полученных данных нарушениям в микроциркуляторном ложе в 23 наблюдениях верифицировано с помощью контактной биомикроскопии. Снижение систолического давления до 40 мм рт. ст. расценивали как глубокое нарушение внутристеночной гемоциркуляции, свидетельствующее о необходимости длительного пассивного дренирования кишечной трубки и недопустимости использования данного участка кишки для наложения анастомоза. Снижение давления до 20 мм рт. ст. или полную утрату активного пульсирующего кровотока расценивали как признак сомнительной жизнеспособности кишки и в совокупности с другими признаками это служило основанием к ее резекции.
Особенно полезным оказывается использование метода трансиллюминационной ангиотензометрии для определения доступных границ резекции в случае обширного ее объема в непосредственной близости от слепой кишки. В подобной ситуации, если придерживаться стандартных установок, необходимо производить резекцию тонкой кишки вместе с правой половиной ободочной. Обоснованное объективными критериями сокращение объема резекции помогает в такой сложной тактической ситуации сохранить важный в функциональном отношении отдел толстой кишки. Приводим следующее наблюдение.
Больная Д., 34 лет, поступила в клинику 14.06:83 г., через 2 суток от начала заболевания с выраженными признаками острой спаечной кишечной непроходимости, осложненной перитонитом.
После интенсивной предоперационной подготовки, через 2 ч 20 мин после поступления больная оперирована. При лапаротомии из брюшной полости удалено около 1 л мутной геморрагической жидкости. Выявлена спаечная непроходимость, обусловленная конгломератом петель в дистальном отделе подвздошной кишки. Кишка темнобагрового цвета, с субсерозными кровоизлияниями, отечной стенкой. На протяжении 1 м 70 см кишка расценена как нежизнеспособная. С целью определения минимально допустимых границ резекции в проксимальном и дистальном отделах выполнена трансиллюминационная ангиотензометрия. По данным измерений, в 20 см проксимальнее видимой границы нежизнеспособности систолическое АД составило 80 мм рт. ст., диастолическое — 30 мм рт. ст. В дистальном направлении на участке, расположенном в 15 см от видимой границы сомнительной жизнеспособности кишки и в 4 см от слепой кишки, систолическое и диастолическое АД оказались соответственно 60/40 мм рт. ст. Оба участка оценены как допустимая граница резекции, что позволило несколько сократить объем обширной резекции тонкой кишки, ограничив его 2 м. Наложен анастомоз по типу конец в конец в 4 см от илеоцекального угла.
При гистологическом исследовании концов удаленной кишки последние оказались жизнеспособными. Проксимальнее анастомоза выполнено дренирование тонкой кишки по Житнюку с проведением дренажной трубки до связки Трейтца.
Тяжелое послеоперационное течение. К концу 1-й недели развились признаки острого нарушения мозгового кровообращения по типу спазма сосудов, которые через 3 сут купировались. Перитонит регрессировал. Кишечный свищ самостоятельно закрылся к концу 3-й недели. Выписана на 24-е сутки в удовлетворительном состоянии.
Обсуждая представленное наблюдение, хотелось бы обратить внимание на несколько обстоятельств. Во-первых, сокращение объема резекции кишки по сравнению с принятыми стандартами (30—40 см в проксимальном и 15—20 см в дистальном направлении от видимых границ нежизнеспособности) допустимо лишь при наличии серьезных оснований (в данном случае — обширность резекции) и требует использования дополнительных объективных критериев оценки жизнеспособности стенки кишки в зоне резекции.
Во-вторых, краткого обсуждения требует расположение трубки, дренирующей тонкую кишку, по отношению к анастомозу. Этот вопрос не решен окончательно и не регламентирован четкими указаниями в литературе. Главная задача состоит в дренировании приводящего отдела тонкой кишки для ее декомпрессии и снижения нагрузки на анастомоз. Это может достигаться введением трубки выше уровня анастомоза (как было сделано в представленном наблюдении), интубацией приводящих отделов через гастростому или с помощью назоинте-стинального зондирования или же ретроградным проведением трубки через анастомоз с выведением ее ниже уровня соустья через энтеростому или цекостому. Мы произвели резекцию тонкой кишки с дренированием ее и наложением первичного межкишечного соустья у 66 больных. У 37 дренажная трубка проходила через соустье, у 29 — располагалась проксимальнее анастомоза. В первой группе несостоятельность швов отмечена у 2 больных, во второй — у одного. Таким образом, достоверно судить о преимуществах того или иного способа вряд ли допустимо.
Что касается вида кишечного соустья, то при отсутствии специальных противопоказаний предпочтение следует отдавать анастомозу по типу конец в конец как более физиологичному. При этом умеренно выраженное несоответствие поперечных размеров приводящего и отводящего отрезков кишки легко устраняется за счет косого среза или просто рассечения отводящей кишки по антибрыжеечному краю. По нашим данным, у 264 больных (81,6% от всех резекций тонкой кишки с наложением первичного анастомоза) соустье выполнено по типу конец в конец, у 42 (16,2%) —по типу бок в бок и у 6 больных (2,2%) произведено наложение илеотранс-
верзоанастомоза по типу конец в бок после резекции подвздошной кишки с ушиванием наглуго дистального ее отрезка.
Хирургическая тактика при резекции дистального отдела подвздошной кишки в непосредственной близости от илеоцекального угла не однозначна. Ряд авторов [Литтман И., 1970; Астапенко В. Г., 1982, и др.] рекомендуют короткий периферический отрезок погружать в слепую кишку, а непрерывность кишечной трубки восстанавливать илеотрансверзоанастомозом. Другие хирурги [Дыскин Е. А.,1958, 1961; Сапаров И. Н., 1965, 1973; Земляной А. Г. и др., 1983; Cosnes J. et al., 1978, и др.], наоборот, стремятся сохранить правую половину ободочной кишки как имеющую важное физиологическое значение. Это значение определяется замыкательной функцией илеоцекального клапана, препятствующего обратному поступлению содержимого толстой кишки в, тонкую, а также наличием аппарата лимфоидных образований, играющих чрезвычайно важную роль в формировании иммунитета.
На основе литературных данных и данных собственных анатомо-функциональных исследований мы убедились в целесообразности сохранения этой важной в функциональном отношении зоны пищеварительной системы [Серова Л. С., 1987]. При этом оказалось, что встречающиеся иногда рекомендации выключения илеоцекального угла, основанные на суждениях о ненадежности кровоснабжения дистальных 12—15 см подвздошной кишки при ее резекции и об опасности наложения кишечного соустья с коротким отрезком подвздошной кишки, следует воспринимать критически. Действительно, на удалении 12—18 см от слепой кишки у ряда индивидуумов сосудистая аркада подвздошной кишки выражена недостаточно и в этом случае можно говорить о так называемой «критической зоне». Однако терминальный отдел подвздошной кишки на расстоянии 8—10 см от слепой кишки, как правило, хорошо снабжается кровью из подвздошно-ободочной артерии.
В клинике выполнено 45 резекций подвздошной кишки в непосредственной близости (10 см и менее) от слепой кишки. У 31 больнбго операция закончена формированием терминотерминального анастомоза с короткой культей подвздошной кишки (от 4 до 8 см), а у 14 больных наложен илеотрансверзоанастомоз с ушиванием наглухо терминального отдела подвздошной кишки. В первой группе несостоятельность анастомоза возникла у 2 больных, во второй — у 5. Кроме того, у отдельных больных второй группы при изучении отдаленных резуль-татвв отмечены жалобы, которые могут быть расценены как проявление дисфункции в зоне анастомоза.
Таким образом, уже сейчас можно говорить о допустимости наложения соустья с терминальным отделом подвздошной кишки, если предварительно убедиться в достаточности его кровоснабжения.
Сложными являются вопросы хирургической тактики и ведения послеоперационного периода у больных с проксимальными или дистальными обширными (субтотальными) резекциями тонкой кишки. При механической тонкокишечной непроходимости объем резекции тонкой кишки нередко достигает 50% общей ее длины, что по современным представлениям трактуется как обширная резекция [Даиров А. Б., 1970; Элькин М. А.,1970; Butler D., 1959; Alexandre Н., 1970], а у ряда больных превышает 75—80% общей длины тонкой кишки, что расценивается как субтотальная ее резекция. По нашим данным, при острой механической кишечной непроходимости обширная резекция кишки была выполнена у 79 больных, в том числе до 2 м — у 66 и от 2 до 3 м — у 13. Субтотальную резекцию тонкой кишки пришлось выполнить 12 больным.
Необходимость выполнения обширных и субтотальных резекций тонкой кишки возникает при операциях по поводу наиболее тяжелых запущенных форм острой кишечной непроходимости. В связи с этим главной причиной смерти в раннем послеоперационном периоде являются перитонит и эндогенная интоксикация, связанные с основным заболеванием и тяжелой операционной травмой. У перенесших начальную фазу послеоперационного периода больных нарушение процессов пищеварения и всасывания приводит к развитию тяжелого и опасного патологического состояния, обозначаемого в литературе как «синдром короткого кишечника» [Tilson М., Wright Н., 1972]. В наших исследованиях особое внимание было уделено изучению патогенеза и возможности корригирующего лечения этого синдрома. При этом установлено, что при проксимальной резекции 80% тонкой кишки достоверно снижается всасывание продуктов расщепления альбумина.
При дистальных обширных резекциях нарушается всасывание наиболее энергоемких жирных продуктов, проявляется послабляющий эффект невсосавшихся жиров и убедительно снижается общий объем лимфообразования.
В то же время всасывание глюкозы не претерпевало существенных изменений при любом
варианте вмешательства.
Проведенные экспериментальные исследования позволили также дать оценку некоторым вариантам корригирующих оперативных вмешательств, рекомендуемых при обширных и субтотальных резекциях тонкой кишки. Так, несколько лучшие показатели резорбции белковых продуктов при проксимальной обширной резекции были получены при выполнении анастомоза по типу конец в конец по сравнению с анастомозом бок в бок. Такое положение связано с сохранением большей площади контакта продуктов с активной пищеварительной поверхностью тощей кишки. Наоборот, при обширной дистальной резекции более выгодным оказалось создание соустья по типу бок в бок, что, по- видимому, является следствием некоторой задержки пассажа в раннем послеоперационном периоде при данной конструкции кишечного соустья.
Полученные экспериментальные данные нашли подтверждение при исследовании всасывания альбумина, меченного 1311, у 5 больных, перенесших обширные и субтотальные резекции тонкой кишки. Обнаружено достоверное снижение уровня продуктов расщепления меченого белка в периферической крови и изменение характера кривой всасывания белка по сравнению с нормой. Одновременно у этих больных было выявлено повышенное содержание радиоактивного белка в кале в зависимости от объема резекции. Наблюдалась взаимосвязь между нарушением всасывания белковых продуктов и исходом лечения.
Результаты экспериментально-клинического изучения функциональных последствий обширных и субтотальных резекций тонкой кишки позволили разработать основные требования к ведению послеоперационного периода у больных, перенесших подобные'Ъперации.
Первые 3—5 сут больным после обширных резекций тонкой кишки проводят лечение в соответствии с характером основного заболевания и травматичностью хирургической операции. Корригируют водно-электролитные нарушения, устраняют последствия катаболизма белков, осуществляют антибактериальную и антикоагулянтную терапию. Начиная с 4—5 сут больных постоянно переводят на энтеральное питание. Парентеральное питание при этом сохраняется и служит дополнительным источником энергетических и пластических резервов. Энтеральное питание органичивают в объеме разовой дозы, а прием пищи учащается до 8—10 раз в день. Из пищевых продуктов при проксимальной резекции на начальном этапе дают до 10—15 г в сутки жиров и цельного молока, а при дистальной обширной резекции эти продукты в послеоперационном периоде совсем исключают из рациона. Применение фестала и панзинорма до 6 раз в день во время приема пищи позволяет уже в начальном периоде сократить число дефекаций до 3—4 раз в сутки и улучшает характер стула. Для профилактики бактериальных энтеритов за счет смещения в проксимальные отделы тонкой кишки «дистальной» микрофлоры назначают внутрь антибиотики (оксациллин, левомицетин и др.). В этот период осуществляется строгий контроль за содержанием гемоглобина, общего белка и его фракций, калия, натрия, кальция, магния, хлора, за активностью аланин-аминотрансферазы и аспартатаминотрансферазы, щелочной фосфатазы, а также содержанием билирубина. Эти лабораторные показатели в течение 1-го месяца после операции исследуют не реже одного раза в неделю, а в течение первого года после операции — не реже одного раза в месяц. В такие же сроки исследуют копрограмму. Парентеральную терапию планируют в зависимости от клинических данных и лабораторных показателей: проводят переливания крови, плазмы, белковых и аминокислотных препаратов, жировых эмульсий, концентрированных растворов глюкозы, полиионных солевых растворов, применяют витамины. Сроки перевода на полное энтеральное питание определяют индивидуально, равно как и сроки выписки из стационара. В наших наблюдениях у данной категории больных сроки выписки составили от 2 до 8 нед.
После выписки больные в течение 2—3 лет должны находиться под постоянным наблюдением гастроэнтеролога, знающего существо и проявления синдрома «короткого кишечника». При выраженных клинических и лабораторных отклонениях показана повторная госпитализация таких больных для корригирующего лечения. Весь этот период больным рекомендуется прием ферментативных препаратов (фестал, панзинорм) до 2—3 раз в день и поливитаминов. В пищевом рационе ограничиваются жиры и цельное молоко.
Лечение больных после обширных и субтотальных резекций представляет сложную, трудоемкую,' но отнюдь не бесперспективную задачу. Пример.
Больной Е,. 40 лет, поступил в клинику 19. 06. 79 г. с выраженными признаками ущемленной правосторонней косой паховой грыжи с явлениями кишечной непроходимости. После предоперационной подготовки в течение 50 мин больной оперирован. Под эндотрахеальным наркозом косым паховым доступом обнажен и вскрыт грыжевой мешок. Удалено до 50 мл прозрачного выпота. В грыжевом мешке располагались две тонкокишечные петли темно-синюшного цвета. Произведена широкая герниолапаротомия с рассечением ущемляющего кольца. В брюшной полости содержалось до 500
мл прозрачного геморрагического выпота. Между двумя ущемившимися кишечными петлями имелось ретроградное ущемление болшей части тонкой кишки, расположенной на длинной брыжейке. Ущемленная часть кишки темнобагрового цвета. Присте, ночные сосуды брыжейки не пульсировали. Ущемленная кишка признана нежизнеспособной. Произведена резекция 380 см тонкой кишки с сохранением 70 см тощей кишки и 6 см подвздошной. Наложен анастомоз по типу конец в конец в 5 см от слепой кишки. Таким образом, объем операции соответствовал дистальной субтотальной резекции. В послеоперационном периоде в полном объеме проводили профилактические и лечебные мероприятия в соответствии с принятой в клинике программой ведения больных с обширной и субтотальной резекцией тонкой кишки. Существенных осложнений не отмечено. К моменту выписки частота стула сократилась до 3—4 раз в сутки. Потеря массы тела за период пребывания в стационаре составила около 6 кг.
После выписки больной наблюдался в течение 2 лет. Дважды, через 3 мес и через 7 мес поступал в клинику для обследования и корригирующей терапии. К концу периода наблюдения дефицит массы тела стабилизировался на уровне 7—8 кг. Частота стула при соблюдении диеты до 3—4 раз в сутки. Инвалид II группы.
Представленное наблюдение, как и другие аналогичные случаи, иллюстрирует тяжесть нарушений, связанных с обширной резекцией тонкой кишки, но в то же время убедительно показывает широкий диапазон адаптационных возможностей человеческого организма. Изучение и целенаправленное использование этих возможностей составляют одну из задач применительно к лечению больных, оперированных по поводу различных форм острой тонкокишечной непроходимости.
Заключая изложение общих вопросов лечения тонкокишечной непроходимости необходимо подчеркнуть, что основные положения, представленные в настоящем разделе, в полной мере сохраняют значение при лечении отдельных форм этого заболевания и служат основой для конкретного определения объема и содержания лечебных мероприятий при каждой из этих форм.
Источник: Петров В. П., Ерюхин И. А., «Кишечная непроходимость» 1989
А так же в разделе «РЕЗЕКЦИЯ КИШКИ В ЛЕЧЕНИИ ТОНКОКИШЕЧНОЙ НЕПРОХОДИМОСТИ »
- ПРИЧИНЫ ФОРМИРОВАНИЯ ВЫСОКОЙ И НИЗКОЙ ТОНКОКИШЕЧНОЙ НЕПРОХОДИМОСТИ
- ОСОБЕННОСТИ ПАТОГЕНЕЗА И КЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ ПРИ ВЫСОКОЙ И НИЗКОЙ ТОНКОКИШЕЧНОЙ НЕПРОХОДИМОСТИ
- ОСОБЕННОСТИ ЛЕЧЕБНОЙ ТАКТИКИ ПРИ ВЫСОКОЙ И НИЗКОЙ ТОНКОКИШЕЧНОЙ НЕПРОХОДИМОСТИ
- СТРАНГУЛЯЦИОННАЯ НЕПРОХОДИМОСТЬ
- ИНВАГИНАЦИЯ
- УЗЛООБРАЗОВАНИЕ
- ОБТУРАЦИОННАЯ НЕПРОХОДИМОСТЬ
- СПАЕЧНАЯ НЕПРОХОДИМОСТЬ
- ДИНАМИЧЕСКАЯ НЕПРОХОДИМОСТЬ
- Этиопатогенез
- Клиника и диагностика
- Профилактика и лечение
- Сегментарная динамическая непроходимость
- РАННЯЯ МЕХАНИЧЕСКАЯ ПОСЛЕОПЕРАЦИОННАЯ НЕПРОХОДИМОСТЬ
- НЕПОСРЕДСТВЕННЫЕ РЕЗУЛЬ ТА ТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ОСТРОЙ ТОНКОКИШЕЧНОЙ НЕПРОХОДИМОСТИ
- Глава 7. ТОЛСТОКИШЕЧНАЯ НЕПРОХОДИМОСТЬ
- ОСОБЕННОСТИ ИЗМЕНЕНИЯ ГОМЕОСТАЗА ПРИ НЕПРОХОДИМОСТИ ТОЛСТОЙ КИШКИ
- ОБТУРАЦИОННАЯ НЕПРОХОДИМОСТЬ РАКОВОЙ ЭТИОЛОГИИ
- Характеристика обтурации при раке толстой кишки
- Диагностика
- Лечебная тактика
- Консервативное лечение
- Оперативное лечение
- Результаты