Нарушение кровообращения (микроциркуляции)
В конце XIX века А.А. Бобров и Е. Lexer, обобщив свои клиникоэкспериментальные наблюдения, сформулировали так называемую эмболическую теорию гематогенного остеомиелита. По их мнению, некроз кости у больных гематогенным остеомиелитом — следствие нарушения кровообращения в зоне развития так называемой концевой артерии в результате обтурации ее просвета бактериальным эмболом. В такой трактовке эмболическая теория не могла быть востребованной для объяснения патогенеза одонтогенных остеомиелитов челюстей — так как распространение инфекции при этом заболевании происходит не гематогенно, а по протяжению. Однако тезис о том, что некроз кости обусловлен в первую очередь нарушением ее кровоснабжения, получил дальнейшее развитие при изучении патогенеза одонтогенного остеомиелита.
В.М. Уваров (1951) на основании сопоставления зон васкуляризации челюстей той или иной артерией с типичными секвестрами пришел к выводу, что нарушение кровообращения в результате тромбоза либо эмболии артерии играет важную роль в развитии деструкции костной ткани. Что касается частого несоответствия величины и формы секвестров области кровоснабжения соответствующей веточки артерии, то этот факт В.М. Уваров объяснил наличием анастомозов между экстра- и интраоссальной системами кровоснабжения челюстей. Такую же точку зрения при объяснении причин появления секвестров причудливой формы у больных остеомиелитом имел Т. Kirsch (1959).
В. И. Лукьяненко (1968) и другие связывали возникновение обширной секвестрации в области нижней челюсти с тромбозом, эмболией или сдавлением нижнеальвеолярной артерии. По-видимому, следует принимать во внимание такой механизм нарушения кровообращения в челюсти, однако вряд ли ему принадлежит ведущая роль в патогенезе остеомиелита. Первичное нарушение проходимости такой крупной артерии само по себе не приводит к полному прекращению кровообращения в челюсти. Восстановление кровообращения происходит за счет включения анастомозов с сосудами так называемой экстраоссальной системы кровоснабжения и одноименной артерии противоположной стороны. Подтверждением этому служат многочисленные клинические наблюдения за больными, у которых во время оперативного вмешательства (остеотомия нижней челюсти) пересекают сосудисто-нервный пучок. Выраженной деструкции костной ткани у таких больных, как правило, не возникает.
С другой стороны, когда речь идет о нарушении кровообращения, вызванном развитием инфекционно-воспалительного процесса, следует ожидать поражения в первую очередь не крупных артерий, а более уязвимых элементов сосудистой системы, составляющих микроциркуляторное русло (рис. 1-4, А). Оно включает в себя арте- риолы, прекапиллярные артериолы, кровеносные капилляры, посткапиллярные венулы и венулы.
Одной из причин нарушения микроциркуляции у больных с острой одонтогенной инфекцией может быть непосредственное повреждение эндотелия капилляров комплексами антиген — антитело, фиксирующимися на клеточных мембранах, а затем фагоцитируемыми нейтрофильными лейкоцитами. При этом освобождаются лизосомальные энзимы, медиаторы воспаления и происходит активация калликреин-кининовой системы. Конечный продукт этой системы — брадикинин — влияет на тонус и проницаемость сосудов микроциркуляторного русла, реологические свойства крови, состояние свертывающей и фибринолитической систем (Про- хончуков А.А., 1972). С учетом сказанного становится понятным, почему у больных с острой одонтогенной инфекцией выявляют признаки активации калликреин-кининовой системы, повышение коагуляционного потенциала крови в виде гиперкоагуляции, гипер-
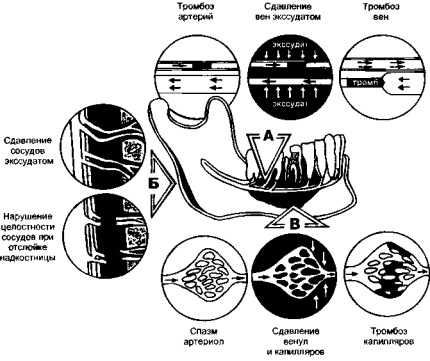
Рис. 1-4. Механизмы нарушения микроциркуляции в костной ткани при одонтогенных воспалительных заболеваниях. А — непосредственно на уровне микро- циркуляторного русла, Б—вследствие внутрикостной гипертензии и сдавления сосудов (в первую очередь вен), В — вследствие сдавления внекостно расположенных отделов сосудов экссудатом, скапливающимся между костью и надкостницей.
фибриногенемии с депрессией фибринолитической системы, признаки нарастания толерантности плазмы к гепарину (Груздев Н.А., 1978; Губин М.А. идр., 1981).
Повышение коагуляционного потенциала на фоне ухудшения реологических свойств крови и замедления скорости объемного кровотока может быть причиной внутрисосудистого свертывания крови с полным либо частичным нарушением микроциркуляции в том или ином участке челюсти (Ольшевский В.А., 1982), ведущим к стойкой гипоксии и повреждению (некрозу) кости. Освобождающиеся при этом так называемые тканевые гормоны (простагландины) и другие биологически активные вещества вызывают развитие воспалительной реакции, обеспечивающей отторжение и рассасывание некротизированной кости.
Другая причина нарушения микроциркуляции связана с внесосу- дистым механизмом окклюзии. Возникает сдавление сосудов воспалительным инфильтратом периваскулярной клетчатки (Гринев М.В., 1977). Этому способствует то обстоятельство, что острый одонтогенный воспалительный процесс возникает в относительно замкнутом костномозговом пространстве, имеющем небольшой объем и ригидные стенки. В связи с этим экссудация, как неотъемлемый составной компонент воспаления, быстро приводит к внутрикостной гипертензии с превышением показателей нормы в несколько раз (в норме внутрикостное давление составляет 0,29—0,39 кПа, или 30—40 мм вод. ст., т.е. приблизительно уравновешивает давление в венах). Внутрикостная гипертензия вызывает в первую очередь сдавление тех вен, в которых по сравнению с другими звеньями кровеносной системы давление наименьшее (рис. 1-4, Б). При сохранном притоке крови это сопровождается переполнением мик- роциркуляторного русла, замедлением кровотока вплоть до стаза. Изменение артериального кровотока в подобных случаях наступает вторично.
Доказательством наличия описанных расстройств гемодинамики служат результаты реографических исследований В.А. Ольшевского и соавт. (1982). У больных с острыми одонтогенными воспалительными процессами в области нижней челюсти эти ученые наблюдали снижение объемного кровотока, затруднения артериального притока и особенно венозного оттока. Эти данные подчеркивают важность своевременного проведения у больных с острой одонтогенной инфекцией мероприятий по нормализации внутрикостного давления путем удаления «причинного» зуба, компактостеоперфо- рации либо создания условий для беспрепятственного оттока экссудата через канал корня зуба.
Теперь становится ясно, что патогенез одонтогенного остеомиелита связан с одновременным участием первого и второго механизмов нарушения микроциркуляции. Более того, эти два вида нарушений микроциркуляции взаимосвязаны. Например, внутрисосудистое свертывание крови вызывает некроз ткани, приводит к высвобождению медиаторов воспаления и, далее, к усилению экссудации, нарастанию внутритканевой (внутрикостной) гипертензии, вызывающей внесосудистую окклюзию отводящих сосудов. Наблюдающиеся при этом замедление кровотока и переполнение микроциркулятор- ного русла, в свою очередь, способствуют внутрисосудистому свертыванию крови.
Признание ведущей роли внутрисосудистого свертывания крови и внесосудистой окклюзии отводящих внутрикостных сосудов в нарушении микроциркуляции при одонтогенном остеомиелите не исключает необходимости учета и других механизмов сосудистых расстройств. Поскольку при остеомиелите всегда вовлекается в воспалительный процесс надкостница, к внесосудистой окклюзии внутрикостных сосудов присоединяется окклюзия экстраоссальных сосудов, вызванная давлением экссудата, скапливающегося между челюстью и надкостницей (рис. 1-4, В). При этом утрачивается возможность включения таких резервных механизмов, как коллатеральное кровообращение, через анастомозы между интра- и экстраос- сальной системами кровоснабжения. Своевременное оперативное вмешательство — рассечение надкостницы с эвакуацией скопившегося под ней гноя — считают важным элементом мероприятий по предупреждению нарушений микроциркуляции у больных с острой одонтогенной инфекцией. Такое оперативное вмешательство не должно приводить к неоправданно широкой отслойке надкостницы.
Известно, что остеомиелит с выраженной деструкцией кости на нижней челюсти наблюдают в 4 раза чаще, чем на верхней челюсти. С учетом изложенных выше механизмов повреждения кости причина этого становится понятной: она в различиях васкуляризации и структуры костного вещества челюстей. В частности, компактная пластинка верхней челюсти гораздо тоньше и более порозна за счет множества пронизывающих ее каналов, в которых проходят нервы, кровеносные сосуды. В связи с этим бактериальные токсины, микроорганизмы и продукты тканевого распада легче и быстрее проникают в околочелюстные ткани, вызывая там развитие воспалительного процесса. На нижней челюсти более мощная и менее порозная компактная пластинка препятствует распространению микроорганизмов и продуктов их жизнедеятельности в околочелюстные ткани, поэтому их концентрация в кости может возрастать до такого
уровня, при котором они вызывают повреждение тканевых структур, т.е. развитие деструкции костной ткани. Кроме того, благодаря меньшей порозности внутрикостное давление, вызванное экссудацией, быстрее достигает такой величины, при которой происходит окклюзия сосудов с последующим нарушением микроциркуляции. Нарушению кровообращения нижней челюсти способствует тот факт, что главным источником ее кровоснабжения служит нижняя альвеолярная артерия, расположенная в костном канале.
Большую толщину и меньшую порозность компактного слоя нижней челюсти считают причиной отторжения участков некротизированной кости, т.е. период формирования секвестров в области нижней челюсти в 1,5—2 раза превышает сроки образования секвестров в области верхней челюсти.
А так же в разделе «Нарушение кровообращения (микроциркуляции) »
- ГЛАВА 1 Этиология и патогенез одонтогенных воспалительных заболеваний
- ЭТИОЛОГИЯ ОДОНТОГЕННОГО ИНФЕКЦИОННОВОСПАЛИТЕЛЬНОГО ПРОЦЕССА
- ПАТОГЕНЕЗ ОДОНТОГЕННОГО ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА
- Механизмы аллергии в патогенезе одонтогенных воспалительных заболеваний
- Причины обострения хронической очаговой одонтогенной инфекции
- Механизмы распространения одонтогенного инфекционно-воспалительного процесса
- Факторы, определяющие возникновение деструкции костной ткани, и объем ее поражения
- Вирулентность возбудителя
- Общая иммунологическая реактивность организма
- Состояние местного иммунитета челюстно-лицевой области