Анксиолитические свойства
Миндалевидный комплекс — одна из основных структур головного мозга, участвующих в выработке и воспроизведении эмоциональных реакций. Точнее, эта область мозга наиболее важна для "эмоциональной" памяти (Davis, 1997, 1998). Эфферентные проекции, посылаемые от миндалины в зоны, ответственные за сопряжение с моторными реакциями (т. е. собственно с внешними проявлениями эмоций), используют глутамат в качестве нейромедиатора. Именно поэтому введение антагонистов глутаматных рецепторов позволяет моделировать эмоциональные реакции и, в частности, контролировать патологически усиленные формы эмоционального поведения (страх, тревога).
Анксиолитические свойства фармакологических средств традиционно выявляют, используя стандартный набор экспериментальных процедур. Наличие таких свойств у антагонистов NMDA-рецепторов было установлено с помощью различных моделей на мышах, крысах, голубях (Wiley, Balster, 1993; Wiley, 1997). Анксиолитическое действие оказывают также антисмысловые олигонуклеотиды, специфичные для субъединицы NR1 NMDA-рецепторов (т. е. нарушение экспрессии ключевого белка рецепторного комплекса; Zapataetal, 1997).
- Анксиолитические свойства.
Однако в последние годы интерес к "анксиолитическим" свойствам антагонистов NMDA-рецепторов угас ввиду сомнений по поводу специфичности их действия, а также из-за неоднозначных и трудно согласуемых результатов, полученных на разных моделях (см., например, Wiley et al, 1998). Поэтому следует более подробно остановиться на результатах, полученных с помощью основных типов экспериментальных методик.
"Конфликтные" методики основаны на использовании инструментального (оперант- ного) поведения как объекта действия исследуемых веществ (см., например, Cook, Davidson, 1973). Несмотря на обилие методических подходов, можно выделить несколько объединяющих их черт. Субъекты эксперимента имеют ограниченный доступ к первичным подкрепляющим агентам (вода, пища), и для того, чтобы получить к ним доступ во время эксперимента, они должны произвести требуемую инструментальную (оперантную) реакцию (например нажать на педаль). Типичная методика имеет два компонента: "ненаказуемый" (инструментальная реакция подкрепляется) и "наказуемый" (инструментальная реакция подкрепляется одновременно с умеренной электрической болевой стимуляцией). Общая частота инструментальной реакции во время "наказуемого" ("конфликтного") компонента обычно ниже, чем во время "ненаказуемого" компонента. Введение анксиолитических средств в дозах, не изменяющих поведение в "ненаказуемые" отрезки эксперимента, довольно селективно повышает частоту инструментальной реакции во время "наказуемого" компонента.
При использовании "конфликтных" моделей все исследованные к настоящему времени конкурентные NMDA-антагонисты избирательно усиливали только "наказуемое" поведение (табл. 2.6; Bennett, Amrick, 1986, 1987; Bennett et al., 1989; Koek, Colpaert, 1991; Wiley et al., 1992; Jessa et al., 1996; Przegalinski et al., 1996; Wiley et al., 1998). В целом по выраженности "антиконфликтного" действия данные вещества уступали бензодиазепинам (Wiley et al., 1992, см. однако Bennett et al., 1989; Wiley et al., 1998). Определенное клиническое значение может иметь тот факт, что при повторном введении этих веществ не наблюдается толерантности к "антинаказующе- му" действию (Wiley et al., 1992; Willetts et al., 1993).
Накопленные многочисленные данные о влиянии неконкурентных ("канальных") антагонистов NMDA-рецепторов на "наказуемое" поведение довольно противоречивы. Методологических особенностей едва ли достаточно, чтобы прояснить ситуацию. Например, согласно одному из сообщений, фармакологически очень близкие вещества — фенциклидин и дизоцилпин — по-разному влияли на "наказуемое" поведение на одной и той же экспериментальной модели (Sanger, Jackson, 1989).
Таблица 2.6. Анксиолитическая активность антагонистов NMDA-рецепторов
|
Экспериментальная модель |
Канальные блокаторы1 |
Конкурентные антагонисты |
Глициновые антагонисты |
Полиаминовые антагонисты |
|
"Конфликтные" методики |
+ |
+ |
- |
- |
|
"Неконфликтные" методики |
+ |
+ |
+/- |
+/- |
' За исключением низкоаффинных блокаторов типа мемантина.
Очевидно, существенную роль играют фармакокинетические факторы. Например, было показано, что дизоцилпин усиливает "наказуемое" поведение у крыс при введении за 2 ч и более перед тестированием, но не ранее (Clineschmidt et al.; 1982, см. однако, Sanger, Jackson, 1989; Kuribara et al., 1990).
Большинство данных (за исключением Chait et al., 1981; Porter et al., 1989) свидетельствует о том, что канальные блокаторы NMDA-рецепторов уступают бензодиазепинам и барбитуратам по силе "антиконфликтного" действия (Wenger, 1980; Sanger, Jackson, 1989). Усиление "наказуемого" поведения под влиянием канальных блокаторов коррелирует с их сродством к фенциклидиновому месту связывания в канале NMD А-рецеп- торного комплекса, а также с их способностью вызывать фенциклидиноподобные дис- криминативные стимульные эффекты (Porter et al., 1989; McMillan et al., 1991).
Несмотря на наличие анксиолитического действия конкурентных антагонистов NMDA-рецепторов у грызунов и голубей, этот эффект не был обнаружен при использовании СРР и NPC-12626 у беличьих обезьян (Mansbach et al., 1991). Следует отметить, что подобная видоспецифичность анксиолитического действия ранее наблюдалась для буспирона (McCloskey et al., 1987). Подобно конкурентным антагонистам, канальные блокаторы не обладают активностью на "конфликтных" моделях у беличьих обезьян (Mansbach et al., 1991).
Низкоаффинные канальные блокаторы, глициновые и полиаминовые антагонисты не проявляют активность при использовании "конфликтных" методик (Sanger, Jackson, 1989; Коек, Colpaert, 1991; Karcz-Kubicha et al., 1997; Wiley et al., 1998; см., однако, Przegalinski et al., 1996; Kotlinska, Liljequist, 1998).
"Неконфликтные" методики. Широко используются тесты: "крестообразный лабиринт", тест парного взаимодействия, тест "четырех площадок", а также ультразвуковая вокализация у крысят, изолированных от матери. Применение "крестообразного лабиринта" основано на том, что крысы или мыши, помещенные в незнакомую обстановку (лабиринт), проводят большую часть теста в "закрытых" рукавах лабиринта; при этом анксиолитический эффект оценивается по выходу животных на открытые участки лабиринта. В тесте парного взаимодействия исследуется поведение животного ("интрудера") на территории незнакомого "резидента". Усиление "социальной" активности "интрудера" без сопутствующих изменений общей двигательной активности рассматривается как анксиолитический эффект. В тесте "четырех площадок" переход субъекта с одной площадки на другую приводит к электроболевому раздражению. Анксиолитическое действие исследуемых веществ выражается в более частом пересечении субъектом линий, разделяющих экспериментальную арену на четыре равных по площади квадрата.
Конкурентные антагонисты NMDA-рецепторов увеличивают время пребывания в "открытых" рукавах "крестообразного лабиринта" (Stephens et al., 1986; Dunn et al., 1989; Guimaraes et al., 1991; Wiley et al., 1995; Karcz-Kubicha et al., 1996), усиливают социальное взаимодействие в тесте "интрудер-резидент" (Dunn et al., 1989), повышают частоту наказуемых переходов в тесте "четырех площадок" (Stephens et al., 1986; Stephens, Andrews, 1988) и уменьшают ультразвуковую вокализацию у крысят, изолированных от крыс-матерей (Winslow et al., 1990; Kehne et al., 1991).
Низкая активность некоторых конкурентных антагонистов (АР-5, АР-7) в значительной мере определяется недостаточным проникновением их через гематоэнцефалический барьер (Chapman et al., 1983); конформационно более жесткие аналоги CGS
19755 и СРР характеризуются более высокой активностью, сравнимой с действием диазепама (Bennett et al., 1989). Введение АР-7 в дорсальную часть околоводопроводного серого вещества уменьшает анксиогенные свойства "открытых" рукавов крестообразного лабиринта. Опираясь на эти данные, некоторые исследователи указывают на околоводопроводное серое вещество как на один из возможных медиаторов анксиолитического действия антагонистов NMDA-рецепторов (Guimaraes et al., 1991; см. также De Souza et al., 1998). Другим фармакокинетическим фактором, влияющим на анксиолитическую активность антагонистов NMDA-рецепторов, является путь введения веществ. Так, CGS-19755 оказывает "антиконфликтное" действие после внутрибрюшинного, но не перорального введения (Bennett et al., 1990). Стереоселективность эффектов конкурентных NMDA-антагонистов была целью изучения лишь в одном исследовании, выявившим более высокую активность D-изомера АР-7 по сравнению с рацематом в тесте "четырех площадок" (Stephens, Andrews, 1988). Сравнительное изучение "антиконфликтного" действия конкурентных антагонистов NMDA-рецепторов показывает, что активность соединений коррелирует со сродством к NMDA-рецептору (Lehmann et al., 1988; Willetts, Balster, 19896; Koek, Colpaert, 1991).
Из представителей неконкурентных антагонистов NMDA-рецепторов наиболее активно изучалось на "неконфликтных" моделях действие дизоцилпина. Анксиолитическая активность дизоцилпина была обнаружена в тестах парного взаимодействия (Dunn et al., 1989), ультразвуковой вокализации изолированных крысят (Winslow et al., 1990; Kehne et al., 1991), в "крестообразном лабиринте" (Dunn et al., 1989; Fraser et al., 1996; Karcz-Kubicha et al., 1996), но не в тесте "четырех площадок" (Stephens, Andrews, 1988). Наличие анксиолитической активности у низкоаффинных блокаторов мемантина и амантадина не подтверждено (Karcz-Kubicha et al., 1997).
Антагонисты (производные кинуреновой кислоты, АСЕА-1021, L-701,324 и др.) и частичные агонисты (Н А-966, АСРС), действующие на глициновый участок, обладают активностью на "неконфликтных" моделях у грызунов (Trullas et al., 1989; Winslow et al., 1990; Kehne et al., 1991; Wiley et al., 1995; Baron et al., 1997; Moraes Ferreira et al., 1997; Kotlinska, Liljequist, 1998). Однако есть также информация, что анксиолитическая активность глициновых антагонистов не коррелирует со связыванием с рецептором (Karcz-Kubicha et al., 1996). Метаболический предшественник кинуреновой кислоты индол-3-пировиноградная кислота при системном введении также оказывает анксиолитическое действие в "крестообразном лабиринте" (Lapin, Politi, 1993).
В отношении полиаминовых антагонистов сведения в целом очень противоречивые. Была продемонстрирована анксиолитическая активность ифенпродила на моделях ультразвуковой вокализации изолированных крысят (Winslow et al., 1990) и "крестообразного лабиринта" (Fraser et al., 1996). Однако этот эффект, очевидно, связан со способностью ифенпродила вызывать высвобождение эндогенных пуринов, а не с функциональным антагонизмом к NMDA-рецепторам (Fraser et al., 1996). Такое заключение частично основывается на наличии аверсивно-мотивационных свойств у других полиаминовых антагонистов элипродила1 (Sukhotina et al., 1998) и ифенпродила (условнорефлекторная вкусовая аверсия; Jackson, Sanger, 1989).
' Эксперименты выполнены совместно с И. А. Сухотиной и Е, А. Блохиной.
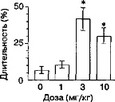
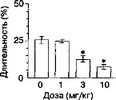

На рис. 2.1 показано, что сочетание инъекций элипродила с посадкой в один из двух отсеков "челночной" камеры приводит к формированию условной реакции избегания места, ассоциированного с введением элипродила. Более того, введение элипродила значительно снижает общительность и повышает выраженность защитных форм поведения.
Анксиогенное действие элипродила может быть не связано с NMDA-рецепторным комплексом, так как другой NMDAR2B-aHTaroHHCT СР-101,606 не обладает подобными свойствами (собственные неопубликованные данные). При этом не следует забывать, что фенциклидиноподобные канальные блокаторы в высоких дозах также вызывают реакцию избегания места (Acquas et al, 1989; Sufka, 1994; Kitaichi et al, 1996a).
Дискриминативные стимульные свойства. Изучение дискриминативных стимуль- ных свойств конкурентных антагонистов NMDA-рецепторов не дало однозначных свидетельств о наличии анксиолитической активности у соединений этого класса. В отличие от бензодиазепинов конкурентные NMDA-антагонисты не блокируют стимульные свойства таких анксиогенов, как пентилентетразол и этиловый эфир р-карболина (Liebman, Bennett, 1988; Stephens et al., 1986; Woods et al., 1988). Более того, у крыс, обученных отличать стимульные свойства диазепама или анксиоселек- тивного соединения CGS-9896 от таковых растворителя, конкурентные NMDA- антагонисты в умеренных нетоксичных дозах не вызывали изменение поведения, на
блюдаемого при введении диазепама или CGS-9896 (Bennett, Amrick, 1986; Liebman, Bennett, 1988). В то же время получены данные о наличии у конкурентных NMDA- антагонистов NPC-12626 и СРР пентобарбиталоподобных стимульных свойств (Willetts, Balster, 1989a; Willetts et al., 1991).
Интересно отметить, что дискриминативные стимульные свойства NMDА имеют много общего с таковыми ряда классических анксиогенов (Woods et al., 1988; Grech et al., 1993), что еще раз подчеркивает возможность участия NMDA-рецепторного комплекса в анксиогенезе. В целом, хотя перспективы клинического применения антагонистов NMDA-рецепторов как анксиолитических средств весьма сомнительны, анксиолитический потенциал, возможно, значительно облегчит их внедрение в других областях. Например, антагонисты NMDA-рецепторов эффективно купируют соматические, вегетативные и поведенческие проявления лекарственных абстинентных синдромов (см. гл. 4), в том числе тревожные состояния и реакции страха (например для синдрома отмены бензодиазепинов — Tsuda et al., 19986).
Источник: Беспалов А. Ю., Звартау Э. Э., «Нейропсихофармакология антагонистов NMDA-рецепторов» 2000