Мозговая система "награды"
Мозговая система "награды" является субстратом подкрепляющего действия различных аддиктивных средств (Звартау, 1988; Koob, 1992). Большинство наркотиков (например опиаты, психостимулянты, никотин) усиливают метаболизм дофамина в мезо- кортиколимбической системе (Robinson, Berridge, 1993; Di Chiara, 1995). Однако мнение о том, что структуры мезолимбической системы составляют мозговую систему "награды", сформировалось еще задолго до того, как были выполнены первые эксперименты с использованием методики микродиализа in vivo (Di Chiara, Imperato, 1988).
Первым неопровержимым экспериментальным доказательством материального субстрата "награды" и подкрепления стало открытие реакции электрической самостимуляции мозга в 1950-х гг. (Rolls, 1975). Именно с этого момента наблюдается постоянный интерес к изучению субстрата действия подкрепляющих стимулов.
Вскоре после опубликования работ Олдса (Olds) и Милнера (Milner) на основе результатов фармакологических исследований было сделано предположение, что дофаминергическая система — возможный нейрохимический субстрат подкрепления и "награды" (Stein, 1964). Не составило труда связать в единое целое данные нейрофизиологических (электрические раздражения отдельных структур мозга) и нейрофармакологических исследований. Как следствие, дофаминовая гипотеза подкрепления оставалась непоколебимой многие годы.
В результате детальных исследований мезолимбической системы накоплены многочисленные сведения о полиморфности и исключительной нейрохимической комплексности этой системы. В дальнейшем изучении этого вопроса важную роль сыграло выявление различных подтипов дофаминовых рецепторов, а также других медиаторов и рецепторов, косвенно затрагиваемых при стимуляции дофаминовых рецепторов или влияющих на высвобождение дофамина или его постсинаптические эффекты. Большинство исследователей пришли к компромиссному решению: стали выделять несколько "ключевых" медиаторных систем, среди которых чаще других упоминали до- фаминергическую, опиоидергическую и ГАМК-ергическую (Koob, 1992).
Не вызывает никаких сомнений, что со временем будет выявлено еще большее количество факторов. Например, в последние годы к числу нейромедиаторных систем, регулярно упоминаемых при анализе подкрепляющих свойств наркотиков, присоединили и такие системы, как пуринергическая (Fredholm et al, 1999), холецистокинино- вая (Dauge, Lena, 1998; Fink et al., 1998), кортикостероидная (Piazza, Le Moal, 1997).
Именно вследствие такого нейрохимического и нейроанатомического многообразия попытки дать исчерпывающее описание системы (или систем) "награды" (рис. 5.1) обречены на неудачу.
По не вполне понятным причинам большинство исследователей в построении своих теоретических концепций или при планировании экспериментов не учитывают вклад глутаматергическои системы в механизмы подкрепляющего действия сти-
ПФК
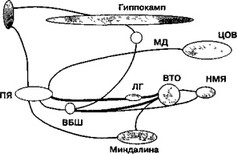
Рис. 5.1. Схема основных проекций, связывающих структуры головного мозга в единую систему "награды". ВБШ — вентральные отделы бледного шара; ВТО — вентральная тегментальная область, ЛГ — латеральный гипоталамус, МД — медиальнодорсальные отделы таламуса, НМЯ — ножкомостовое ядро; ПФК — префронтальная кора; ПЯ — прилежащее ядро перегородки; ЦОВ — центральное околоводопроводное вещество
мулов различной природы. Удивление возрастает, если вспомнить про глутаматер- гические проекции в прилежащее ядро перегородки, которое, по-видимому, является основным интерфейсом между сенсорной и моторной информацией и чуть ли не главным субстратом мотивационных свойств наркотиков. Прилежащее ядро получает проекции от вентральной тегментальной области (ВТО), латерального гипоталамуса, миндалины, лимбических и сенсомоторных областей коры больших полушарий, гиппокампа, медиальной и латеральной преоптических областей, центрального околоводопроводного вещества и еще ряда структур. Нельзя не обратить внимание на то, что все эти проекции в той или иной степени связаны с мотивированным поведением (например миндалина — с эмоциогенезом, медиальная преоптическая область — с половым поведением, некоторые ядра латерального гипоталамуса — с пищевым поведением). Более подробно роль вентральных отделов полосатого тела (стриатума) будет обсуждена в гл. 6. Для данной же главы большее значение имеет выяснение и фармакологический анализ роли глутаматергической системы в механизмах первично- и вторично-подкрепляющих эффектов наркотиков.
Таким образом, имеющиеся данные указывают на ключевую роль дофамина и глутамата в системах "награды" и подкрепления. Роль дофамина доказана в многочисленных электрофизиологических, нейрохимических и фармакологических исследованиях. Предположения о роли глутамата во многом основаны на сведениях о нейрохимической организации анатомических проекций, получаемых мезолимби- ческой системой и, в частности, полосатым телом.
Структуры мезолимбической дофа_минергической системы (например прилежащее ядро, ВТО) получают большое количество глутаматергических афферентов из коры, миндалины, гиппокампа (Kelley, Domesick, 1982; Kelley et al, 1982; Imperato et al., 1990; Kalivas, 1993). Поэтому представляется естественным, что активность нейронов в этих структурах находится под глутаматергическим контролем.
С одной стороны, глутамат модулирует высвобождение дофамина из пресинаптических окончаний (Carter et al., 1988; Imperato et al., 1990; Krebs et al., 1991; Desce et al., 1992). На пилокарпиновой модели эпилепсии выявлено, что стимуляция NMDA- и Di-дофаминовых рецепторов оказывает сходное действие, ингибируя распространение судорог (Turski et al., 1987). Если и глутамат, и дофамин в стриатуме выступают как антиконвульсанты, оказывая при этом противоположное действие на возбудимость нейронов хвостатого тела, то, исходя из традиционных воззрений, представляется маловероятным, что рецепторы глутамата (возбуждающий медиатор) и дофамина (тормозный медиатор) локализованы на телах одних и тех же нейронов стриатума. Эти данные подтверждают, что глутамат действует опосредованно, модулируя высвобождение дофамина.
С другой стороны, результаты поведенческих (Schmidt, Bury, 1988) и электрофизиологических (Mogenson, 1987) исследований указывают на функциональный антагонизм дофамин- и глутаматергических передач в стриатуме. Нейроны хвостатого тела, активность которых ингибируется дофамином (или активацией нигростриар- нвк путей), возбуждаются при подведении глутамата (или усилении кортикальной афферентации). Активация постсинаптических NMDA-рецепторов и Бгдофамино- вых рецепторов приводит к противоположным изменениям в цАМФ-зависимом фосфорилировании белка DARPP-32 (Halpain et al., 1990). Кроме того, системное введение ряда антагонистов NMDA-рецепторов (в первую очередь фенциклидино- подобнвк канальных блокаторов), так же как и дофаминопозитивных веществ, характеризуется стимуляцией локомоторной активности у резерпинизированных жи- вотнвк (Starr, Starr, 1994). Однако следует отметить, что в основе этого стимулирующего эффекта антагонистов глутаматных рецепторов, скорее всего, лежит блокада глутаматергической передачи в дорсальных (но не вентральных) отделах стриатума, а также в субталамических ядрах и бледном шаре, получающих возбуждающие проекции из стриатума (Starr, Starr, 1994; Ferre et al., 1994).
В отличие от неконкурентных канальных блокаторов NMDA-рецепторов конкурентные, глициновые и полиаминовые антагонисты не усиливают метаболизм дофамина в базальных ядрах, значительно меньше или совсем не стимулируют локомоторную активность при введении интактным животным и уменьшают локомоторный стимулирующий эффект наркотиков психостимулирующего типа действия (Mogenson, 1987; Pulvirenti et al., 1989; Rao et al., 1990; Svensson et al., 1991; Bubser et al., 1992; Loscher, Honack, 1992; Murata, Kawasaki, 1993).
Первым неопровержимым экспериментальным доказательством материального субстрата "награды" и подкрепления стало открытие реакции электрической самостимуляции мозга в 1950-х гг. (Rolls, 1975). Именно с этого момента наблюдается постоянный интерес к изучению субстрата действия подкрепляющих стимулов.
Вскоре после опубликования работ Олдса (Olds) и Милнера (Milner) на основе результатов фармакологических исследований было сделано предположение, что дофаминергическая система — возможный нейрохимический субстрат подкрепления и "награды" (Stein, 1964). Не составило труда связать в единое целое данные нейрофизиологических (электрические раздражения отдельных структур мозга) и нейрофармакологических исследований. Как следствие, дофаминовая гипотеза подкрепления оставалась непоколебимой многие годы.
В результате детальных исследований мезолимбической системы накоплены многочисленные сведения о полиморфности и исключительной нейрохимической комплексности этой системы. В дальнейшем изучении этого вопроса важную роль сыграло выявление различных подтипов дофаминовых рецепторов, а также других медиаторов и рецепторов, косвенно затрагиваемых при стимуляции дофаминовых рецепторов или влияющих на высвобождение дофамина или его постсинаптические эффекты. Большинство исследователей пришли к компромиссному решению: стали выделять несколько "ключевых" медиаторных систем, среди которых чаще других упоминали до- фаминергическую, опиоидергическую и ГАМК-ергическую (Koob, 1992).
Не вызывает никаких сомнений, что со временем будет выявлено еще большее количество факторов. Например, в последние годы к числу нейромедиаторных систем, регулярно упоминаемых при анализе подкрепляющих свойств наркотиков, присоединили и такие системы, как пуринергическая (Fredholm et al, 1999), холецистокинино- вая (Dauge, Lena, 1998; Fink et al., 1998), кортикостероидная (Piazza, Le Moal, 1997).
Именно вследствие такого нейрохимического и нейроанатомического многообразия попытки дать исчерпывающее описание системы (или систем) "награды" (рис. 5.1) обречены на неудачу.
По не вполне понятным причинам большинство исследователей в построении своих теоретических концепций или при планировании экспериментов не учитывают вклад глутаматергическои системы в механизмы подкрепляющего действия сти-
ПФК

Рис. 5.1. Схема основных проекций, связывающих структуры головного мозга в единую систему "награды". ВБШ — вентральные отделы бледного шара; ВТО — вентральная тегментальная область, ЛГ — латеральный гипоталамус, МД — медиальнодорсальные отделы таламуса, НМЯ — ножкомостовое ядро; ПФК — префронтальная кора; ПЯ — прилежащее ядро перегородки; ЦОВ — центральное околоводопроводное вещество
мулов различной природы. Удивление возрастает, если вспомнить про глутаматер- гические проекции в прилежащее ядро перегородки, которое, по-видимому, является основным интерфейсом между сенсорной и моторной информацией и чуть ли не главным субстратом мотивационных свойств наркотиков. Прилежащее ядро получает проекции от вентральной тегментальной области (ВТО), латерального гипоталамуса, миндалины, лимбических и сенсомоторных областей коры больших полушарий, гиппокампа, медиальной и латеральной преоптических областей, центрального околоводопроводного вещества и еще ряда структур. Нельзя не обратить внимание на то, что все эти проекции в той или иной степени связаны с мотивированным поведением (например миндалина — с эмоциогенезом, медиальная преоптическая область — с половым поведением, некоторые ядра латерального гипоталамуса — с пищевым поведением). Более подробно роль вентральных отделов полосатого тела (стриатума) будет обсуждена в гл. 6. Для данной же главы большее значение имеет выяснение и фармакологический анализ роли глутаматергической системы в механизмах первично- и вторично-подкрепляющих эффектов наркотиков.
Таким образом, имеющиеся данные указывают на ключевую роль дофамина и глутамата в системах "награды" и подкрепления. Роль дофамина доказана в многочисленных электрофизиологических, нейрохимических и фармакологических исследованиях. Предположения о роли глутамата во многом основаны на сведениях о нейрохимической организации анатомических проекций, получаемых мезолимби- ческой системой и, в частности, полосатым телом.
Структуры мезолимбической дофа_минергической системы (например прилежащее ядро, ВТО) получают большое количество глутаматергических афферентов из коры, миндалины, гиппокампа (Kelley, Domesick, 1982; Kelley et al, 1982; Imperato et al., 1990; Kalivas, 1993). Поэтому представляется естественным, что активность нейронов в этих структурах находится под глутаматергическим контролем.
С одной стороны, глутамат модулирует высвобождение дофамина из пресинаптических окончаний (Carter et al., 1988; Imperato et al., 1990; Krebs et al., 1991; Desce et al., 1992). На пилокарпиновой модели эпилепсии выявлено, что стимуляция NMDA- и Di-дофаминовых рецепторов оказывает сходное действие, ингибируя распространение судорог (Turski et al., 1987). Если и глутамат, и дофамин в стриатуме выступают как антиконвульсанты, оказывая при этом противоположное действие на возбудимость нейронов хвостатого тела, то, исходя из традиционных воззрений, представляется маловероятным, что рецепторы глутамата (возбуждающий медиатор) и дофамина (тормозный медиатор) локализованы на телах одних и тех же нейронов стриатума. Эти данные подтверждают, что глутамат действует опосредованно, модулируя высвобождение дофамина.
С другой стороны, результаты поведенческих (Schmidt, Bury, 1988) и электрофизиологических (Mogenson, 1987) исследований указывают на функциональный антагонизм дофамин- и глутаматергических передач в стриатуме. Нейроны хвостатого тела, активность которых ингибируется дофамином (или активацией нигростриар- нвк путей), возбуждаются при подведении глутамата (или усилении кортикальной афферентации). Активация постсинаптических NMDA-рецепторов и Бгдофамино- вых рецепторов приводит к противоположным изменениям в цАМФ-зависимом фосфорилировании белка DARPP-32 (Halpain et al., 1990). Кроме того, системное введение ряда антагонистов NMDA-рецепторов (в первую очередь фенциклидино- подобнвк канальных блокаторов), так же как и дофаминопозитивных веществ, характеризуется стимуляцией локомоторной активности у резерпинизированных жи- вотнвк (Starr, Starr, 1994). Однако следует отметить, что в основе этого стимулирующего эффекта антагонистов глутаматных рецепторов, скорее всего, лежит блокада глутаматергической передачи в дорсальных (но не вентральных) отделах стриатума, а также в субталамических ядрах и бледном шаре, получающих возбуждающие проекции из стриатума (Starr, Starr, 1994; Ferre et al., 1994).
В отличие от неконкурентных канальных блокаторов NMDA-рецепторов конкурентные, глициновые и полиаминовые антагонисты не усиливают метаболизм дофамина в базальных ядрах, значительно меньше или совсем не стимулируют локомоторную активность при введении интактным животным и уменьшают локомоторный стимулирующий эффект наркотиков психостимулирующего типа действия (Mogenson, 1987; Pulvirenti et al., 1989; Rao et al., 1990; Svensson et al., 1991; Bubser et al., 1992; Loscher, Honack, 1992; Murata, Kawasaki, 1993).
Источник: Беспалов А. Ю., Звартау Э. Э., «Нейропсихофармакология антагонистов NMDA-рецепторов» 2000