NMDA-рецепторные механизмы опиатной толерантности
Первые сообщения о том, что антагонисты NMDA-рецепторов способны замедлять развитие толерантности к эффектам опиатов, появились в 1991 г. (Marek et al., 1991а,б; Tru]illo, Akil, 1991a). В указанных работах было установлено, что толерантность к анальгетическому эффекту морфина значительно менее выражена у животных, которые вместе с морфином получали канальный блокатор дизоцилпин (МК- 801). Морфин вводили дробно в течение нескольких дней, а его анальгетическую активность оценивали на моделях термической боли (тест "отдергивания хвоста").
В дальнейшем подобные исследования проводили не раз, при этом их основной результат воспроизводился без каких-либо проблем (Herman et al., 1995). Как ни парадоксально, но после первых работ о влиянии антагонистов NMDA-рецепторов на развитие опиатной толерантности было сделано всего несколько попыток более глубокого исследования этого явления.
Угнетающий эффект антагонистов NMDA-рецепторов наблюдали как на крысах, так и на мышах. В табл. 3.1 перечислены практически все антагонисты NMDA-рецеп-
Таблица 3.1. Влияние антагонистов NMDA-рецепторов на развитие толерантности к анальгетической активности морфина
Антагонисты NMDA-рецепторов Эффект1 Ссылка
|
Канальные |
Дизоцилпин |
+ |
Trujillo, Akil, 1991а; Marek etal., 1991а,б, |
|
блокаторы |
(МК-801) |
|
Ben-Eliyahu et al., 1992; Bhargava, Matwyshyn, 1993; Gutstein, Trujillo, 1993; Lufty et al., 1993; Elliott etal., 19946; Verma etal., 1995; Bilsky etal., 1996; Wong et al., 1996; Lufty et al., 1996; Manning etal., 1996; Belozertseva, Bespalov, 1998 |
|
|
Кетамин |
+ |
Trujillo, Akil, 1994; Gonzalez etal., 1997 |
|
|
Декстрорфан |
+ |
Trujillo, Akil, 1994 |
|
|
Декстрометорфан |
+ |
Elliott et al., 1994a; Manning etal., 1996 |
|
|
Фенциклидин |
+ |
Беспалов и соавт., 1994; Trujillo, Akil, 1994 |
|
|
Мемантин |
+ |
Belozertseva, Bespalov, 1998; Popik, Kozela, 1999 |
|
Конкурентные |
LY-235959 |
|
Bilsky etal., 1996; Allen, Dykstra, 1999 |
|
антагонисты |
LY-274614 |
+ |
Tiseo, Inturrisi, 1993; Tiseoetal., 1994; Elliott etal., 19946 |
|
|
D-AP5 |
+ |
Wong etal., 1996 |
|
|
NPC-17742 |
+ |
Kolesnikov etal., 1993 |
|
|
CGP-39551 |
+ |
Gonzalez et al., 1997 |
|
Глициновые |
АСРС |
+ |
Kolesnikovetal., 1994 |
|
антагонисты |
АСЕА-1328 |
|
Lutfy et al., 1996 |
|
|
Кинуреновая кислота |
+ |
Беспалов и соавт., 1994; Marek etal., 1991a |
1 Замедление развития толерантности.
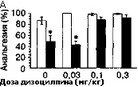

Рис. 3.1. Влияние дизоцилпина (А) и элипродила (Б) на развитие толерантности к анальгетическому эффекту морфина (тест "отдергивания хвоста", мыши линии BALB/c). Анальгетическую активность морфина (5 мг/кг) оценивали до (светлые столбики) и после (темные столбики) субхронического введения морфина (20 мг/кг, 8 дней). * р lt; 0,05 (тест Тыоки), по сравнению с исходным уровнем
торов, которые были исследованы на моделях опиатной толерантности. На рис. 3.1 представлены данные о влиянии дизоцилпина и полиаминового антагониста элипродила на развитие толерантности к анальгетическому эффекту морфина'.
В ранних работах убедительного ответа о механизме, лежащем в основе угнетающего влияния антагонистов NMDA-рецепторов на развитие толерантности, получено не было. Однако сам факт замедления развития толерантности к морфину при сочетанном введении последнего с антагонистами позволял сделать ряд предположений.
Во-первых, ряд авторов подчеркивает существенную роль супраспинального уровня для проявления анальгетического эффекта морфина и развития толерантности к этому эффекту (Advokat, 1988; Milne et al., 1989; Advokat, Gulati, 1991). Поэтому, противодействуя анальгетическому эффекту морфина на супраспинальном уровне, антагонисты NMDA-рецепторов могут ослаблять изменения, вызываемые морфином и влекущие за собой развитие толерантности. Такое объяснение может показаться вполне приемлемым для канальных блокаторов, которые действительно способны в некоторых случаях уменьшать морфиновую анальгезию (см. гл. 2.6.3). Однако развитие опиатной толерантности подавляется представителями различных классов антагонистов NMDA-рецепторов, большинство из которых усиливают морфиновую анальгезию даже на моделях термической боли. Более того, антагонисты NMDA-рецепторов замедляют развитие толерантности при интратекальном введении как на интактных животных, так и на животных с перерезанным спинным мозгом (рис. 3.2; Беспалов и соавт., 1993; Gutstein, Trujillo, 1993; Wong et al., 1996).
Во-вторых, хроническая опиатная экспозиция может оказывать модулирующее воздействие на функционирование NMDA-рецепторов. Как уже отмечалось, активация опиатных рецепторов в ЦОВ сопровождается последующей активацией NMDA- рецепторов (Jacquet, 1988; и др.). Интратекальное введение морфина вызывает гиперчувствительность NMDA-рецепторов к стимуляции (Kreeger et al., 1994; и др.). Можно предположить, что повторные введения морфина ведут к прогрессивной де- сенситизации NMDA-рецепторов. В опытах in vitro выявлено, что десенситизация NMDA-рецепторов — это относительно непродолжительный и обратимый процесс
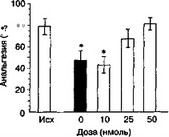
Рис. 3.2. Влияние дизоцилпина на развитие толерантности к анальгетическому эффекту морфина при интратекальном введении (тест ''отдергивания хвоста", беспородные крысы). Анальгетическую активность морфина (10 мкг) оценивали до (Исх) и после повторных инт- ратекальных введений морфина (8 дней, 20-40 мкг). * р lt; 0,05 (тест Тьюки), по сравнению с исходным уровнем (Исх)
(Fagni et al., 1983; Snell, Johnson, 1986), который может лежать в основе некоторых быстро преходящих форм толерантности (Mucha, Kalant, 1980). Однако возникновение десенситизации блокируется конкурентными антагонистами NMDA-рецепторов (например, АР-7), но не канальными блокаторами, такими как фенциклидин и Mg2+ (Snell, Johnson, 1986). Более того, антагонисты NMDA-рецепторов, действующие на глициновый участок, сами способны вызывать десенситизацию NMDA- рецепторов (Thomson, 1990). Поэтому маловероятно, что антагонисты NMDA- рецепторов замедляют развитие толерантности за счет предупреждения развития десенситизации NMDA-рецепторов.
Такой вывод не исключает другие возможные пути адаптационных изменений NMDA-рецепторного комплекса при длительном введении опиатов. Например, повторное введение морфина приводит к снижению связывания ['Н]дизоцилпина в различных областях головного и спинного мозга (Gudehithlu et al., 1994; Bhargava et al., 1995), хотя эти функциональные изменения не подтверждаются данными, характеризующими уровни экспрессии мРНК для различных субъединиц NMDA- рецептора (Zhu et al., 1999). Повторные введения опиатов ведут к истощению запасов цинка в некоторых отделах ЦНС (Gulya et al., 1991) и, следовательно, могут ослаблять ингибиторное влияние этого иона на NMDА-рецепторный комплекс.
Особый интерес вызывает вопрос о том, являются ли изменения в NMDA-рецепторном комплексе причиной наблюдаемых изменений в анальгетической активности морфина, или они представляют собой адаптивный процесс, не связанный напрямую с развитием и экспрессией толерантности. Длительное введение антагонистов большинства рецепторпых систем способно вызывать "ир"-регуляцию рецепторов с соответствующим усилением функции этих рецепторов (Bardo et al., 1983; и др.). Антагонисты NMDA-рецепторов не являются исключением (см. гл. 2.7.3). Продолжительное введение антагонистов вызывает увеличение аффинности и/или количества NMDA-рецепторов (McDonald et al., 1990; Williams et al., 1992; Sanner et al., 1994; Lason et al., 1997; Wang et al., 1999a). Таким образом, роль NMDA-рецепторов
в развитии опиатной толерантности может быть косвенно подтверждена ускоренным развитием толерантности у животных, которые многократно подвергались воздействию антагонистов NMDA-рецепторов и у которых NMDA-рецепторы функционально более активны. Данные, представленные на рис. 3.3, подтверждают такое предположение лишь отчасти, так как для воспроизведения ускоренного развития толерантности потребовались очень большие дозы дизоцилпина1 (Dravolina et al., 1999a). Подобный эффект не наблюдается при введении низких, но достаточных для угнетения развития толерантности доз канальных блокаторов, а также при введении конкурентных антагонистов (Tiseo et al., 1994).
Следует также отметить, что аналогичный эксперимент может быть выполнен, если вместе с каждой повторной инъекцией морфина вводить агонисты NMDA- рецепторов, усиливая таким образом воздействие на NMDA-рецепторы и их функциональную активность. В недавних исследованиях выявлено ускоренное развитие толерантности у животных, получавших морфин в сочетании с NMDA (Kolesnikov et al., 1998). Требуются дополнительные исследования, чтобы окончательно убедиться в корректности этих наблюдений и основанных на них заключений, так как в работе Колесникова и его коллег (1998) была использована исключительно низкая доза NMDA (1 мг/кг), которая не обладает активностью на большинстве других моделей.
Вместе с тем, адаптивные изменения в опиатных рецепторах могут быть мишенью действия антагонистов NMDA-рецепторов. Например, установлено, что как канальный блокатор дизоцилпин, так и конкурентный антагонист D-AP5 при интратекаль- ном введении совместно с морфином предотвращают не только развитие толерантности к анальгетическому эффекту морфина, но и "down''-регуляцию высокоаффинных мест связывания морфина (Wong et al., 1996). Сами по себе антагонисты NMDA-рецепторов при длительном введении не оказывают модулирующего влияния на экспрессию опиатных рецепторов (Tiseo et al., 1994).
В-третьих, как стимуляция NMDA-рецепторов, так и острое введение морфина стимулируют высвобождение оксида азота (Adams et al., 1993). Данный эффект, возможно, опосредован не самим морфином, а его главным метаболитом — морфин-3- глюкуронидом, который оказывает возбуждающее действие за счет стимуляции NMDA-рецепторов (Bartlett et al., 1994). Кроме того, известно, что этот метаболит морфина накапливается в процессе хронического введения морфина и может играть определяющую роль в развитии толерантности к анальгетическому эффекту морфина (Smith et al., 1993). В то же время выявлено, что ингибиторы синтеза оксида азота блокируют развитие толерантности (Adams et al., 1993; Pasternak et al., 1995). Вполне вероятно, что в основе угнетающего влияния антагонистов NMDA-рецепторов на развитие толерантности к морфину лежит их способность тормозить метаболизм оксида азота, стимулируемый морфином.
В-четвертых, антагонисты NMDA-рецепторов, возможно, влияют на адаптивные процессы, сопутствующие развитию толерантности, на уровне клетки. Во многих работах обнаружено, что активность NMDAepnraecKHX синапсов длительно сохраняется после активации этих рецепторов (Foster et al., 1988; Collingridge, Singer, 1990). Известно, что гиперактивация NMDA-рецепторов запускает каскад внутриклеточных реакций, приводящих к гибели клетки (см. гл. 1.3.1). Отсроченная аппликация антагонистов NMDA-рецепторов блокирует эти процессы (Foster et al., 1988; Gill et al., 1988). В то же время отсроченное применение антагонистов NMDA-рецепторов также ослабляет развитие толерантности (Marek et al., 19916). Можно предположить, что хроническое введение морфина ведет к гиперактивации NMDA-рецепторов, которая, в свою очередь, вызывает долговременные изменения в эндогенной ноцицептивной системе. При этом механизмы, лежащие в основе этих изменений, могут быть аналогичными механизмам нейротоксического действия возбуждающих аминокислот.
Согласно данному предположению, замедление развития толерантности к анальгетическому эффекту морфина при сочетанном введении его с антагонистами NMDA- рецепторов может объясняться их способностью снижать кальциевую трансмембранную проницаемость (Mayer, Miller, 1990). Другие вещества, уменьшающие транспорт ионизированного кальция через мембрану и/или обладающие мембраностабилизирующими свойствами (антагонисты медленных кальциевых каналов, агонисты х-подти- па опиатных рецепторов), также способны снижать развитие толерантности к анальгезии, вызванной морфином (Contreras et al., 1988; Adamson et al., 1989; Takahashi et al., 1991). Возможная роль изменений клеточного метаболизма кальция подтверждается также данными о перекрестной толерантности между морфином и ионами лантана, ингибирующими трансмембранный транспорт ионов кальция (Майский и соавт., 1982). Вместе с тем, способность других классов веществ замедлять развитие толерантности может быть результатом их взаимодействия с NMDA-зависимыми процессами. Так, блокаторы медленных кальциевых каналов противодействуют эффектам NMDA на электрофизиологических моделях (Dingledine, 1983), агонисты х-опиатных рецепторов обладают выраженными церебропротективными свойствами в отношении нейротоксичности, вызванной NMDA (Hudson etal., 1991).
Представляется интересным, что вещества, блокирующие развитие толерантности к морфину (х-агонисты, клонидин), проявляют свойства блокаторов кальциевых каналов N-типа (Adamson et al., 1989). Блокаторы потенциалзависимых кальциевых каналов N-типа (ш-конопептиды) обладают рядом специфических свойств антагони-
стов NMDA-рецепторов, например способностью подавлять развитие аллодинии и высвобождение медиаторов, вызванное глутаматом (Chaudieu et al., 1992; Chaplan et al., 1993).
Таким образом, антагонисты NMDA-рецепторов подавляют развитие толерантности к анальгетической активности морфина. Данный факт не вызывает сомнений, хотя и оставляет неразрешенными многие вопросы.
Источник: Беспалов А. Ю., Звартау Э. Э., «Нейропсихофармакология антагонистов NMDA-рецепторов» 2000