NMDA-рецепторы и физиологические механизмы болевой чувствительности
Глутаматергическая система играет важную роль в восприятии сенсорной информации различной модальности. Глутаматергические синапсы опосредуют проведение импульсов, связанных с передачей обонятельных, вестибулярных, зрительных, тактильных и других сигналов (Greenamyre et al., 1984; Mayer, Westbrook, 1987; Yaksh, 1989; Willis, Coggeshall, 1991; Smith, Darlington, 1996). Глутаматные рецепторы, и в частности NMDA-подтип, присутствуют во всех структурах и областях ЦНС, ответственных за реагирование на болевую стимуляцию. Кроме того, в последние годы стала появляться информация, свидетельствующая о том, что периферические глутаматные рецепторы могут также непосредственно участвовать в генезе болевых реакций (например воспалительной природы; Carlton, Coggeshall, 1999).
- Спинальные механизмы болевой чувствительности
За последние 20 лет накоплено большое количество экспериментальных данных, указывающих на то, что глутамат является одним из основных медиаторов болевой чувствительности на спинальном уровне (Curtis, Watkins, 1960; Johnson, 1978; Davies, Watkins, 1983; Salt, Hill, 1983; Mayer, Westbrook, 1987; Dickenson et al., 1997). Авторадиографическими методами была выявлена преимущественная локализация глутаматных рецепторов в задних рогах спинного мозга (Greenamyre et al., 1984). Значительная концентрация глутамата отмечена в спинномозговых ганглиях, задних корешках, в первом и втором слое задних рогов (Willis, Coggeshall, 1991). С использованием электрофизиологических методов было установлено, что большинство нейронов, возбуждающихся при ионофоретическом подведении глутамата и других возбуждающих аминокислот, находится именно в пределах первого и второго слоев задних рогов (Schneider, Perl, 1985; Yoshimura, Jessel, 1990). Стимуляция С-волокон приводит к активации нейронов первого и второго слоев задних рогов, и эта активация блокируется глутаматными антагонистами (Schouenborg, Sjolund, 1986). Однако есть также данные о существовании популяции нейронов, активируемых глутаматом, и в глубоких слоях задних рогов (King et al., 1988).
В пользу существования эндогенной глутаматергической системы контроля боли на спинальном уровне говорит также увеличение внеклеточного содержания глутамата после болевой стимуляции (Skilling et al., 1988). Дорсальная ризотомия не изменяет концентрации глутамата в задних рогах спинного мозга (Willis, Coggeshall, 1991), хотя приводит к торможению высвобождения и обратного захвата глутамата (Aanonsen, Wilcox, 1987).
Глутамат, являясь агонистом для глутаматных рецепторов всех подтипов, обнаруживает и более широкие свойства. Выявлению роли глутаматных рецепторов отдельных подтипов посвящено большое количество исследований (Salt, Hill, 1986; Headley et al., 1987; Yaksh, 1989; Dickenson, Sullivan, 1990; Tolle et al., 1990; Raigorodsky, Urea, 1990; Dougherty, Willis, 1991; Ren et al., 1992; Dickenson et al., 1997). Лиганды NMDA-рецепторов модулируют ответы глубоких слоев на стимуляцию афферентных волокон с малым диаметром (С-волокна). Мишенью для веществ, действующих на He-NMDA-рецепторы, являются нейроны всех слоев, отвечающих на стимуляцию Аб- и С-волокон (Dickenson, Sullivan, 1991; Dickenson et al., 1997). Сеть спинальных промежуточных нейронов предпочтительно использует NMDA- подтип глутаматных рецепторов (Willis, Coggeshall, 1991).
Несмотря на установленную полимодальность большинства Аб- и С-афферентов (Lynn, Carpenter, 1982), с передачей информации от специфических ноцицепторов связывают именно NMDA-, а не He-NMDA-рецепторы (Morris, 1984; Dougherty, Willis, 1991). Кроме того, предполагается, что NMDA-рецепторы вовлечены в полисинаптическое проведение сигналов, а He-NMDA-рецепторы — в моносинаптическое (Dickenson, Sullivan, 1990; Willis, Coggeshall, 1991). При этом NMDA-рецепторы расположены на интернейронах второго порядка, активируемых при стимуляции волокон А- и С-типов, в то время как He-NMDA-рецепторы находятся в первичных синапсах афферентов (Davies, Watkins, 1983). Блокада NMDA-рецепторов in vivo (Raigorodsky, Urea, 1990) и in vitro (Jeftinija, 1989) подавляет проведение ноцицеп- тивной информации, передаваемой через волокна малого диаметра. NMDA-рецепторы в большей степени, чем He-NMDA-подтипы, задействованы в передаче информации в передних рогах спинного мозга и, следовательно, в сегментарной регуляции моторной функции (Headley et al., 1987a).
Существует значительное количество электрофизиологических, биохимических и поведенческих свидетельств в пользу вовлечения глутаматных рецепторов в регуляцию болевой чувствительности на спинальном уровне (Cahusac et al., 1984; Morris, 1984; Salt, Hill, 1986; Aanonsen, Wilcox, 1987; Davies et al., 1988; Urea, Raigorodsky, 1988; Yaksh, 1989; Dickenson, Sullivan, 1990; Haley et al., 1990; Raigorodsky, Urea, 1990; Dougherty, Willis, 1991; Kehl et al., 1991; Woolf, Thompson, 1991; Ren et al., 1992; Dickenson et al., 1997). Так, интратекальное введение большинства агонистов глутаматных рецепторов (например NMDA) крысам и мышам вызывает снижение болевых порогов с такими характерными поведенческими коррелятами, как, например, вокализация, поведение "самокусания" (Aanonsen, Wilcox, 1987; Raigorodsky, Urea, 1987, 1990; Urea, Raigorodsky, 1988; Yaksh et al., 1999).
В зависимости от дозы и времени после интратекального введения для некоторых агонистов (например для NMDA) отмечалась двухфазность эффекта: вначале воз
никала гипералгезия, которая сменялась гипоалгезией (Raigorodsky, Urea, 1987; Kolhekar et al., 1997). Существует несколько возможных объяснений этого феномена. С одной стороны, при длительной стимуляции NMDA-рецепторов возникает постдеполяризационная депрессия, которая может затруднять проведение импульсов через глутаматергические синапсы (McLennan, Liu, 1981; Reet et al., 1983). С другой стороны, введение агониста может запускать дополнительные механизмы за счет косвенной (непрямой) модуляции других рецепторов или нейромедиаторных систем (Morari et al., 1991; и др.). Например, повышение болевых порогов во второй фазе спинального действия NMDA блокируется налоксоном, метизергидом, фентолами- ном, что подтверждает участие других медиаторных систем в реализации гипоалге- тического эффекта NMDA (Kolhekar et al., 1997). Однако следует отметить, что как гипералгезия, так и гипоалгезия, вызываемые NMDA, опосредованы стимуляцией NMDA-рецепторов, так как сочетанное введение антагонистов NMDA-рецепторов полностью блокировало оба эффекта агониста. Поэтому было высказано предположение, что вторая фаза действия NMDA является результатом взаимодействия с сегментарными ингибиторными системами (возможно, за счет высвобождения эндогенных опиоидов).
Учитывая то, что интратекальное введение агонистов глутаматных рецепторов приводит к развитию псевдоболевого синдрома, неудивительно, что глутаматные антагонисты дают противоположный эффект, повышая пороги болевого реагирования. Причем этот эффект скорее всего независим от вызываемых этими веществами моторных расстройств, так как анальгетическое действие глутаматных антагонистов проявляется в тестах, не зависящих от состояния моторной функции (Cahusac ct al., 1984).
В многочисленных исследованиях установлено, что глутаматные рецепторы опосредуют ответ на термическую, механическую, ишемическую боль (Salt, Hill, 1986; Raigorodsky, Urea, 1987, 1990; Sher, Mitchell, 1990; Tolleetal., 1990; Dougherty, Willis, 1991; Dickenson et al., 1997). Антагонисты NMDA-рецепторов при интрате- кальном введении повышают пороги болевого реагирования в тестах термической и механической боли (Salt, Hill, 1983; Cahusac et al., 1984; Aanonsen, Wilcox, 1987; Raigorodsky, Urea, 1990). Анальгетическое действие фенциклидиноподобных канальных блокаторов на моделях термической боли не всегда очевидно при интрате- кальном введении этих веществ (Nasstrom et al., 19936), так как они способны быстро распространяться от места введения и, следовательно, иметь дополнительные мишени действия (Nasstrom et al., 1993a). Более того, есть основания полагать, что анальгетическая активность антагонистов NMDA-рецепторов в тестах, основанных на термически индуцированной боли, весьма ограничена (Salt, Hill, 1983; Tolle et al., 1990; Yaksh et al., 1999).
Как известно, периферическая болевая стимуляция приводит к экспрессии протоонкогена c-fos в нейронах спинного мозга. Индукция синтеза c-fos предотвращается опиатным анальгетиком морфином, что коррелирует с болеутоляющим действием этого вещества (Tolle et al., 1990; Gogasetal., 1991). Антагонисты NMD А-рецепторов подавляют экспрессию c-fos, вызванную химическим (инъекция формалина в заднюю лапу), но не термическим болевым стимулом (Tolle et al., 1990; Kehl et al., 1991). Подобная диссоциация болевых стимулов по чувствительности может объясняться различными паттернами экспрессии протоонкогенов в ответ на разные стимулы и, соответственно, различной фармакологической чувствительностью этого феномена (Morgan, Curran, 1991).
Большое значение имеет участие глутаматергической передачи в процессах длительного болевого реагирования, а именно — в регуляции восприятия боли, индуцированной химически или возникающей после повреждения нерва. Установлено, что антагонисты NMDA-рецепторов (в большей степени, чем не-NMDA рецепторов) эффективно ослабляют химически индуцированное "болевое" поведение, характеризующееся видимыми элементами аутоагрессии — самокусание, чесание и др. (КеЫ etal., 1991; Ren et al., 1992). Химически вызванное болевое раздражение приводит к быстрой активации NMDA-рецепторов, которая сохраняется длительное время (около 1 ч). Наблюдающаяся при этом повышенная активность глубоких слоев задних рогов не уменьшается при отсроченном (после химического раздражения) применении антагонистов NMDA-рецепторов или местного анестетика (лигнокаин). Эти результаты указывают на то, что NMDA-рецепторы вовлечены в механизмы быстрого и пролонгированного реагирования на химический ноцицептивныи стимул (Haley et al., 1990).
Одной из проблем, связанных с хронической болью, является феномен центральной сенситизации. Возможных две причины гипералгезии, возникающей после периферической травмы: увеличение чувствительности первичных афферентных ноци- цепторов, расположенных вблизи от места повреждения (периферическая сенситизация), и увеличение возбудимости нейронов соответствующего отдела спинного мозга (центральная сенситизация) (Woolf, Thompson, 1991; Yaksh et al., 1999). Центральная сенситизация запускается через высокопороговые ноцицептив- ные афферентные входы и проявляется длительным снижением болевых порогов. Предполагают, что центральная сенситизация возникает в результате временной суммации медленных синаптических потенциалов. Рядом авторов установлено, что возникновение и поддержание состояния центральной сенситизации — NMDA-зависимые процессы (Davies, Lodge, 1987; Dickenson, Sullivan, 1991; Dougherty, Willis, 1991; Dubner, 1991; Woolf, Thompson, 1991; Willis, 1993; Dickenson et al., 1997). Более того, в механизме возникновения центральной сенситизации задействованы нейроны глубоких слоев задних рогов, активность которых регулируется NMDA- (но не не-NMDA) подтипами глутаматных рецепторов (Davies, Watkins, 1983; Schouenborg, Sjolund, 1983; Davies, Lodge, 1987). Возможно, что в основе центральной сенситизации лежит явление, аналогичное долговременной потенциации, которая характерна для многих структур мозга, зависима от NMDA-рецепторов и считается электрофизиологическим коррелятом синаптической пластичности (Svendsen et al., 1998, 1999).
Феномен центральной сенситизации ответственен за ложноположительные результаты при исследовании влияния различных веществ на активность нейронов спинного мозга, вызванную острой болевой стимуляцией. Хартелл и Хэдли (Kartell, Headley, 1996) показали отсутствие достоверных антиноцицептивных эффектов при введении антагонистов NMDA-рецепторов бодрствующим животным и животным, находящимся под анестезией после незначительного хирургического вмешательства. Однако более серьезная хирургическая процедура с большим объемом поврежденных тканей способствовала появлению у антагонистов NMDA-рецепторов анальгетической активности.
Дикенсон и Салливэн (Dickenson, Sullivan, 1990) отмечают функциональный характер взаимодействия глутаматных рецепторов с процессами, лежащими в основе центральной сенситизации. Свои выводы они основывают на том, что аналогичный феномен в желатинозной субстанции усиливается под действием антагонистов NMDA-рецепторов. Сегментарная гиперреактивность возникает также после субарахноидального применения стрихнина, бикукуллина, простагландинов Е2 и Е2а и после транзиторной ишемии спинного мозга, в результате чего усиливается поведенческое и вегетативное реагирование на легкое тактильное раздражение. Это явление (аллодиния) блокируется антагонистами глутаматных рецепторов различных подтипов (Yaksh, 1989; Нао et al, 1996; Minami et al, 1999; Dickenson et al., 1997).
В целом, возникновение центральных гипералгетических состояний можно представить следующим образом. После повреждения периферической ткани возбуждающие нейротрансмиттеры (например глутамат и субстанция Р), действуя через NMDA- и нейрокининовые NKl-рецепторы, запускают несколько каскадных процессов с высвобождением оксида азота, продуктов циклооксигеназной активности и с активацией некоторых киназ. Спинальный диализ подтверждает высвобождение возбуждающих аминокислот и простаноидов. Нейрокининовые и глутаматные (NMDA- и ne-NMDA-подтипы) рецепторы повышают высвобождение простагландинов Е2. Спинальные простагландины способствуют дальнейшему высвобождению аминокислот и пептидов. Активация ц/6-, сс2-рецепторов и рецепторов нейропептида Y предотвращает высвобождение аминокислот и пептидов из первичных афферентов и способна блокировать острую и хроническую боль (Yaksh et al., 1999). Блокада NMDA-рецепторов не должна оказывать значимого воздействия на острую боль, так как эти рецепторы не обнаруживаются постсинаптически в синапсах, образованных первичными афферентами и нейронами широкого динамического диапазона.
При хронической боли развивается гиперактивность как пре- (первичные афференты), так и постсинаптических (синапсы, образованные нейронами второго порядка и нейронами широкого динамического диапазона) NMDA-рецепторов (рис. 2.2). Причина развития этой гиперактивности скорее всего заключается в продолжительном повышении внутриклеточной концентрации Са2+, активации Са2+-зависимых протеинкиназ, которые фосфорилируют NMDA-рецептор, снижают магниевый блок (Mayer et al., 1999).
Особый интерес представляет взаимодействие системы возбуждающих аминокислот с другими медиаторными системами. Так, было показано, что ионофорети- ческая аппликация NMDA в комбинации с субстанцией Р или кальцитонин-по- добным пептидом приводит к сенситизации спинальных ответов на химическое и механическое болевое раздражение (Murase et al., 1989; Dougherty, Willis, 1991). Сочетанное введение глутаматонегативных веществ усиливает антиноцицептивное действие антагонистов тахикининовых ККгрецепторов (Seguin, Millan, 1994). Данные о сосуществовании специфических мест связывания NMDA и субстанции Р, а также об участии NMDA-рецепторов в регуляции высвобождения субстанции Р указывают на возможную физиологическую роль подобных взаимодействий (De Biasi, Rustioni, 1988; Liu et al., 1997). Кроме того, предполагается, что ГАМКергическая система тонически ингибирует эффекты, опосредованные активацией NMDA-рецепторов (Aanonsen, Wilcox, 1989; Raigorodsky, Urea, 1990). В то же время, глутаматные рецепторы пресинаптически регулируют высвобождение ГАМК и могут таким образом
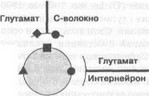
ф — ц-ОР • — NMDA
^ — ГАМК ¦ — не-NMDA
Рис. 2.2. Схематическое изображение проекций, получаемых нейронами широкого динамического диапазона, на которые конвергируют первичные афференты различной модальности, включая ноцицептивные А6- и С-волокна. На схеме не отражены тахикининовые рецепторы и совместное высвобождение субстанции Р и глутамата из пресинаптических терминалей ноцицептивных входов. Тормозные влияния оказывают ГАМК и пресинаптические опиатные рецепторы (ц-ОР). Возбуждающие влияния опосредованы NMDA- и He-NMDA-подти- пами глутаматных рецепторов осуществлять "ауторегулирование'' собственных возбуждающих влияний (Drejer et al, 1987; Perouansky, Grantyn, 1990).
Баланс возбуждающих и тормозных влияний могут нарушить изменения в любом компоненте системы регуляции ноцицептивных входов. Помимо уже упомянутой роли NMDA-рецепторов в возникновении состояний центральной сенситизации, следует указать на значение ингибиторных систем в развитии этого явления. Фармакологическая блокада спинальных ГАМК-рецепторов усиливает гипералгезию при болевом синдроме нейропатической природы (Yamamoto, Yaksh, 1992a).
Отдельно рассмотрим взаимодействие глутамат- и опиоидергических систем. В ряде исследований выявлено, что активация |х-опиатных рецепторов приводит к ослаблению мембранных эффектов возбуждающих аминокислот. Так, ц,-опиатный агонист DAMGO в большей степени уменьшает возбуждение спинальных нейронов I—IV слоев задних рогов, вызванное NMDA, чем аналогичное возбуждение, вызванное АМРА (Lei, Wilcox, 1990; Kolaj et al., 1993). Морфин противодействует нейрональному возбуждению сенсорных нейронов V слоя заднего рога спинного мозга, вызванному локальной аппликацией глутамата (Zieglgansberger, Satoh, 1975; Dostrovsky, Pomeranz, 1976; Belcher, Ryall, 1978). Причем данный эффект морфина чувствителен к налоксону, т. е. опосредован опиатными рецепторами. При сочетанном интратекальном введении с морфином глутаматные антагонисты оказывают потенцирующее действие в отношении морфиновой анальгезии (Chapman, Dickenson, 1992). Антагонисты NMDA-рецепторов значительно усиливают блокирующее действие морфина на медленные электрические потенциалы передних рогов, вызванные стимуляцией задних рогов (Feng, Kendig, 1996). Возможно, что опиаты и возбуждающие аминокислоты взаимодействуют через общую конвергентную систему вторичных посредников, которыми могут быть как Са2+, фосфоинозитолы, так и циклические нуклеотиды (Levy et al., 1981). Однако Риверос и Оррего (Riveros, Orrego, 1986)
установили, что трансмембранный кальциевый ток, вызванный NMDA, не блокируется морфином.
В то же время спинальное гипоалгетическое действие глутаматных антагонистов достоверно ослабевает при сочетанном введении с опиатными антагонистами (Nasstrom et al., 19936). Кроме того, существует корреляция между вызываемой морфином активацией нисходящих тормозных влияний и способностью этого вещества при внутрижелудочковом введении ослаблять ноцицептивное поведение, возникающее вследствие интратекального введения агонистов глутаматных рецепторов (DeLander, Wahl, 1989; 1991; Jensen, Yaksh, 1989). Исходя из сказанного можно предположить, что глутаматные рецепторы модулируют спинальное действие морфина за счет взаимодействия с нисходящими тормозными влияниями.
- Супраспинальные механизмы болевой чувствительности
Глутаматергическая система участвует в эндогенных механизмах регуляции болевой чувствительности не только на спинальном, но и на супраспинальном уровне. Мишенью для действия возбуждающих аминокислот на супрасегментарном уровне является центральное околоводопроводное вещество (ЦОВ), откуда через большое ядро шва (БЯШ) в составе заднелатерального канатика идут нисходящие серотонин- ергические пути в спинной мозг (Behbehani, Fields, 1979). Связь между ЦОВ и БЯШ, установленая авторадиографически, имеет глутаматергическую природу (Wiklund et al., 1988). В электрофизиологических исследованиях выявлено, что локальная аппликация глутамата в ЦОВ приводит к повышению активности нейронов БЯШ (Behbehani, Fields, 1979). Большинство исследователей считает, что возбуждающие влияния ЦОВ на БЯШ опосредованы глутаматными рецепторами, однако в отношении того, какие конкретно подтипы рецепторов задействованы в этом процессе, мнения ученвгх расходятся (Headley et al., 1987a; Wiklund et al., 1988; Jensen, Yaksh, 1992a). Иньекции возбуждающих аминокислот в ЦОВ приводят к выраженной анальгезии (Behbehani, Fields, 1979; Jacquet, 1988; Gold et al., 1990). Этот эффект возбуждающих аминокислот опосредован специфическими рецепторами, так как блокируется глутаматными антагонистами (Jacquet, 1988). Более того, локальная инъекция неспецифического возбуждающего вещества хлорида калия не вызывает повышения болевых порогов (Urea et al., 1980). Гипоалгетический эффект локального введения возбуждающих аминокислот в ЦОВ блокируется перерезкой заднелатерального канатика, а также разрушением БЯШ. Микроаппликация морфина в ЦОВ также усиливает нейронную активность в БЯШ и оказывает анальгетическое действие. Сочетанное введение в ЦОВ NMDA с морфином усиливает анальгетическое действие последнего за счет суммации эффектов (Behbehani, Fields, 1979; Jacquet, 1988). В то же время, пролонгированная болевая стимуляция увеличивает активность NMDA-рецепторов и повышает экспрессию мРНК для субъединицы NMDAR1 (Renno, 1998).
Анальгезию, возникающую после электрической стимуляции ЦОВ, также предотвращают с помощью антагонистов глутаматных рецепторов, вводимых как системно, так и локально в ЦОВ, БЯШ. Более того, антагонисты глутаматных рецепторов уменьшают анальгетический эффект локального введения морфина в ЦОВ и анальгезию, вызванную стрессом (Behbehani, Fields, 1979; Aimone, Gebhart, 1986,
Jacquet, 1988; Siegfried, Nunes de Souza, 1989; Lipa, Kavaliers, 1990; Suh et al., 1994). После болевой стимуляции концентрация глутамата в ЦОВ снижается, а предварительное введение морфина увеличивает концентрацию глутамата. При этом отмечено, что анальгетический эффект возбуждающих аминокислот не опосредован опиа- тергическими системами (Behbehani, Fields, 1979), хотя системное введение опиатного антагониста налоксона блокирует анальгезию при локальном введении глутамата (Urea et al., 1980). Вместе с тем на модели анальгезии, вызванной локальным введением возбуждающих аминокислот, для морфина и налоксона выявлен неопиатный компонент регуляции болевой чувствительности (Behbehani, Fields, 1979; Jacquet, 1988). В реализации вызванной стрессом анальгезии также участвуют неопиатные механизмы (Watkins et al., 1982).
На основании экспериментальных данный была предложена схема взаимодействия глутамат- и опиатергической систем в ЦОВ (рис. 2.3). Согласно этой схеме, стимуляция опиатнвк рецепторов в ЦОВ через тормозные ГАМК-ергические нейроны усиливает возбуждающие влияния на БЯШ и, следовательно, приводит к повышению болевых порогов. Стимуляция NMDA-рецепторов вызывает аналогичные изменения активности ЦОВ. Предполагается, что эффекты стимуляции опиатных и NMDA-рецепторов конвергируют на общие глутаматергические нейроны, проецирующиеся в БЯШ (Jacquet, 1988). В недавних исследованих подтверждена солокализация ц.-опиатнв1х и NMDA-рецепторов в ЦОВ (Commons et al., 1999), а также антагонистические взаимоотношения между опиатными и NMDA-рецепторами в БЯШ (Alojado el al.. I 994).
Локальная аппликация возбуждающих аминокислот, а также электрическая стимуляция ЦОВ и БЯШ могут не только обладать гипоалгетическими свойствами, но и, наоборот, вызывать характерный поведенческий синдром (двигательное возбуждение с вокализацией), который свидетельствует об алгогенном эффекте этих воздействий (Jensen, Yaksh, 1992a, б). Так как существование восходящих глутаматерги- ческих ноцицептивных проекций доказано (Magnusson et al., 1987), предполагалось, что локальная аппликация глутамата может воспроизводить эффект этих возбуждающих спинобульбарных проекций (Jensen, Yaksh, 1992a). Однако локальная аппликация глутамата в другие области, также получающие спинобульбарные проекции, не приводила к появлению болевого поведения (Jensen, Yaksh, 19926). Комплексный характер супраспинальных глутаматергических механизмов болевого реагирования подчеркивается тем, что антиноцицептивные эффекты глутаматергической стимуляции определенных участков в ЦОВ могут быть ассоциированы с возникновением кратковременного болевого поведения (Jensen, Yaksh, 1992a). Доказано также учас-
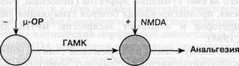
Рис. 2.3. Схема взаимодействия опиат- и NMDA-ергической системы в ЦОВ. На схеме указаны только постсинаптические рецепторы (NMDA, ГАМК, [i-опиатные рецепторы). Возбуждающие и тормозные влияние обозначены как "+" и "-", соответственно
тие глутаматных рецепторов (NMDA gt; АМРА) в генезе как аверсивных, так и анти- ноцицептивных эффектов локального введения глутамата в ЦОВ. Ранее уже высказывалось предположение о функциональной неоднородности ЦОВ. В частности, разрушение БЯШ или введение налоксона блокирует анальгезию, вызванную электрической стимуляцией вентральной (но не дорсальной) части ЦОВ (van Praag, Frenk, 1990).
Филдс с коллегами (Fields et al., 1988) обнаружили существование двух различных групп клеток в стволовых структурах, названных "on"- и "off'-клетками. Эти клетки запускают нисходящие, соответственно, активирующие и тормозные влияния на болевое реагирование. Предполагается, что "оп"-клетки проецируются на "off'-клетки и регулируют нейрональную активность последних. При этом кратковременное болевое поведение, возникающее при локальном подведении возбуждающих аминокислот, сменяется более длительным повышением болевых порогов и может отражать нормальный физиологический ответ на болевое раздражение. Иными словами, глутамат, высвобождающийся из спинобульбарных и спиномезэнцефальных терминал ей, активирует "оп"-клетки с развитием болевого поведения и "off- клетки с последующим угнетением болевых рефлексов на спинальном уровне (спинально-бульбарно-спинальная петля) (Jensen, Yaksh, 1992a). В пользу того, что болевая стимуляция приводит к высвобождению глутамата в ЦОВ, свидетельствует снижение экспрессии мРНК NMDAR1-субъединицы NMDA-рецепторного комплекса (Renno, 1998).
Стволовые структуры участвуют в развитии и проявлении гипералгетических состояний, сопровождающих висцеральное воспаление (Coutinho et al., 1998). Было обнаружено, что NMDA-рецепторы вовлечены в функционирование нисходящей системы в ростральной вентромедиальной медуллярной области, усиливающей болевое реагирование. Локальное введение антагонистов NMDA-рецепторов в эту структуру подавляет реагирование, запускаемое стимуляцией воспаленной колоректальной области (Coutinho et al., 1998). Важно заметить, что, как и для ЦОВ, в стволовых структурах опиатные и NMDA-рецепторы являются своего рода синергистами, так как опиатные анальгетики активируют "off -клетки, а антагонисты NMDA-рецепторов подавляют эти влияния (Spinella et al., 1996; Heinricher et al., 1999). Подобные взаимодействия скорее всего характерны не для всех супраспинальных участков, так как блокада таламических NMDA-рецепторов подавляет термическую и механическую гипералгезию, вызванную интраплантарной инъекцией местно раздражающих веществ в контралатеральную конечность (Kolhekar et al., 1997).
При системном введении возбуждающие аминокислоты и их антагонисты действуют параллельно на сегментарные и супрасегментарные механизмы болевого реагирования. При этом могут наблюдаться сменяющие друг друга изменения болевой чувствительности противоположной направленности. Так, при внутрибрюшинном введении NMDLA было обнаружено, что возникающее снижение болевых порогов в дальнейшем уступает место гипоалгезии (Беспалов и соавт., 1992). В основе этого бифазного действия NMDLA могут лежать те же причины, что и описанные ранее для подобного эффекта NMDA при интратекальном введении. Кроме того, необходимо учитывать возможность несинхронной экспозиции эндогенных мишеней вследствие особенностей фармакокинетики вещества. Фармакокинетические особенности, возможно, лежат в основе разнонаправленного действия антагонистов глутаматных рецепторов на анальгетический эффект морфина при системном введении. Так, на моделях острой боли канальные блокаторы NMDA-рецепторов уменьшают анальгетическую активность морфина, в то время как конкурентные антагонисты — усиливают (см. гл. 2.6.3).
Источник: Беспалов А. Ю., Звартау Э. Э., «Нейропсихофармакология антагонистов NMDA-рецепторов» 2000
А так же в разделе «NMDA-рецепторы и физиологические механизмы болевой чувствительности »
- Анальгетическая активность антагонистов NMDA-рецепторов
- Анальгетическая активность комбинации антагонистов NMDA-рецепторов и опиатных анальгетиков
- 2.7. Факторы, ограничивающие клиническое применение антагонистов NMDA-рецепторов
- Первично-подкрепляющие свойства
- Дискриминативные стимул ьные свойства
- Реакция электрической самостимуляции мозга
- Условнорефлекторная реакция предпочтения места
- Возможные пути ослабления психотомиметического и аддиктивного потенциала антагонистов NMDA-рецепторов
- Расстройства внимания и сенсомоторный дефицит
- Развитие толерантности
- Нейротоксическое действие