Развитие толерантности
Практически во всех возможных случаях клинического применения антагонистов NMDA-рецепторов для получения эффекта требуется не однократное, а многократное, повторное введение этих веществ. Поэтому вопрос о развитии толерантности к клинически значимым эффектам антагонистов NMDA-рецепторов приобретает исключительно важное значение.
Показано развитие толерантности к действию фенциклидиноподобных канальных блокаторов при режимах введения, которые сопровождались также и формированием физической зависимости (Lu et al., 1992; Wessinger, 1994; Kitaichi et al., 1995; Balster, Willetts, 1996). Пока не установлено, вырабатывается ли физическая зависимость при введении антагонистов NMDA-рецепторов остальных классов, однако известно, что толерантность действительно развивается.
Развитие толерантности к эффектам антагонистов NMDA-рецепторов характеризуется рядом особенностей. Во-первых, выраженность толерантности очень мала, не всегда очевидна и не всегда коррелирует с режимом введения и дозировками антагонистов NMDA-рецепторов. Хотя пока нет данных, указывающих на фармакокинетические механизмы толерантности к этим веществам, совершенно определенно можно утверждать, что фармакодинамическая толерантность весьма неоднородна. Например, известно, что толерантность к эффектам антагонистов NMDA-рецепторов может иметь ассоциативный (выработанный) компонент (Smith, 1991). Эти данные
вызывают наибольшее замешательство, так как антагонисты NMDA-рецепторов сами по себе способны ухудшать обучение и подавляют развитие толерантности к другим классам психоактивных веществ (см. гл. 3).
Как и для многих других нейромедиаторных систем, введение антагонистов NMDA-рецепторов способно вызывать повышение экспрессии рецепторов и/или увеличение чувствительности к агонистам. Анализ имеющейся информации показывает, что результаты экспериментов с длительным введением антагонистов NMDA-рецепторов ("ир-регуляция", "down-регуляция", нет эффекта) зависят от типа использованного антагониста (например конкурентный или неконкурентный), длительности введения (3-28 дней), дозировок и режима введения (постоянный или дробный) (Manallack et al, 1989; Beart, Lodge, 1990; Williams et al, 1992; Sanner et al., 1994; Rabbani et al., 1995; Weiss et al., 1996; Lason et al., 1997). Например, повторные введения дизоцилпина (МК-801) и фенциклидина увеличивают экспрессию мРНК для субъединицы NMDAR1 (Sanner et al., 1994; Lason et al., 1997; Wang et al., 1999a), а также связывание меченого [}Н]МК-801 (McDonald et al., 1990; Williams et al., 1992).
Возможно, что причиной развития кажущейся толерантности при длительном введении антагонистов NMDA-рецепторов является повышение чувствительности к эндогенным агонистам NMDA-рецепторов. Такое предположение подтверждается, например, повышением проконвульсантной активности NMDA после субхронического введения высокоаффинных канальных блокаторов и конкурентных антагонистов (Rabbani et al., 1995; Brooks et al., 1997; см., однако, Boast et al., 1988). Далее, у животных, получавших повторные инъекции дизоцилпина (МК-801), усиливается нейротоксическое действие агонистов NMDA-рецепторов (McDonald et al., 1990; Norman et al., 1990).
Установлено также, что длительное введение антагонистов NMDA-рецепторов может впоследствии оказать влияние на формирование процессов, зависимых от NMDA-рецепторов, например на развитие лекарственной толерантности и зависимости (см. гл. 3 и 4). Действительно, опыт введения дизоцилпина (МК-801), кетамина и декстрометорфана в последующем отрицательно сказывался на интенсивности опиатного абстинентного синдрома (Koyuncuoglu, Aricioglu, 1991; Koyuncuoglu et al., 1992; см. также гл. 4.1), хотя эти данные не были подтверждены для конкурентных антагонистов (Tiseo et al., 1994). Такие данные могут серьезно скомпрометировать клиническое применение антагонистов NMDA-рецепторов, так как пациенты, получающие эти средства по одним показаниям (например нейродегенеративные расстройства), окажутся в группе риска по развитию судорожных состояний (например при отмене антагонистов NMDA-рецепторов) или по формированию лекарственной зависимости.
Во-вторых, к некоторым эффектам антагонистов NMDA-рецепторов развивается не толерантность, а сенситизация (Wolf, Khansa, 1991; Pechnick, Hiramatsu, 1994; Xu, Domino, 1994; KitaichietaL, 1995; см. также рис. 2.12Б, 2.15). Однако развитие сенси- тизации, скорее всего, характерно только для высокоаффинных канальных блокаторов и некоторых конкурентных антагонистов.
В-третьих, развитие толерантности во многом может определяться принадлежностью антагониста NMDA-рецепторов к тому или иному классу. Выявлено развитие толерантности к таким эффектам конкурентных антагонистов, как угнетающее
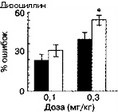
¦I После повторного введения растворителя I I После повторного введения о-СРРепе
• После повторного введения растворителя I I После повторного введения D-CPPene
Рис. 2.15. Влияние дизоцилпина и мемантина на количество преждевременных оперантных реакций у крыс, обученных нажимать на педаль в режиме подкрепления "фиксированный интервал". В течение 7 дней, предшествовавших тесту, животные получали повторные введения о-СРРепе или растворителя. За 30 мин перед заключительным тестированием животные получали инъекции дизоцилпина или мемантина (дозы указаны на оси абсцисс). * р lt; 0,05 (тест Тыоки), по сравнению с контролем (темные столбики)
действие на локомоторную активность (Boast et al., 1988; Rabbani et al., 1995) и моторную координацию (Smith, Chapman, 1993), каталептогенные свойства (Lu et al., 1992). В то же время в ряде исследований не обнаружено развития толерантности к моторным (Boast et al., 1988; De Sarro et al., 1996), нротивосудорожным (Boast et al., 1988; Smith, Chapman, 1993; De Sarro et al., 1996), нейропротективным (Urwyler et al., 1996), анксиолитическим (Willetts et al., 1993; Jessa et al., 1996) и антидепрес- сантным эффектам конкурентных антагонистов NMDA-рецепторов (Skolnick et al., 1992).
Полученная в отношении глициновых и полиаминовых антагонистов информация крайне скудна: известно лишь о развитии толерантности к частичным агонистам глицинового участка (Skolnick et al., 1992; Lopes et al., 1997).
Существование различных классов антагонистов NMDA-рецепторов, а также комплексный характер взаимодействия между различными связывающими участками NMDA-рецепторного комплекса (например см. табл. 1.4) позволяют предполагать, что будет довольно непросто предсказать развитие кросс-толерантности или кросс-сенситизации между определенными типами антагонистов NMDA-рецепторов. В то же время вполне реальной представляется ситуация, когда одновременно или в разное время будут применяться два или более антагониста NMD А-рецепторов с различными или одинаковыми показаниями. Интерес также вызывает возможность развития перекрестной толерантности между антагонистами NMDA-рецепторов и представителями других классов фармакологических средств (например барбитуратами, бензодиазепинами, этанолом; Rabbani et al., 1995).
На настоящий момент экспериментальных данных крайне недостаточно. Например, известно, что симметричная кросс-толерантность к каталептогенным свойствам развивается между фенциклидиноподобными канальными блокаторами и конкурентными антагонистами NMDA-рецепторов (Lu et al., 1992; см., однако,
Rashidy-Pour et al, 1995). На рис. 2.15 приведены некоторые данные о развитии толерантности и кросс-толерантности в результате повторного введения конкурентного антагониста D-CPPene[4]. В этих экспериментах (водное подкрепление, "фиксированный интервал") инъекции D-CPPene выполняли после ежедневной тренировки, чтобы избежать формирования "ассоциативной" толерантности (Kumar, Slolerman, 1977).
Повторное введение D-CPPene (5,6 мг/кг, один раз в день в течение 7 дней) приводило к развитию толерантности и к эффектам самого D-CPPene, и к эффектам глицинового антагониста АСЕА-1021. В то же время эффекты канальных блокаторов не только не уменьшались, но даже усиливались (сенситизация). Особенно четко это было заметно для нарушений аккуратности оперантного поведения, вызываемых канальными блокаторами. При использовании режима подкрепления "фиксированный интервал" пищевое подкрепление становится доступным только по прошествии определенного промежутка времени (10 с), поэтому распределение нажатий на педаль во времени служит довольно чувствительным индикатором состояния сенсомоторной функции животного.
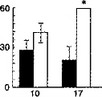
Развитие толерантности к антагонистам NMDA-рецепторов при их клиническом применении может оказаться весьма серьезной проблемой. Как ни парадоксально, одной из причин такой обеспокоенности являются результаты электрофизиологических, биохимических и поведенческих исследований, выявивших способность этанола блокировать NMDA-рецепторы в клинически значимых концентрациях, соответствующих состоянию умеренного опьянения (Colombo, Grant, 1992; Tsai et al., 1995; Lovinger, 1997; Faingold et al., 1998). Повторное употребление этанола может вызвать адаптивные изменения в NMDA-рецепторном комплексе и тем самым повлиять на фармакологическую активность антагонистов NMDA-рецепторов. Например, у экспериментальных животных, которым хронически вводили этанол, плотность связывающих участков для глутамата и дизоцилпина была значительно увеличена (Snell et al., 1993, 1996; см. также Chandler et al., 1997), что, как предполагают, отражает явление "up-регуляции" рецепторного комплекса (Trevisan et al., 1994; Follesa, Ticku, 1996). Результаты изучения поведения подтверждают развитие кросс-толерантиости, по крайней мере к конкурентным антагонистам, у животных, получавших этанол в течение нескольких дней (рис. 2.1 б[5]).
Источник: Беспалов А. Ю., Звартау Э. Э., «Нейропсихофармакология антагонистов NMDA-рецепторов» 2000
А так же в разделе «Развитие толерантности »
- NMDA-рецепторы и физиологические механизмы болевой чувствительности
- Анальгетическая активность антагонистов NMDA-рецепторов
- Анальгетическая активность комбинации антагонистов NMDA-рецепторов и опиатных анальгетиков
- 2.7. Факторы, ограничивающие клиническое применение антагонистов NMDA-рецепторов
- Первично-подкрепляющие свойства
- Дискриминативные стимул ьные свойства
- Реакция электрической самостимуляции мозга
- Условнорефлекторная реакция предпочтения места
- Возможные пути ослабления психотомиметического и аддиктивного потенциала антагонистов NMDA-рецепторов
- Расстройства внимания и сенсомоторный дефицит
- Нейротоксическое действие