Теоретическое обоснование эффектов антагонистов NMDA-рецепторов
Внутриклеточные механизмы адаптации
Описанные выше экспериментальные свидетельства влияния антагонистов NMDA- рецепторов на развитие толерантности, и в особенности толерантности к антиноци- цептивной активности морфина, позволяют существенно дополнить и/или изменить представления о механизмах развития толерантности.
Один из наиболее существенных выводов, который можно сделать на основании имеющихся данных, заключается в признании ключевой роли гиперактивации NMDA-рецепторов в развитии толерантности к морфину (и, возможно, к другим психоактивным веществам). Доказательство этого положения следует разбить на несколько основных пунктов.
Во-первых, в исследованиях, выполненных Симонне и его коллегами (Larcher et al., 1998; Laulin et al., 1998, 1999), выявлено, что через несколько часов после введения героина развивается гипералгезия, которая блокируется введением антагонистов NMDA-рецепторов. При повторном введении героина развивающаяся гипералгезия накапливается, все более и более противодействуя его анальгетическому эффекту. Скорее всего, аналогичные процессы возникают и при введении морфина. Ослабляя эту гипералгетическую реакцию, антагонисты NMDA-рецепторов оказываются способными как удлинять морфиновую анальгезию, так и восстанавливать анальгетичсскую активность морфина у животных с острой толерантностью (см. гл. 3.1.3.5). Более того, именно благодаря влиянию на постепенно развивающуюся гипералгезию, антагонисты NMDA-рецепторов угнетают развитие толерантности при отсроченном введении (см. гл. 3.1.3.6).
Взаимодействие гипоалгезии (вследствие непосредственной стимуляции опиатных рецепторов) и компенсаторной гипералгезии, опосредованной NMDA-рецепторами, несомненно, является очень динамичным процессом. Введение опиатного антагониста вскоре (через 30-60 мин) после введения опиатного агониста позволяет гипералгезии проявиться раньше, чем в случае без опиатного антагониста (Larcher et al, 1998; Laulin et al, 1998, 1999). Введение опиатного антагониста налоксона через 2 ч после однократной инъекции морфина (10 мг/кг) усиливает спинальные эффекты NMDA-рецепторов (Kreeger et al., 1994; Yukhananov, Larson, 19946). Другим проявлением этого феномена является сенситизация к опиатным антагонистам, развивающаяся после однократной инъекции морфина (см. гл. 4.4.1.2).
Результаты всех вышеописанных экспериментов свидетельствуют о том, что критический период для развития толерантности (острой и субхронической) приходится на 2-4 ч с момента введения морфина. Это заключение находится в полном соответствии с результатами исследования временно'й кинетики развития острой толерантности к морфину (Hovav, Weinstock, 1987). Установлено, что феномен острой толерантности можно продемонстрировать с помощью двух инъекций морфина, производимых с различными интервалами. Активность второй дозы значительно снижается при введении через 4 ч после первой. Более того, если длительность действия морфина ограничить до 75 мин путем введения налоксона (или используя короткодействующий агонист фентанил), толерантность ко второй дозе все равно развивается при условии, что второе введение осуществлено спустя 4 ч после первого. Однако если налоксон ввести на пике действия морфина (через 30 мин), толерантность не развивается.
Во-вторых, есть данные о том, что агонисты глутаматных рецепторов (включая NMDA) вызывают при интратекальном введении и гиперестезию, и гиперрефлексию, проявляющуюся поведением "самокусания", чесанием и т. д. (Yaksh et al., 1986; Urea, Raigorodsky, 1988; Lutfy, Weber, 1996). Иными словами, повышение активности NMDA-рецепторов путем непосредственной активации этих рецепторов агонистами коррелирует с облегчением проведения ноцицептивной информации.
В-третьих, известно, что одним из внутриклеточных последствий стимуляции ц-опиатных рецепторов является активация протеинкиназ А и С, которые регулируют активность NMDA-рецепторов путем фосфорилирования внутриклеточного домена (Gerber et al., 1989; Chen, Huang, 1991; Mayer et al., 1999). Изменения функциональной активности NMDA-рецепторов вследствие опиатнои стимуляции могут рано или поздно проявиться адаптивными изменениями уровней экспрессии NMDA-рецепторного комплекса или его составляющих. Преходящая (кратковременная) стимуляция NMDA-рецепторов после системного введения морфина сопровождается последующим снижением уровня экспрессии мРНК для субъединиц NMDA-рецептора (Le Greves et al., 1998). Предполагая активацию NMDA-рецепторов, зависимую от ПКА и/или ПКС, следует упомянуть конкретные субъединицы NMDA-рецепторов (NR2A и NR2B), которые активируются форболовыми эфирами (Yamakura, Shimoji, 1999). Следовательно, способность антагонистов NMDA-рецепторов замедлять развитие толерантности к опиатнои анальгезии должна напрямую зависеть от профиля связывания антагониста с NMDA-рецепторами с различным субъединичным составом. Эта способность, видимо, зависит не только от субъединицы NR2, но и от NR1. Например, известно, что кластеризация NMDA-рецепторов (см. гл. 1.5.2) зависит от присутствия сплайс-варианта субъединицы NR1, содержащей фрагмент Cl (Ehlers et al., 1995; Tingley et al., 1997).
Таким образом, общую схему взаимодействия опиатного и NMDA-рецепторов в контексте развития толерантности можно представить следующим образом (рис. 3.13; см. также Mayer et al., 1999). Введение морфина активирует опиатные рецепторы, усиливающие активность ПКС и ПКА, которые, в свою очередь, повышают функциональную готовность NMDA-рецепторов, что в конце концов проявляется гиперестезией, гипералгезией и снижением анальгетического потенциала морфина. Интересно, что предположение о развитии гипералгетических реакций лежит в основе ряда современных теорий развития толерантности (Siegel, 1988; и др.). Более подробно применение этого принципа для объяснения развития толерантности обсуждается в гл. 3.3.3
Аналогичная схема может быть предложена для объяснения развития острой толерантности к другим нейроактивным веществам, таким как, например, этанол (Chandler et al., 1998). Однократное применение этанола in vitro вызывает подавление возбуждающих постсинаптических потенциалов в гиппокампе, опосредованных NMDA-рецепторами. Однако этот эффект этанола через некоторое время ослабевает, свидетельствуя о развитии острой толерантности. Острая толерантность к этанолу не наблюдается у мышей с "выключенным" (нокаут) геном, контролирующим экспрессию тирозиновой киназы Fyn (Miyakawa et al., 1997).
Поскольку NMDA-рецепторы играют определенную роль в процессах клеточной смерти (см гл. 1.3.1), развитие гиперактивности NMDA-рецепторов вследствие введения различных нейроактивных веществ может отражаться даже в избыточной гибели нейронов в отдельных структурах ЦНС. Например, развитие толерантности к опиатной анальгезии сопровождается появлением так называемых "темных" нейронов в спинном мозге, соответствущих по всем характеристикам нейронам, погибшим по механизмам "программированной" смерти (апоптоз; Mayer et al., 1999). Аналогичное нейротоксическое действие оказывает длительное введение этанола (Chandler et al., 1993).
Далее можно предположить, что механизмы, ответственные за развитие и проявление острой толерантности, каким-то образом принимают участие в формировании субхронической толерантности. Однако такое предположение непременно основывается на допущении, что в процесс вовлекается как минимум еще один механизм. Дело в том, что особенностью субхронической толерантности (т. е. толерантности, сопровождающей повторные введения опиатного агониста) является постепенное увеличение ее амплитуды!, т. е. прогрессивное снижение анальгетической активности опиатного аго-
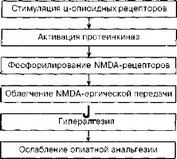
Рис. 3.13. Схематическое представление механизма развития гипералгезии и острой толерантности после однократного введения морфина (см объяснения в тексте)
ниста. Действительно, как уже отмечалось, гипералгезия, развивающаяся вследствие острой стимуляции опиатных рецепторов, обладает способностью накапливаться. Здесь представляется уместным вспомнить о различиях в методах индукции толерантности (дробное или постоянное введение), о которых говорилось выше. Для развития толерантности вследствие постоянной инфузии опиатного агониста, пожалуй, никакого дополнительного механизма не требуется. Постоянная стимуляция опиатного рецептора может оказаться единственным фактором, ответственным за накопление гиперактивности NMDA-рецепторов и развитие толерантности.
При дробных введениях опиатного агониста из-за ограничений, зависящих от фармакокинетического профиля вещества, стимуляция рецептора сменяется периодами отсутствия стимуляции. Такое чередование дает возможность организму быстро компенсировать изменения, вызванные введением опиата, и восстановить ресурсы без каких-либо адаптивных перестроек. Очевидно, что на самом деле все обстоит иначе, и адаптивные изменения развиваются.
Данные о развитии гиперактивности NMDA-рецепторов вследствие введения нейроактивных веществ указывают на определяющую роль посттрансляционных механизмов в развитии толерантности. Уже подчеркивалось, что развитие толерантности к опиатным агонистам не удается объяснить изменениями количества и/или аффинности опиатных рецепторов. Для этанола складывается такая же картина (Chandler et al, 1997,1998).
Следовательно, необходим поиск дополнительных механизмов, которые были бы ответственны за удержание компенсаторных изменений, запускаемых острой стимуляцией опиатных рецепторов.
Описанные выше экспериментальные свидетельства влияния антагонистов NMDA- рецепторов на развитие толерантности, и в особенности толерантности к антиноци- цептивной активности морфина, позволяют существенно дополнить и/или изменить представления о механизмах развития толерантности.
Один из наиболее существенных выводов, который можно сделать на основании имеющихся данных, заключается в признании ключевой роли гиперактивации NMDA-рецепторов в развитии толерантности к морфину (и, возможно, к другим психоактивным веществам). Доказательство этого положения следует разбить на несколько основных пунктов.
Во-первых, в исследованиях, выполненных Симонне и его коллегами (Larcher et al., 1998; Laulin et al., 1998, 1999), выявлено, что через несколько часов после введения героина развивается гипералгезия, которая блокируется введением антагонистов NMDA-рецепторов. При повторном введении героина развивающаяся гипералгезия накапливается, все более и более противодействуя его анальгетическому эффекту. Скорее всего, аналогичные процессы возникают и при введении морфина. Ослабляя эту гипералгетическую реакцию, антагонисты NMDA-рецепторов оказываются способными как удлинять морфиновую анальгезию, так и восстанавливать анальгетичсскую активность морфина у животных с острой толерантностью (см. гл. 3.1.3.5). Более того, именно благодаря влиянию на постепенно развивающуюся гипералгезию, антагонисты NMDA-рецепторов угнетают развитие толерантности при отсроченном введении (см. гл. 3.1.3.6).
Взаимодействие гипоалгезии (вследствие непосредственной стимуляции опиатных рецепторов) и компенсаторной гипералгезии, опосредованной NMDA-рецепторами, несомненно, является очень динамичным процессом. Введение опиатного антагониста вскоре (через 30-60 мин) после введения опиатного агониста позволяет гипералгезии проявиться раньше, чем в случае без опиатного антагониста (Larcher et al, 1998; Laulin et al, 1998, 1999). Введение опиатного антагониста налоксона через 2 ч после однократной инъекции морфина (10 мг/кг) усиливает спинальные эффекты NMDA-рецепторов (Kreeger et al., 1994; Yukhananov, Larson, 19946). Другим проявлением этого феномена является сенситизация к опиатным антагонистам, развивающаяся после однократной инъекции морфина (см. гл. 4.4.1.2).
Результаты всех вышеописанных экспериментов свидетельствуют о том, что критический период для развития толерантности (острой и субхронической) приходится на 2-4 ч с момента введения морфина. Это заключение находится в полном соответствии с результатами исследования временно'й кинетики развития острой толерантности к морфину (Hovav, Weinstock, 1987). Установлено, что феномен острой толерантности можно продемонстрировать с помощью двух инъекций морфина, производимых с различными интервалами. Активность второй дозы значительно снижается при введении через 4 ч после первой. Более того, если длительность действия морфина ограничить до 75 мин путем введения налоксона (или используя короткодействующий агонист фентанил), толерантность ко второй дозе все равно развивается при условии, что второе введение осуществлено спустя 4 ч после первого. Однако если налоксон ввести на пике действия морфина (через 30 мин), толерантность не развивается.
Во-вторых, есть данные о том, что агонисты глутаматных рецепторов (включая NMDA) вызывают при интратекальном введении и гиперестезию, и гиперрефлексию, проявляющуюся поведением "самокусания", чесанием и т. д. (Yaksh et al., 1986; Urea, Raigorodsky, 1988; Lutfy, Weber, 1996). Иными словами, повышение активности NMDA-рецепторов путем непосредственной активации этих рецепторов агонистами коррелирует с облегчением проведения ноцицептивной информации.
В-третьих, известно, что одним из внутриклеточных последствий стимуляции ц-опиатных рецепторов является активация протеинкиназ А и С, которые регулируют активность NMDA-рецепторов путем фосфорилирования внутриклеточного домена (Gerber et al., 1989; Chen, Huang, 1991; Mayer et al., 1999). Изменения функциональной активности NMDA-рецепторов вследствие опиатнои стимуляции могут рано или поздно проявиться адаптивными изменениями уровней экспрессии NMDA-рецепторного комплекса или его составляющих. Преходящая (кратковременная) стимуляция NMDA-рецепторов после системного введения морфина сопровождается последующим снижением уровня экспрессии мРНК для субъединиц NMDA-рецептора (Le Greves et al., 1998). Предполагая активацию NMDA-рецепторов, зависимую от ПКА и/или ПКС, следует упомянуть конкретные субъединицы NMDA-рецепторов (NR2A и NR2B), которые активируются форболовыми эфирами (Yamakura, Shimoji, 1999). Следовательно, способность антагонистов NMDA-рецепторов замедлять развитие толерантности к опиатнои анальгезии должна напрямую зависеть от профиля связывания антагониста с NMDA-рецепторами с различным субъединичным составом. Эта способность, видимо, зависит не только от субъединицы NR2, но и от NR1. Например, известно, что кластеризация NMDA-рецепторов (см. гл. 1.5.2) зависит от присутствия сплайс-варианта субъединицы NR1, содержащей фрагмент Cl (Ehlers et al., 1995; Tingley et al., 1997).
Таким образом, общую схему взаимодействия опиатного и NMDA-рецепторов в контексте развития толерантности можно представить следующим образом (рис. 3.13; см. также Mayer et al., 1999). Введение морфина активирует опиатные рецепторы, усиливающие активность ПКС и ПКА, которые, в свою очередь, повышают функциональную готовность NMDA-рецепторов, что в конце концов проявляется гиперестезией, гипералгезией и снижением анальгетического потенциала морфина. Интересно, что предположение о развитии гипералгетических реакций лежит в основе ряда современных теорий развития толерантности (Siegel, 1988; и др.). Более подробно применение этого принципа для объяснения развития толерантности обсуждается в гл. 3.3.3
Аналогичная схема может быть предложена для объяснения развития острой толерантности к другим нейроактивным веществам, таким как, например, этанол (Chandler et al., 1998). Однократное применение этанола in vitro вызывает подавление возбуждающих постсинаптических потенциалов в гиппокампе, опосредованных NMDA-рецепторами. Однако этот эффект этанола через некоторое время ослабевает, свидетельствуя о развитии острой толерантности. Острая толерантность к этанолу не наблюдается у мышей с "выключенным" (нокаут) геном, контролирующим экспрессию тирозиновой киназы Fyn (Miyakawa et al., 1997).
Поскольку NMDA-рецепторы играют определенную роль в процессах клеточной смерти (см гл. 1.3.1), развитие гиперактивности NMDA-рецепторов вследствие введения различных нейроактивных веществ может отражаться даже в избыточной гибели нейронов в отдельных структурах ЦНС. Например, развитие толерантности к опиатной анальгезии сопровождается появлением так называемых "темных" нейронов в спинном мозге, соответствущих по всем характеристикам нейронам, погибшим по механизмам "программированной" смерти (апоптоз; Mayer et al., 1999). Аналогичное нейротоксическое действие оказывает длительное введение этанола (Chandler et al., 1993).
Далее можно предположить, что механизмы, ответственные за развитие и проявление острой толерантности, каким-то образом принимают участие в формировании субхронической толерантности. Однако такое предположение непременно основывается на допущении, что в процесс вовлекается как минимум еще один механизм. Дело в том, что особенностью субхронической толерантности (т. е. толерантности, сопровождающей повторные введения опиатного агониста) является постепенное увеличение ее амплитуды!, т. е. прогрессивное снижение анальгетической активности опиатного аго-

Рис. 3.13. Схематическое представление механизма развития гипералгезии и острой толерантности после однократного введения морфина (см объяснения в тексте)
ниста. Действительно, как уже отмечалось, гипералгезия, развивающаяся вследствие острой стимуляции опиатных рецепторов, обладает способностью накапливаться. Здесь представляется уместным вспомнить о различиях в методах индукции толерантности (дробное или постоянное введение), о которых говорилось выше. Для развития толерантности вследствие постоянной инфузии опиатного агониста, пожалуй, никакого дополнительного механизма не требуется. Постоянная стимуляция опиатного рецептора может оказаться единственным фактором, ответственным за накопление гиперактивности NMDA-рецепторов и развитие толерантности.
При дробных введениях опиатного агониста из-за ограничений, зависящих от фармакокинетического профиля вещества, стимуляция рецептора сменяется периодами отсутствия стимуляции. Такое чередование дает возможность организму быстро компенсировать изменения, вызванные введением опиата, и восстановить ресурсы без каких-либо адаптивных перестроек. Очевидно, что на самом деле все обстоит иначе, и адаптивные изменения развиваются.
Данные о развитии гиперактивности NMDA-рецепторов вследствие введения нейроактивных веществ указывают на определяющую роль посттрансляционных механизмов в развитии толерантности. Уже подчеркивалось, что развитие толерантности к опиатным агонистам не удается объяснить изменениями количества и/или аффинности опиатных рецепторов. Для этанола складывается такая же картина (Chandler et al, 1997,1998).
Следовательно, необходим поиск дополнительных механизмов, которые были бы ответственны за удержание компенсаторных изменений, запускаемых острой стимуляцией опиатных рецепторов.
Источник: Беспалов А. Ю., Звартау Э. Э., «Нейропсихофармакология антагонистов NMDA-рецепторов» 2000
А так же в разделе «Теоретическое обоснование эффектов антагонистов NMDA-рецепторов »
- Толерантность к эффектам фентанила и других опиатных агонистов
- Толерантность, вызванная нефармакологической стимуляцией
- Ассоциативная толерантность
- Экспрессия толерантности
- Острая толерантность
- Отсроченное введение антагонистов NMDA-рецепторов
- Толерантность к эффектам других психоактивных веществ
- Системная теория боли
- Концепция "внутрилекарственного обусловливания"