Теоретическое обоснование влияния антагонистов NMDA- рецепторов на подкрепляющие свойства наркотиков
Самое простое объяснение антиаддиктивных эффектов антагонистов NMDA-рецепторов заключается в предположении, что эти вещества ослабляют эффекты наркотиков путем специфического (включая аллостерические механизмы) взаимодействия с рецепторами, опосредующими эффекты наркотиков. Однако такое предположение можно с уверенностью отбросить, для чего достаточно даже поверхностного анализа имеющихся данных. Приведем лишь примеры, касающиеся исследований эффектов морфина и кокаина, т. е. веществ, которые наиболее обстоятельно обсуждались выше. Потенцирование или простая аддитивность отмечены для эффектов морфина и антагонистов NMDA-рецепторов на болевое реагирование (см. гл. 2.6.3), летальных эффектов и каталепсии (Trujillo, Aid), 19916), а также для изменений спектров
ЭЭГ (Haberny, Young, 1995). Отрицательное взаимодействие обнаружено для судорожных эффектов морфина (Lutfy et al., 1994), не говоря уже о подкрепляющих свойствах этого вещества (см. выше).
Сочетанное введение антагонистов NMDA-рецепторов и кокаина приводит к ослаблению многих эффектов кокаина, включая проконвульсивное действие (Witkin, Tortella, 1991; Witkin, Acri, 1995; Barat, Abdel-Rahman, 1997), сердечно-сосудистые и гормональные эффекты (Hageman, Simor 1993; Damianopoulos, Carey, 1995). Однако опять же существует целый ряд других эффектов кокаина или иных экспериментальных ситуаций, когда наблюдается либо обратный эффект (например синергизм между кокаином и дизоцилпином), либо отсутствие какого-либо взаимодействия. Например, субъективные эффекты кокаина не нарушаются при совместном введении с антагонистами NMDA-рецепторов (Witkin, Acri, 1995; Kantak et al., 1998).
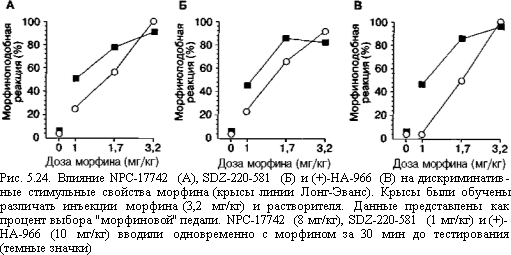
Результаты экспериментов по изучению дискриминативных стимульных свойств представляют особый интерес, так как прекрасно иллюстрируют специфичность поведенческого анализа аддиктивного потенциала фармакологических средств. Для большинства экспериментальных методик, используемых для изучения подкрепляющих свойств наркотиков, кажется естественным, что субъективные эффекты, производимые этими веществами, наиболее существенны и определяют формирование аддиктивного поведения (например при выработке условной реакции предпочтения места, ассоциированного с введением наркотика). Однако такой подход противоречит классическим представлениям о том, что подкрепляющие свойства и субъективные эффекты не имеют ничего общего на операционном уровне. В качестве примера стоит привести данные, указывающие, что субъективные эффекты не только кокаина (Witkin, Acri, 1995; Kantak et al., 1998), но и этанола (Bienkowski, Kostowski, 1998; Koros et al., 1999), и морфина (Bespalov et al., 1998a) не ослабевают при сочетанном введении антагонистов NMDA-рецепторов. Как видно из рис. 5.23 и 5.24, при введении морфина в комбинации с различными антагонистами NMDA-рецепторов диск- риминативные стимульные свойства морфина меняются, но недостаточно для того, чтобы предположить вклад этих изменений в модулирующее влияние антагонистов NMDA-рецепторов на аддиктивный потенциал морфина1. Такое заключение основывается на том, что хотя все исследованные вещества отрицательно модулируют активность NMDA-рецепторного комплекса, только канальный блокатор дизоцил- пин и полиаминовый антагонист элипродил в некоторой степени снижали различительные свойства морфина, в то время как конкурентные антагонисты NPC-17742 и SDZ-220-581, а также глициновый частичный агонист (+)-НА-966 оказывали противоположное влияние (Bespalov et al., 1998а). Для сравнения укажем, что предварительное введение опиатных антагонистов приводит к значительному сдвигу вправо кривой "доза-эффект" для морфина.
Таким образом, маловероятно, что антагонисты NMDA-рецепторов оказывают антиаддиктивное действие за счет прямого взаимодействия с рецепторами, с которыми связываются аддиктивные вещества. Более того, эффекты антагонистов NMDA- рецепторов не связаны с изменением субъективных эффектов аддиктивных веществ.
Очевидно, что выработка и поддержание зависимости для любого аддиктивного вещества основывается на двух более или менее независимых механизмах. Первый
“ Эксперименты выполнены совместно с Р. Л Балстером, П М. Бирдсли.
А Б
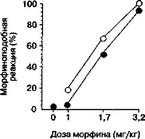
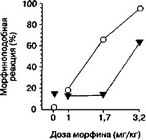
Рис. 5.23. Влияние дизоцилпина (А) и элипродила (Б) на дискриминативные стимульные свойства морфина (крысы линии Лонг-Эванс). Крысы были обучены нажимать на педаль для получения пищевого подкрепления. Стандартная оперантная камера Скиннера была оборудована двумя педалями. Во время обучения для получения пищи крысы должны были выбрать одну из этих двух педалей, если предварительно им вводили морфин (3,2 мг/кг), и другую педаль — после введения растворителя. Во время теста нажатие на любую педаль приводило к получению пищи. Данные представлены как процент выбора "морфиновой" педали. Дизоцилпин (0,03 мг/кг; темные кружки) или элипродил (17,3 мг/кг; темные треугольники) вводили одновременно с морфином за 30 мин до тестирования механизм относительно специфичен для каждого вещества и отражает профиль рецепторного действия и спектр психофармакологических свойств (например эйфори- генные свойства), характерных для него. Второй механизм — скорее всего, общий для всех аддиктивных веществ и связан с универсальными процессами адаптации к воздействию нейроактивных веществ.
Существование этих двух механизмов подчеркивается рядом экспериментальных фактов. Самыми яркими из них являются противоречивые данные, получаемые при
исследовании поведения животных, у которых были разрушены определенные отделы мезолимбической системы. Избирательные разрушения дофаминергических тер- миналей в прилежащем ядре снижают чувствительность к эффектам различных ад- диктивных веществ (Lyness et al., 1979; Roberts et al., 1980; Spyraki et al., 1982,1983; Pettit et al., 1984; Koob, 1992), уменьшают спонтанную локомоторную активность (Kelly, Iversen, 1976; Joyce et al., 1983) и аппетитивную фазу полового поведения (Everitt, 1990). У этих животных также снижена чувствительность к "награждающей" электрической стимуляции мезолимбической системы (Fibiger et al., 1976; Stellar, Corbett, 1989).
В то же время разрушения тел нейронов прилежащего ядра не нарушают реакцию самостимуляции (Johnson, Stellar, 1994), не снижают спонтанную локомоторную активность и оказывают неоднозначное влияние на психостимулирующие свойства наркотиков (Kehne et al., 1981; Carey, 1982; Makanjuola, Ashcroft, 1982; Kelly, Roberts, 1983; Kafetzopoulos, 1986).
Еще один пример — не вызывающий никаких сомнений аддиктивный потенциал этанола и фенциклидиноподобных канальных блокаторов NMDA-рецепторов. С одной стороны, мезолимбический дофаминергический тракт, безусловно, задействован в реализации подкрепляющих свойств этанола и канальных блокаторов. Однако причинно-следственная связь между угнетением этими веществами глутаматерги- ческой передачи и стимуляцией метаболизма дофамина не прослеживается (Diana et al., 1993; French, 1994). С другой стороны, влияние эффектов антагонистов NMDA- рецепторов на подкрепляющие свойства этанола довольно трудно поддается анализу. Например, мемантин не влияет на потребление этанола (Piasecki et al., 1998), но на результаты таких экспериментов серьезное влияние может оказывать сходство субъективных эффектов этанола и антагонистов NMDA-рецепторов (Colombo, Grant, 1992; Bienkowski et al., 1996,1998; Hundt et al., 1998), и, следовательно, выбор экспериментальной модели и параметров для анализа будет играть решающую роль. Есть убедительные свидетельства того, что подкрепляющие свойства этанола и других исследованных аддиктивных веществ реализуются при непосредственном участии глутаматергической передачи в мезолимбической системе (Rassnick et al., 1992a; Yan et al., 1998). Более того, вторично-подкрепляющие (Lamblin et al., 1993; Lin, Hubbard, 1995; Biala, Kotlinska, 1999), безусловные психостимулирующие свойства этанола (Liljequist, 1991a), а также метаболическая активация мезолимбической системы (Wu, 1993) ослабевают при совместном введении с канальными блокаторами, конкурентными и глициновыми антагонистами NMDA-рецепторов. Эффекты антагонистов NMDA-рецепторов (даже канальных блокаторов типа дизоцилпина) на подкрепляющие свойства наркотиков не связаны с дофаминопозитивным потенциалом антагонистов (Pierce et al., 1997).
Универсальный механизм выработки зависимости может быть исследован как "процесс подкрепления", процесс избирательного повышения поведенческой значимости стимулов, ассоциированных с действием наркотика, или как "процесс формирования сенситизации в мезокортиколимбической системе мозга". Принципиальных отличий между этими подходами к определению универсального механизма обнаружить не удается, так как внешние различия отражают абсолютно разные методы анализа и порой трудно совместимые подходы к построению схемы эксперимента.
Поведенческие методы анализа имеют определенные преимущества, так как позволяют значительно уменьшить количество факторов, потенциально влияющих на исход экспериментального исследования. Например, некоторые антагонисты NMDA-рецепторов (фенциклидиноподобные канальные блокаторы), подобно большинству аддиктивных веществ, усиливают пресинаптическое высвобождение дофамина в мезолимбической системе. Эти эффекты не являются характерными для блокады NMDA-рецепторов, а, возможно, связаны со способностью фенциклидиноподобных канальных блокаторов усиливать in vivo активность дофаминергических нейронов в ВТО, посылающих проекции в другие структуры мезолимбической системы в переднем мозге (French, 1994; см. также гл. 2.7.1). Однако это явление не воспроизводится in vitro на срезах среднего мозга (French, 1994). Видимо, при приготовлении срезов мозга исследуемая система теряет наиболее существенные компоненты (определенные связи между структурами мозга).
В целом создается впечатление, что попытки разобраться в комплексных нейрохимических механизмах действия будут еще долго обречены на неудачу, если экспериментальный анализ не станет основываться на едином многоуровневом подходе к проблемам подкрепления и аддиктивного поведения. Для того чтобы предложить такую многоуровневую систему, стоит разнести всю имеющуюся информацию в два отдельных кластера.
С одной стороны, острые психостимулирующие и эйфоригенные свойства аддиктивных веществ коррелируют с активацией дофаминергической передачи в мезолимбической системе. Для каждого вещества механизм активации различен и отражает особенности нейроанатомического распределения специфических рецепторов для этих веществ на клеточном и системном уровне. Например, известно, что психостимулирующие свойства кофеина опосредованы аденозиновыми рецепторами А(- и АА- подтипов (Fredholm et al., 1999). А2Л-рецепторы потенцируют эффекты стимуляции Огдофаминовых рецепторов. Агаденозиновые рецепторы модулируют пресинаптическое высвобождение медиаторов, что сближает кофеин с другими аддиктивными веществами, практически все из которых усиливают высвобождение дофамина (см. выше). С другой стороны, действуя через А(-рецепторы, находящиеся на возбуждающих глутаматергических проекциях в полосатое тело, аденозин тормозит также высвобождение глутамата. Кофеин блокирует эти рецепторы и, следовательно, может способствовать высвобождению глутамата. Доказана способность не только кофеина, но и других аддиктивных веществ усиливать высвобождение в мезолимбической системе дофамина и глутамата (Pap, Bradberry, 1995; Smith et al., 1995).
Процесс формирования аддиктивного поведения зависит от активности глутама- тергической системы и сопровождается постепенным развитием сенситизации дофаминергической системы. Антагонисты дофаминовых рецепторов подавляют острые стимулирующие эффекты, но практически не влияют на развитие сенситизации (Broadbent et al., 1995). Более того, антагонисты дофаминовых рецепторов не оказывают значительного влияния на выработку и проявление вторично-подкрепляющих свойств аддиктивных веществ, лишенных прямой дофаминомиметической активности (например этанола; Cunningham et al., 1992; Risinger et al., 1992). Аналогичный вывод следует из результатов работ с применением избирательного разрушения дофаминергических терминалей в проекционных областях мезолимбической системы, таких как прилежащее ядро (Rassnick et al., 1993; см. выше).
Антагонисты NMDA-рецепторов могут противодействовать острым эффектам некоторых аддиктивных веществ, но они наиболее эффективны при применении с целью предотвращения формирования хронического адаптивного процесса. Более того, блокада NMDA-рецепторов оказывает большее влияние на выработку, чем на проявление этих адаптивных реакций. В табл. 5.2 сравниваются среднеэффективные дозы антагонистов NMDA-рецепторов, полученные при исследовании влияния этих веществ на выработку и проявление условной реакции предпочтения места, ассоциированного с введением морфина.
При более детальном анализе имеющихся данных можно обнаружить еще целый ряд аналогичных примеров. Например, антагонисты NMDA-рецепторов снижают выработку предпочтения этанола у необученных животных, но не влияют на выбор этанола у животных, у которых сформировалось предпочтение питьевых растворов, содержащих этанол (Lin, Hubbard, 1995).
Парадоксально, но точно к таким же выводам привели в конечном итоге исследования влияния антагонистов NMDA-рецепторов на память и обучение, не связанные с фармакологической стимуляцией (Miserendino et al., 1990; Morris et al., 1990; Bliss, Collingridge, 1993). Помимо чисто теоретического интереса, эти выводы имеют большое практическое значение, так как позволяют предположить, что отрицательное влияние некоторых антагонистов NMDA-рецепторов на память и обучение не скажется на воспроизведении ранее приобретенных реакций и действий, т. е. сохранит функциональные характеристики организма, который будет находиться под воздействием антагонистов NMDA-рецепторов.
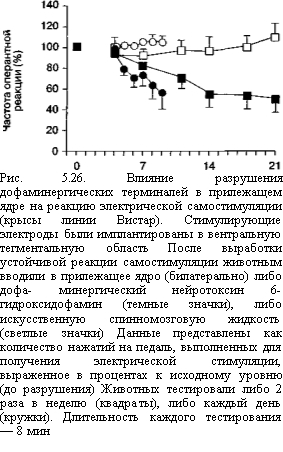
Описанные выше результаты экспериментов с локальным внутримозговым введением антагонистов NMDA-рецепторов указывают на вентральные отделы полосатого тела (прилежащее ядро) как на возможный нейроанатомический субстрат формирования адаптивных изменений, зависимых от активности глутаматергической системы. Данные, полученные при изучении эффектов разрушений мезолимбичес- кой системы, также подтверждают эти предположения. Животные, у которых были предварительно разрушены тела нейронов прилежащего ядра, не способны обучаться нажимать на педаль для получения электрической стимуляции ВТО (рис. 5.25; Bespalov, Zvartau, 19956).
Подчеркнем еще раз, что после того как реакция самостимуляции уже выработана, эти разрушения значительно менее эффективны (Johnson, Stellar, 1994). Напротив, у животных, успешно обученных реакции самостимуляции, повреждающими свойствами обладают разрушения, избирательно затрагивающие дофаминергичес- кие терминали проекций из ВТО в прилежащее ядро. Интересно, что эффект этих разрушений проявляется не сразу и зависит в большей степени от общего количества
Таблица 5.2. Среднеэффективные дозы (мг/кг) антагонистов NMDA-рецепторов на модели условной реакции предпочтения места, ассоциированного с введением морфина
|
Вещество |
Выработка |
Экспрессия |
|
Дизоцилпин |
0,05(0,03-0,07) |
0,28(0,11-0,45) |
|
D-CPPene |
1,2 (0,8-1,6) |
6,1 (3,7-8,5) |
|
Мемантин |
3,4(1,9-4,9) |
Эффект отсутствует |


реакций, выполненных после разрушения, чем от фактора времени (рис. 5.261). В гл. 6 предлагается гипотеза, объясняющая, почему деятельность организма может способствовать угашению приобретенной реакции.
Можно предполагать, что универсальный механизм формирования аддиктивного поведения, локализующийся в вентральных отделах полосатого тела, активно включается лишь на этапах выработки. После того как поведение сформировано и стабильно, автоматическое исполнение приобретенных реакций осуществляется, в том числе, и другими структурами (например дорсальными отделами полосатого тела).
Г ипотетический универсальный механизм формирования хронической адаптивной реакции в ответ на повторные воздействия нейро- и психоактивных веществ представлен на рис. 5.27. Следует обратить внимание на то, что эта схема является своего рода дальнейшим развитием схемы, предложенной в гл. 4.5 для объяснения развития толерантности и зависимости. В отличие от предыдущей схемы на рис. 5.27 не обозначен рецептор, через который действует нейроактивное вещество. На самом деле тип рецептора не имеет большого значения при обсуждении этой гипотетической модели. Помимо u-опиатного рецептора (рис. 4.14) существует еще целый ряд рецепторов, которые сопряжены со стимулирующим G-белком и аденилатциклазным каскадом. Для настоящей главы наибольший интерес может представлять Di-дофаминовый рецептор. Стимуляция этого рецептора, сопровождающая острые эффекты аддиктивных веществ, приведет к тем же последствиям, что и стимуляция ц-опиатного рецептора (Chergui, Lacey, 1999). Этим, в некотором смысле конечным этапом, согласно предлагаемой схеме, может быть гиперактивация NMDA-рецепторов.
Эксперименты выполнены совместно с Я. М. вап Ри, Г. Волтеринком.
Дни
Схема, представленная на рис. 5.27, предполагает существование универсального механизма взаимодействия NMDA-рецепторов с процессами адаптации к эффектам различных нейро- и психоактивных веществ. Совершенно необязательно, чтобы этот
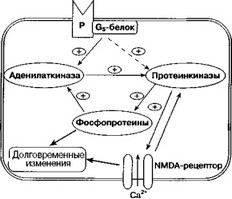
Рис. 5.27. Гипотетическая схема формирования хронической адаптивной реакции (объяснения в тексте) Р — рецептор. Пунктирной линией обозначена связь, существование которой еще недостаточно исследовано и которая, возможно, подразумевает участие в процессе одной или более систем внутриклеточных посредников
универсальный механизм ограничивался рамками, накладываемыми этой гипотетической схемой. В частности, наличие некоторой универсальности можно предполагать как для клеточных механизмов, так и для принципов синаптической организации. Например, на рис. 2.2 в гл. 2.6.1.1 было показано вероятное взаимодействие опиатного и NMDA-рецепторов в регуляции первичных и вторичных болевых сигналов. Аналогичное взаимодействие, судя по всему, имеется и в других отделах центральной нервной системы. Данные ультраструктурного анализа локализации опиатных и NMDA-рецепторов в прилежащем ядре также указывают на совместное участие этих рецепторов в регуляции пресинаптического высвобождения медиаторов (Gracy et al, 1997). Для прилежащего ядра, так же как и для других структур, установлено, что селективные агонисты д-опиатных рецепторов усиливают эффекты активации постсинаптических NMDA-рецепторов (Martm et al., 1997).
В отличие от поведенческих экспериментов, биохимические и нейрофармакологические исследования изолированных клеточных систем, структур и проекций мозга не дают целостного представления о процессе подкрепления и не позволяют применить предлагаемую модель для объяснения поведения живого организма. Поэтому разработка представления об универсальном механизме может и должна быть продолжена на надклсточном уровне.
Источник: Беспалов А. Ю., Звартау Э. Э., «Нейропсихофармакология антагонистов NMDA-рецепторов» 2000
А так же в разделе «Теоретическое обоснование влияния антагонистов NMDA- рецепторов на подкрепляющие свойства наркотиков »
- 5.2.1. Реакция внутривенного самовведения
- Реакция электрической самостимуляции мозга
- 5.3.1. Реакция условнорефлекторного предпочтения места
- Реакция электрической самостимуляции мозга
- Условнорефлекторное восстановление угашенной реакции внутривенного самовведения
- Условнорефлекторная локомоторная активность
- Сенситизация (обратная толерантность)
- Стриарные механизмы памяти и обучения: поискуниверсального механизма подкрепления на поведенческом уровне
- Принцип образования связи "стимул-реакция"
- Долговременные изменения в глутаматергических синапсах стриатума
- Г ностические модули и феномен "перепрограммирования" стриарных проекций
- Взаимодействие дофамина и глутамата
- Лимбико-моторная интеграция и проблема частного и целого
- Ожидание "награды" и "запускающий механизм"
- "Запускающий механизм": дофамин или глутамат?
- Регуляция "запускающего механизма"
- Альтернативное подкрепление и адъюнктивное поведение
- Новизна стимулов
- Основные поведенческие феномены в свете предлагаемой модели
- Угашение
- . Латентное торможение
- Внешнее (латеральное) торможение
- Избирательность образования связей "стимул-реакция"
- Регуляция активности гностических модулей
- Идеальная экспериментальная модель для анализа вклада глутаматергической системы в