Холинергическая система
Холинергические нейроны и пути. У млекопитающих скопления холинергических нейронов локализуются в таких отделах головного мозга, как медиальное ядро перегородки, ядро диагональной связки, в базальном магноцеллюлярном ядре (ядре Мейнерта), неопределенной субстанции, магноцеллюлярном преоптическом ядре, ретикулярной формации ствола мозга (рис. 14). Вставочные холинергические нейроны обнаружены в хвостатом ядре, переднем роге латерального желудочка. Они относятся к наиболее богатым аце- тилхолином мозговым структурам.
Основные холинергические пути в ЦНС — кортикальные, от магноцеллюлярных ядер переднего мозга, которые посылают свои аксоны также в таламус и миндалевидный комплекс. Наиболее важное из этих ядер — ядро Мейнерта с преимущественными проекциями во фронтальную и париетальную кору.
Неокортекс Гипоталамус Мозжечок
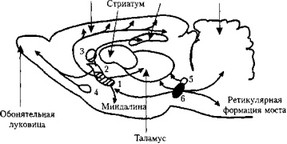
Рис. 14. Холинергические структуры и холинергические пути (цит. по: Webster R А., 2001):
1 — базальное магноцеллюлярное ядро; 2 — ядро диагональной связки; 3 — медиальное ядро перегородки; 4 — магноцеллюлярное преоптическое ядро; 5 — латеральное дорсальное тегментальное ядро; 6 — педункулопонтийное тегментальное ядро
Другие холинергические ядра (см. рис. 14) найдены в ретикулярной формации ствола мозга (латеральное дорсальное тегментальное и педункулопонтийное тегментальное ядра). Они дают проекции в таламус, к неопределенной субстанции, бледному шару, гипоталамусу и субталамусу. Холинергическое параламинарное ядро покрышки моста (педункулопонтийное тегментальное ядро) посылает афференты в таламус, магноцеллюлярное преоптическое ядро. Активация этого ядра наблюдается при парадоксальной фазе сна. От ретикулярной формации покрышки моста волокна идут через наружное коленчатое тело в затылочную область коры, формируя понтогени- кулятный путь. С его активацией связано распространение «мостоколенчатозатылочных волн», регистрируемых у животных в процессе глубокого сна.
Имеются также холинергические проекции от медиального сеп- тума и ядра диагонального пучка в гиппокамп, участвующий в процессах памяти.
Рецепторы. Скопление мускариновых рецепторов сосредоточено преимущественно в базальных отделах переднего мозга, гиппокампе, таламусе и коре головного мозга. М (-холинорецепторы обнаружены в неокортексе, гиппокампе, стриатуме, тогда как М2-холино- рецепторы — в базальном переднем мозге. Н-холинорецепторы присутствуют в различных структурах ЦНС, в частности в нейрогипофизе, в продолговатом и спинном мозге (клетках Реншоу), гиппокампе, коре головного мозга. Однако в наибольшей степени они представлены в периферической нервной системе: в нейронах ганглиев симпатической и парасимпатической нервной системы у окончаний всех преганглионарных волокон (в том числе и в мозговом веществе надпочечников), а также в нервно-мышечных синапсах скелетных мышц.
Функции холинергической системы в ЦНС. Холинергическая система мозга участвует в таких функциях, как память (кора головного мозга, гиппокамп), регуляция сложных двигательных реакций, в частности механизма инициации движений, двигательных стереотипов и т.д. (базальные ганглии), регуляция уровня бодрствования и внимания (ретикулярная формация ствола мозга, холинергические структуры переднего мозга). Поражение холинергической передачи в периферической нервной системе, в частности нервно-мышечных синапсах, связано с симптомами усталости или слабости мышц (миастения гравис). Полагают, что в основе этого заболевания лежит аутоиммунный процесс: организм вырабатывает аутоантитела, которые блокируют функцию холинорецепторов.
Регуляция уровня бодрствования. В ретикулярной формации ствола мозга М-холинорецепторы обеспечивают передачу восходящих активирующих влияний в вышележащие структуры головного мозга, вызывая ЭЭГ-реакцию активации. Так, М-холиномиметик ареколин при введении в боковые желудочки мозга животного возбуждает рецепторы ретикулярной формации ствола мозга и практически не обладает прямым возбуждающим действием на вышележащие отделы головного мозга. При таком введении ареколина кроликам наблюдались спонтанные изменения электрической активности головного мозга, характерные для реакции активации, вызываемой электрическим раздражением ретикулярной формации среднего мозга. Опыты на кроликах с перерезкой мозга на различных уровнях показали, что после премезенцефалической (выше уровня среднего мозга) перерезки ареколин уже не вызывал реакции активации в вышележащих структурах. Под влиянием М-холинолитиков ами- зила и метамизила подавлялась ЭЭГ-реакция активации, вызванная электрическим раздражением ретикулярных структур. Синхронизирующее действие амизила и метамизила на вышележащие отделы головного мозга менее выражено у животных с премезенцефалической перерезкой.
Волокна восходящей активирующей ретикулярной формации вызывают активацию коры, иннервируя неспецифические ядра та4. ламуса, а также холинергические ядра переднего мозга. Поврежде-1 ние этих структур вызывает ЭЭГ-синхронизацию, а стимуляция ан-| тихолинэстеразными веществами — десинхронизацию ЭЭГ (aroused)*j которая, как показали эксперименты, не связана с поведенческим! возбуждением. Это предполагает, что не только ацетилхолин, но и] другие медиаторы могут участвовать в регуляции сна и поддержа-! нии сознания. Однако он играет существенную роль в формировав нии парадоксальной фазы сна, так как этой фазе предшествуют! взрывные разряды холинергических нейронов покрышки варолие-1 ва моста (педункулопонтийного тегментального ядра).
Холинергическая медиация широко представлена в коре головне го мозга, и она не связана с первичными афферентными входами. Hail пример, атропин не способен блокировать возбуждение, вызванное сти J мулированием первичных афферентов. Кроме того, стимуляция аф ферентных волокон вызывает высвобождение ацетилхолина в широкой области коры, не связанной с их кортикальным представительством,; оно пропорционально уровню кортикального возбуждения. Полагают! что ацетилхолин оказывает только фоновый возбудительный эффект! на кортикальные функции. Он не может, как показали эксперименты,! напрямую стимулировать разряды пирамидных клеток, а только по-| вышает их чувствительность к другим возбудительным входам посред- J ством активации мускариновых рецепторов.
Холинергические ретикулярные ядра ствола имеют проекции и - к дофаминергическим нейронам вентральной тегментальной облает! ти, активирующие Н-холинорецепторы, в результате чего увеличи- lt; вается дофаминергическая передача. Это предполагает участие хо! линергической медиации в процессах вознаграждения, связанных с! активацией мезолимбических и мезокортикальных путей, берущих ! начало от дофаминергических нейронов вентральной тегментальной Я области. Возбуждение Н-холинорецепторов, приводящее к повышению активности этих нейронов, лежит в основе привыкания и пси- | хической зависимости к никотину при курении.
Регуляция двигательной активности. В структурах спинного моз- | га Дж. Экклсом обнаружены Н-холинорецепторы в синапсах, образуемых коллатералями аксона а-мотонейрона спинного мозга и тормозными интернейронами (клетками Реншоу), обеспечивающими 1 механизм возвратного торможения. Активация этих рецепторов небольшими дозами Н-холиномиметика никотина приводила к торможению мотонейронов спинного мозга лягушки, что сопровождалось ]
каталептическим состоянием с подтянутыми к туловищу конечностями («поза молельщика»).
Высокая концентрация ацетилхолина обнаружена в стриатуме. Здесь находятся холинергические интернейроны, оказывающие возбуждающий эффект на другие нейроны стриатума, активируя М-хо- линорецепторы. Холинергическая система стриатума сопряжена с дофаминергической. Ацетилхолин тормозит высвобождение дофамина, а дофамин, наоборот, — ацетилхолина. Разнонаправленное влияние ацетилхолина и дофамина на нейроны стриатума объясняет эффективность лечения болезни Паркинсона введением мускариновых антагонистов, тогда как агонисты мускариновых рецепторов вызывают у животных тремор.
Регуляция когнитивных процессов. В ЦНС ацетилхолин вовлекается в процессы, связанные с обучением и памятью. Поражение холинергических структур септогиппокампальной области, как и инъекции в эти структуры холинергических антагонистов, приводят к дисфункции запоминания и пространственной памяти. Инъекции же холинергических агонистов в эти регионы оказывают положительное влияние на обучение и память.
Регуляцию когнитивных процессов связывают с активацией как мускариновых, так и никотиновых холинорецепторов. Введение антагонистов М-холинорецепторов увеличивало количество проб при выработке инструментального условного рефлекса у крысы. Полагают, что в процессах памяти существенную роль играют высокочастотные разряды гиппокампальных клеток. Активация М-холинорецепторов, сопровождающаяся блокадой К+-токов, повышает возможность этих нейронов разряжаться пачками. Кроме того, часть холинергических входов в гиппокамп активирует возбудительные никотиновые холинорецепторы ГАМК-ергических интернейронов. Возбуждение интернейронов вызывает синхронизацию активности большинства глутаматергических нейронов, влияя тем самым на гиппокампальные функции, в частности на процессы памяти.
Но наиболее существенные доказательства роли ацетилхолина в когнитивных процессах дают исследования болезни Альцгеймера, характеризующейся поражением холинергических нейронов базальных ядер. Повышение холинергических функций при введении ан- тихолинэстеразных веществ или агонистов М-холинорецепторов в эти структуры помогает сохранить мнестические функции на ранней стадии этой болезни.
Холинергические процессы в ЦНС связаны и с регуляцией эмоционального поведения. Латеральный гипоталамус, миндалевидный комплекс, ретикулярная формация среднего мозга, а также обонятельные луковицы активно вовлекаются в нейрофизиологические механизмы формирования агрессивных реакций хищника. Тригер- ный механизм агрессии — холинергический, а за эффекторные проявления агрессии «ответственен» норадреналин. Холинергическая стимуляция миндалевидного комплекса вызывает резкое увеличение агрессивности и других эмоциональных реакций. Агрессивность и вокализация наблюдаются также при введении в миндалевидный комплекс карбахолина и антихолинэстеразных веществ.
Центральные М-холинолитики амизил и метамизил эффективно защищают слизистую желудка, сердечную мышцу от рефлекторной дистрофии. Известно, что гипофизарно-адреналовая система весьма чувствительно реагирует на нанесение животному чрезвычайного раздражения, при котором происходит максимальное ее возбуждение с выбросом в кровь большого количества кортикостероидов. Это приводит к нарушению трофики желудка, сердца, т.е. к нейрогенным дистрофиям. Блокируя М-холинергические синапсы активирующей ретикулярной формации ствола мозга, метамизил снимает возбуждающее действие ареколина на гипофизарно-адреналовую систему. Таким образом, уменьшением активирующего влияния ретикулярной формации на вышележащие центры, в частности на центры гипоталамической области, объясняется защитное действие центральных М-холинолитиков на развитие нейрогенных дистрофий.
Источник: Белова Е. И., «Основы нейрофармакологии» 2006