ГЛАВА 4 О ВОЗМОЖНЫХ МЕХАНИЗМАХ РАЗВИТИЯ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
Под механизмом развития ЭП В.Д. Беляков с соавт. [1] понимают существующие в современный период теории, которые в соответствии с интеллектуальным климатом времени способны объяснить, как он развивается на той или иной территории. Наиболее значимыми в современный период теориями эпидемиологии применительно к антропонозам признаны теория механизма передач Л.В. Громашевского [2], теория саморегуляции паразитарных систем В.Д. Белякова [3] и концепция Б.Л. Черкасского, рассматривающая ЭП как социально-экологическую систему [4]. Однако последняя в большей мере, на наш взгляд, представляет собой модель ЭП и обосновывает необходимость системного подхода для его изучения, нежели объясняет само развитие ЭП. В этой связи возможные механизмы «запуска» эпидемического процесса в коллективе можно представить следующим образом:
- занос возбудителя в восприимчивый коллектив (теория механизма передачи);
- интродукция в сложившийся иммунный коллектив людей, восприимчивых к циркулирующим в нем вариантам возбудителя (теория саморегуляции паразитарных систем);
- занос резервационных, эпидемических или в стадии эпидемического преобразования вариантов возбудителей в восприимчивый коллектив (теория саморегуляции паразитарных систем).
В последние годы в периодической литературе активно обсуждается и еще один относительно «новый» механизм развития ЭП, обусловленный активизацией репликации персистирующих микроорганизмов [5-7]. На его реализацию мы и хотели бы обратить особое внимание, поскольку этот механизм развития ЭП ни учеными-эпидемиологами, ни тем более практическими врачами, пока особо во внимание не принимается.
Понимание данного механизма развития ЭП тесно увязано в первую очередь с иммунологическими исследованиями. При этом следует признать, что интеграция исследований по изучению ЭП в современный период более ощутима между эпидемиологами и микробиологами, нежели эпидемиологами и иммунологами. Между тем, в разработанной нами классификации факторов риска состоянию естественной резистентности организма отводится существенная роль в качестве одного из пусковых механизмов развития ЭП [8]. В частности, проводимые нами исследования в области морской эпидемиологии по изучению иммунного статуса организма моряков в ходе длительного рейса показали, что практически любой выход в море сопровождается выраженными его изменениями [9]. Они неоднозначны и зависят от длительности и интенсивности воздействия «фактора моря» на организм моряка и его адаптивных возможностей. Поэтому, как мы полагаем, ЭП, развивающийся в условиях практически полностью замкнутого коллектива, может служить моделью для оценки обсуждаемого механизма.
Как известно, снижение общей резистентности организма людей к возбудителям инфекционных болезней ведет к росту манифестных форм и реализуется в трех основных направлениях. Прежде всего, уменьшается минимальная инфицирующая доза микроорганизмов и, следовательно, повышается риск заболевания. Далее увеличивается число случаев с тяжелым клиническим течением, и, наконец, может произойти активизация персистиру- ющих форм инфекций с переходом в манифестную. Если первые два из вышеперечисленных последствий общепризнанны и не требуют, по-нашему мнению, дополнительных разъяснений, то последний необходимо охарактеризовать более детально в связи с чрезвычайной значимостью его реализации, особенно в экстремальных ситуациях [10, 11].
Так, с позиций системного подхода, проявления эпидемического процесса на организменном уровне можно представить следующей схемой (рис. 4.1).
В ее основе - схема В.Д. Белякова [12] «Формы инфекционного процесса». Мы внесли в нее некоторые коррективы, учитывая развитие теоретических основ учения об эпидемическом процессе в современный период. Принципиально в этом плане положение о разделении понятий «бессимптомная форма инфекции» и «носи- тельство», которые в литературе часто объединяют в единое понятие - «носительство». Против этого в свое время возражал еще И.Р. Дробинский [13]. Хотя мы и не можем не согласиться с точкой зрения о все большей размытости границ между латентными, хроническими инфекциями и носительством [14]. Тем не менее любые попытки обобщений требуют определенной формализации. В схеме В.Д. Белякова, например, не учитывается, что при одномоментном заражении группы людей эпидемический процесс может быть представлен одновременно и манифестными, и бессимптомными формами инфекции. В последующем обе могут закончиться или полным освобождением от возбудителя, или носительством, 112
т.е. «... своеобразной формой сосуществования (симбиоз) патогенных микробов и организма хозяина, не проявляющейся в течение длительного времени, а в отдельных случаях - пожизненно, внешними реакциями со стороны организма» [15]. В последнее время термины «носительство» и «персистенция» часто отождествляют. Причем последний ранее использовали, говоря о вирусах, а в настоящее время распространили его на бактерии и прочие микроорганизмы [16, 17]. Учитывая имеющиеся сведения о носительст- ве различных видов микроорганизмов, мы ввели в схему понятие «носительство без выделения возбудителя во внешнюю среду».
Наше обращение к указанной схеме, объясняется тем, что в эпидемиологической литературе все чаще пишут об универсальности явления носительства, по крайней мере, для большинства инфекций [3, 18, 19]. Более того, это положение стало одним из постулатов теории саморегуляции паразитарных систем [3]. По мнению авторов теории, именно носительство как форма инфекционного процесса преобладает в фазе резервации процесса эпидемического и обеспечивает сохранение возбудителя в межэпидемический период, тем самым подчеркивается нестабильность состояния носительства и возможность его трансформации в манифестную форму. Однако механизмы такого превращения недостаточно изучены. Пожалуй, наиболее обстоятельно варианты перехода персистентной бессимптомной инфекции в клинически выраженную, представлены в работе А.А. Обгольц [16]. Вместе с тем, необходимо учитывать и поликлональность персистирующей в организме хозяина микропопуляции [20]. В ходе клинико-иммунологических исследований установлено, что иммунная система играет ведущую роль в отборе тех или иных клонов. Тем самым снижение естественной резистентности и иммунологической реактивности организма способно привести к отбору наиболее вирулентных клонов. Общеизвестно, что последние удается выделить именно в разгар инфекционного процесса. Носители и лица с бессимптомной формой инфекции индуцируют в коллективе преимущественно аналогичные состояния. Для появления в коллективе манифестных форм как следствие формирования эпидемического варианта требуется определенный временной промежуток [3]. Однако для перехода персистирующей формы инфекции (носи-
113
тельство) в манифестную с появлением эпидемического варианта нет необходимости в длительной циркуляции гетерогенного по вирулентности инфекционного агента в неиммунном коллективе. Поэтому возникновение заболевания возможно сразу вслед за действием какого-либо фактора, приводящего к дисбалансу в иммунной системе (например, выход судового экипажа в рейс).
Для дальнейшего развития эпидемического процесса возможны несколько сценариев. Первый, когда манифестирование происходит в полностью иммунном к данному инфекту коллективу, а эпидемический процесс проявляется спорадическим уровнем заболеваемости. Второй: в коллективе есть неиммунные индивидуумы либо лица, генетически более восприимчивые к данному инфекционному агенту, в таких случаях возможна экспрессия манифестных форм (эпидемическая вспышка). Подобная ситуация складывается и когда на иммунный в целом коллектив действуют экстремальные факторы, снижающие степень его восприимчивости (например, ионизирующее излучение [11]).
Проиллюстрируем представленный механизм развития ЭП на примере развития ЭП стрептококковой инфекции в период длительного рейса в относительно изолированном судовом коллективе. Как свидетельствуют наши исследования и данные других авторов [9, 21] наибольшие изменения иммунного статуса моряков приходятся на период выхода судна в море в первый месяц рейса, а также - 3-й и 4-й месяцы. Именно в это время в рейсе в основном формируются соответствующие уровни заболеваемости моряков респираторной стрептококковой инфекцией (ОРЗ, ангина) [22]. Как показывают наши исследования [7], активизация ЭП в этот период возможна вследствие преодоления скрытого до данного момента состояния носительства, в основном у «часто болеющих» членов экипажа и перехода его в манифестную форму. Как известно, от больных людей выделяются более вирулентные штаммы стрептококка, нежели от носителей . Поскольку уровень популяционного иммунитета к стрептококковой инфекции в этот период у экипажа низкий [7], а в условиях судна контакты между членами экипажа, естественно, очень тесные, то это проявляется внутрирейсовым подъемом заболеваемости респираторной стрептококковой инфекцией (РСИ). Так, в результате индивидуальной 114
оценки динамики заболеваемости в ходе каждого рейса удалось установить четкую взаимосвязь между фактором выхода судна в рейс и внутрирейсовым подъемом заболеваемости. Независимо от времени года работы в том или ином полушарии она повышалась сразу после действия названного фактора. При этом одновременно в течение первого месяца рейса повышались уровни заболеваемости и ОРЗ и ангиной, реже - только ОРЗ, или только ангиной.
Детализируя приведенные материалы, мы проанализировали заболеваемость РСИ по пятидневкам. Оказалось, что практически во всех случаях (за редким исключением) рост числа заболевших в первую пятидневку начинался с ОРЗ, предшествуя аналогичной динамике заболеваний ангиной. При выходе в море первоначально заболевали новые члены экипажа или пассажиры (рис. 4.2, табл. 4.1).
Следующим, достаточно выраженным фактором, действие которого мы наблюдали - «3-4-й месяц пребывания экипажа в плавании». Увеличение заболеваемости членов судового коллектива в эти сроки наблюдались и в случае полной изоляции моряков (рис. 4.3, 4). Динамика заболеваемости по пятидневкам была при этом менее эксплозивной, сохраняя однако отмеченную выше последовательность возникновения манифестных форм ОРЗ и ангины.
В литературе активно высказывается мысль о том, что вирусные инфекции следует отнести к болезням адаптации, и именно они, при изменениях иммунного статуса человека активизируются в первую очередь [19, 23, 24]. Так, C. Andrewes [25] считает, что экология вирусов характеризуется двумя противоположными, но взаимосвязанными тенденциями: склонностью вирусов вызывать латентные инфекции и способностью переходить в активное вирулентное состояние, вызывая эпидемии и эпизоотии. При изолированном действии только первой тенденции она превратилась бы из механизма поддержания и сохранения вируса в биологический тупик, грозящий гибелью данного паразитического вида, так как у него не было бы иной возможности пассироваться кроме вертикальной передачи от одного биологического хозяина к другому. Переход же вируса в вирулентную форму создает условия для широкого его распространения в неиммунных популяциях [26]
Как было нами показано [7], при выходе в рейс сначала активизируются респираторные вирусы, способствуя последующему повышению вирулентности бета-гемолитических стрептококков,
активизации механизма передачи [27] и выходу эпидемического процесса РСИ из фазы резервации. Эти данные в последующем легли в основу разработанной нами концепции интеграционноконкурентного развития ЭП [28], способной, как мы полагаем, объяснить механизм возникновения спонтанного подъема заболеваемости населения, например парентеральными вирусными гепатитами [29]. Поскольку эти нозоформы относятся к убикви- тарным инфекциям, то запуск, а точнее, активизация ЭП, как правило, не предполагает их заноса. В предэпидемический период среди населения региона всегда имеется определенный резервуар потенциальных источников инфекции, в основном носителей вирусов гепатита В (ГВ) и С (ГС). Первоначально, как мы полагаем, у отдельных лиц происходит трансформация носительства в манифестную форму инфекции. Возможность и механизм такой трансформации при парентеральных вирусных гепатитах показаны в работе Н.А. Гавришевой с соавт. [5]. Если в окружении лиц с указанной формой инфекции есть восприимчивые люди, происходит рост манифестных форм, которые и диагностируются клиницистами. При этом активизация ГВ и ГС, видимо, происходит в результате реализации интеграционных механизмов, способствующих, например, размножению одного ассоцианта в присутствии другого при сочетанной инфекции [30]. Впрочем, сама по себе активизация вирусов не способна вызвать интенсификацию ЭП. Последнее возможно, если есть условия, способствующие их распространению. Применительно к парентеральным вирусным гепатитам к таковым прежде всего следует отнести распространенность наркомании среди населения и активность полового пути передачи, обусловленного чрезмерной либерализацией сексуальных отношений в современный период [29].
Вместе с тем вполне резонен вопрос: универсален ли механизм развития эпидемического процесса, представленный выше? Судя по имеющимся материалам, он вероятен для таких инфекций, как грипп и ОРЗ, парентеральные вирусные гепатиты, стрептококковые инфекции, корь, туберкулез, а также заболеваний, вызываемых условно-патогенными микроорганизмами [3, 7, 24, 29, 31-34]. А.А. Сохин все вирусные инфекции относит к болезням адаптации, акцентируя при этом внимание на возможности спонтанно- 118
го возникновения заболеваний на свободных территориях [19]. К названной группе примыкают и интеграционные вирусы [3]. При участии переносчиков вышеуказанный механизм развития эпидемического процесса вероятен для болезни Брилла - Цинссера [35]. Применительно к гриппу, например, В.Д. Беляков с соавт. [3] в механизме персистенции вируса гриппа А выделяет следующие фазы: 1) переход к персистенции; 2) стабилизация персистенции; 3) прогрессирующее совершенствование способности к продуктивной инфекции (выход из персистенции). Окончательный выход происходит при активации пассажа вируса на не иммунном коллективе. Такое развитие событий предполагает возможность независимого формирования очагов гриппа с новой антигенной разновидностью.
Таким образом, все вышеизложенное свидетельствует о значимости развития ЭП вследствие появления клинически выраженных форм инфекции в результате трансформации носительства в манифестную форму под воздействием факторов риска, влияющих на состояние естественной резистентности и иммунологической реактивности организма.
- занос возбудителя в восприимчивый коллектив (теория механизма передачи);
- интродукция в сложившийся иммунный коллектив людей, восприимчивых к циркулирующим в нем вариантам возбудителя (теория саморегуляции паразитарных систем);
- занос резервационных, эпидемических или в стадии эпидемического преобразования вариантов возбудителей в восприимчивый коллектив (теория саморегуляции паразитарных систем).
В последние годы в периодической литературе активно обсуждается и еще один относительно «новый» механизм развития ЭП, обусловленный активизацией репликации персистирующих микроорганизмов [5-7]. На его реализацию мы и хотели бы обратить особое внимание, поскольку этот механизм развития ЭП ни учеными-эпидемиологами, ни тем более практическими врачами, пока особо во внимание не принимается.
Понимание данного механизма развития ЭП тесно увязано в первую очередь с иммунологическими исследованиями. При этом следует признать, что интеграция исследований по изучению ЭП в современный период более ощутима между эпидемиологами и микробиологами, нежели эпидемиологами и иммунологами. Между тем, в разработанной нами классификации факторов риска состоянию естественной резистентности организма отводится существенная роль в качестве одного из пусковых механизмов развития ЭП [8]. В частности, проводимые нами исследования в области морской эпидемиологии по изучению иммунного статуса организма моряков в ходе длительного рейса показали, что практически любой выход в море сопровождается выраженными его изменениями [9]. Они неоднозначны и зависят от длительности и интенсивности воздействия «фактора моря» на организм моряка и его адаптивных возможностей. Поэтому, как мы полагаем, ЭП, развивающийся в условиях практически полностью замкнутого коллектива, может служить моделью для оценки обсуждаемого механизма.
Как известно, снижение общей резистентности организма людей к возбудителям инфекционных болезней ведет к росту манифестных форм и реализуется в трех основных направлениях. Прежде всего, уменьшается минимальная инфицирующая доза микроорганизмов и, следовательно, повышается риск заболевания. Далее увеличивается число случаев с тяжелым клиническим течением, и, наконец, может произойти активизация персистиру- ющих форм инфекций с переходом в манифестную. Если первые два из вышеперечисленных последствий общепризнанны и не требуют, по-нашему мнению, дополнительных разъяснений, то последний необходимо охарактеризовать более детально в связи с чрезвычайной значимостью его реализации, особенно в экстремальных ситуациях [10, 11].
Так, с позиций системного подхода, проявления эпидемического процесса на организменном уровне можно представить следующей схемой (рис. 4.1).
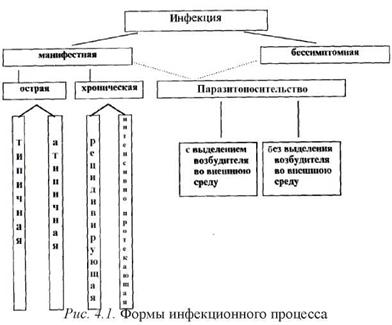 |
В ее основе - схема В.Д. Белякова [12] «Формы инфекционного процесса». Мы внесли в нее некоторые коррективы, учитывая развитие теоретических основ учения об эпидемическом процессе в современный период. Принципиально в этом плане положение о разделении понятий «бессимптомная форма инфекции» и «носи- тельство», которые в литературе часто объединяют в единое понятие - «носительство». Против этого в свое время возражал еще И.Р. Дробинский [13]. Хотя мы и не можем не согласиться с точкой зрения о все большей размытости границ между латентными, хроническими инфекциями и носительством [14]. Тем не менее любые попытки обобщений требуют определенной формализации. В схеме В.Д. Белякова, например, не учитывается, что при одномоментном заражении группы людей эпидемический процесс может быть представлен одновременно и манифестными, и бессимптомными формами инфекции. В последующем обе могут закончиться или полным освобождением от возбудителя, или носительством, 112
т.е. «... своеобразной формой сосуществования (симбиоз) патогенных микробов и организма хозяина, не проявляющейся в течение длительного времени, а в отдельных случаях - пожизненно, внешними реакциями со стороны организма» [15]. В последнее время термины «носительство» и «персистенция» часто отождествляют. Причем последний ранее использовали, говоря о вирусах, а в настоящее время распространили его на бактерии и прочие микроорганизмы [16, 17]. Учитывая имеющиеся сведения о носительст- ве различных видов микроорганизмов, мы ввели в схему понятие «носительство без выделения возбудителя во внешнюю среду».
Наше обращение к указанной схеме, объясняется тем, что в эпидемиологической литературе все чаще пишут об универсальности явления носительства, по крайней мере, для большинства инфекций [3, 18, 19]. Более того, это положение стало одним из постулатов теории саморегуляции паразитарных систем [3]. По мнению авторов теории, именно носительство как форма инфекционного процесса преобладает в фазе резервации процесса эпидемического и обеспечивает сохранение возбудителя в межэпидемический период, тем самым подчеркивается нестабильность состояния носительства и возможность его трансформации в манифестную форму. Однако механизмы такого превращения недостаточно изучены. Пожалуй, наиболее обстоятельно варианты перехода персистентной бессимптомной инфекции в клинически выраженную, представлены в работе А.А. Обгольц [16]. Вместе с тем, необходимо учитывать и поликлональность персистирующей в организме хозяина микропопуляции [20]. В ходе клинико-иммунологических исследований установлено, что иммунная система играет ведущую роль в отборе тех или иных клонов. Тем самым снижение естественной резистентности и иммунологической реактивности организма способно привести к отбору наиболее вирулентных клонов. Общеизвестно, что последние удается выделить именно в разгар инфекционного процесса. Носители и лица с бессимптомной формой инфекции индуцируют в коллективе преимущественно аналогичные состояния. Для появления в коллективе манифестных форм как следствие формирования эпидемического варианта требуется определенный временной промежуток [3]. Однако для перехода персистирующей формы инфекции (носи-
113
тельство) в манифестную с появлением эпидемического варианта нет необходимости в длительной циркуляции гетерогенного по вирулентности инфекционного агента в неиммунном коллективе. Поэтому возникновение заболевания возможно сразу вслед за действием какого-либо фактора, приводящего к дисбалансу в иммунной системе (например, выход судового экипажа в рейс).
Для дальнейшего развития эпидемического процесса возможны несколько сценариев. Первый, когда манифестирование происходит в полностью иммунном к данному инфекту коллективу, а эпидемический процесс проявляется спорадическим уровнем заболеваемости. Второй: в коллективе есть неиммунные индивидуумы либо лица, генетически более восприимчивые к данному инфекционному агенту, в таких случаях возможна экспрессия манифестных форм (эпидемическая вспышка). Подобная ситуация складывается и когда на иммунный в целом коллектив действуют экстремальные факторы, снижающие степень его восприимчивости (например, ионизирующее излучение [11]).
Проиллюстрируем представленный механизм развития ЭП на примере развития ЭП стрептококковой инфекции в период длительного рейса в относительно изолированном судовом коллективе. Как свидетельствуют наши исследования и данные других авторов [9, 21] наибольшие изменения иммунного статуса моряков приходятся на период выхода судна в море в первый месяц рейса, а также - 3-й и 4-й месяцы. Именно в это время в рейсе в основном формируются соответствующие уровни заболеваемости моряков респираторной стрептококковой инфекцией (ОРЗ, ангина) [22]. Как показывают наши исследования [7], активизация ЭП в этот период возможна вследствие преодоления скрытого до данного момента состояния носительства, в основном у «часто болеющих» членов экипажа и перехода его в манифестную форму. Как известно, от больных людей выделяются более вирулентные штаммы стрептококка, нежели от носителей . Поскольку уровень популяционного иммунитета к стрептококковой инфекции в этот период у экипажа низкий [7], а в условиях судна контакты между членами экипажа, естественно, очень тесные, то это проявляется внутрирейсовым подъемом заболеваемости респираторной стрептококковой инфекцией (РСИ). Так, в результате индивидуальной 114
оценки динамики заболеваемости в ходе каждого рейса удалось установить четкую взаимосвязь между фактором выхода судна в рейс и внутрирейсовым подъемом заболеваемости. Независимо от времени года работы в том или ином полушарии она повышалась сразу после действия названного фактора. При этом одновременно в течение первого месяца рейса повышались уровни заболеваемости и ОРЗ и ангиной, реже - только ОРЗ, или только ангиной.
Детализируя приведенные материалы, мы проанализировали заболеваемость РСИ по пятидневкам. Оказалось, что практически во всех случаях (за редким исключением) рост числа заболевших в первую пятидневку начинался с ОРЗ, предшествуя аналогичной динамике заболеваний ангиной. При выходе в море первоначально заболевали новые члены экипажа или пассажиры (рис. 4.2, табл. 4.1).
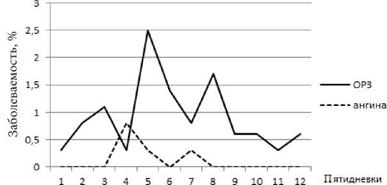
Рис. 4.2. Динамика заболеваемости по пятидневкам ОРЗ и ангинами на плавбазе «Е. Никишин» при выходе судна в рейс |
Следующим, достаточно выраженным фактором, действие которого мы наблюдали - «3-4-й месяц пребывания экипажа в плавании». Увеличение заболеваемости членов судового коллектива в эти сроки наблюдались и в случае полной изоляции моряков (рис. 4.3, 4). Динамика заболеваемости по пятидневкам была при этом менее эксплозивной, сохраняя однако отмеченную выше последовательность возникновения манифестных форм ОРЗ и ангины.
| Таблица 4.1
Динамика заболеваемости ОРЗ и ангиной туристов и членов экипажа в ходе круиза на т/х «Русь» (с 28.12.88 по 13.01.89 г)
*- члены экипажа |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
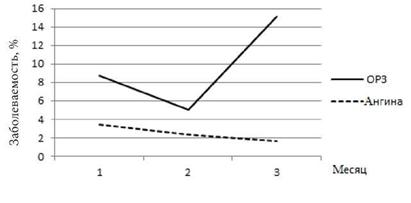
Рис. 4.2. Внутрирейсовая динамика заболеваемости на плавбазе «Славянск» в рейсе 1989 г. |
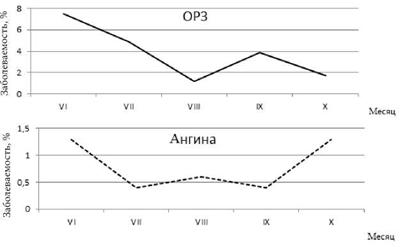
Рис. 4.4. Внутрирейсовая динамика заболеваемости на плавбазе «Е. Никишин» в рейсе 1990 г. |
В литературе активно высказывается мысль о том, что вирусные инфекции следует отнести к болезням адаптации, и именно они, при изменениях иммунного статуса человека активизируются в первую очередь [19, 23, 24]. Так, C. Andrewes [25] считает, что экология вирусов характеризуется двумя противоположными, но взаимосвязанными тенденциями: склонностью вирусов вызывать латентные инфекции и способностью переходить в активное вирулентное состояние, вызывая эпидемии и эпизоотии. При изолированном действии только первой тенденции она превратилась бы из механизма поддержания и сохранения вируса в биологический тупик, грозящий гибелью данного паразитического вида, так как у него не было бы иной возможности пассироваться кроме вертикальной передачи от одного биологического хозяина к другому. Переход же вируса в вирулентную форму создает условия для широкого его распространения в неиммунных популяциях [26]
Как было нами показано [7], при выходе в рейс сначала активизируются респираторные вирусы, способствуя последующему повышению вирулентности бета-гемолитических стрептококков,
активизации механизма передачи [27] и выходу эпидемического процесса РСИ из фазы резервации. Эти данные в последующем легли в основу разработанной нами концепции интеграционноконкурентного развития ЭП [28], способной, как мы полагаем, объяснить механизм возникновения спонтанного подъема заболеваемости населения, например парентеральными вирусными гепатитами [29]. Поскольку эти нозоформы относятся к убикви- тарным инфекциям, то запуск, а точнее, активизация ЭП, как правило, не предполагает их заноса. В предэпидемический период среди населения региона всегда имеется определенный резервуар потенциальных источников инфекции, в основном носителей вирусов гепатита В (ГВ) и С (ГС). Первоначально, как мы полагаем, у отдельных лиц происходит трансформация носительства в манифестную форму инфекции. Возможность и механизм такой трансформации при парентеральных вирусных гепатитах показаны в работе Н.А. Гавришевой с соавт. [5]. Если в окружении лиц с указанной формой инфекции есть восприимчивые люди, происходит рост манифестных форм, которые и диагностируются клиницистами. При этом активизация ГВ и ГС, видимо, происходит в результате реализации интеграционных механизмов, способствующих, например, размножению одного ассоцианта в присутствии другого при сочетанной инфекции [30]. Впрочем, сама по себе активизация вирусов не способна вызвать интенсификацию ЭП. Последнее возможно, если есть условия, способствующие их распространению. Применительно к парентеральным вирусным гепатитам к таковым прежде всего следует отнести распространенность наркомании среди населения и активность полового пути передачи, обусловленного чрезмерной либерализацией сексуальных отношений в современный период [29].
Вместе с тем вполне резонен вопрос: универсален ли механизм развития эпидемического процесса, представленный выше? Судя по имеющимся материалам, он вероятен для таких инфекций, как грипп и ОРЗ, парентеральные вирусные гепатиты, стрептококковые инфекции, корь, туберкулез, а также заболеваний, вызываемых условно-патогенными микроорганизмами [3, 7, 24, 29, 31-34]. А.А. Сохин все вирусные инфекции относит к болезням адаптации, акцентируя при этом внимание на возможности спонтанно- 118
го возникновения заболеваний на свободных территориях [19]. К названной группе примыкают и интеграционные вирусы [3]. При участии переносчиков вышеуказанный механизм развития эпидемического процесса вероятен для болезни Брилла - Цинссера [35]. Применительно к гриппу, например, В.Д. Беляков с соавт. [3] в механизме персистенции вируса гриппа А выделяет следующие фазы: 1) переход к персистенции; 2) стабилизация персистенции; 3) прогрессирующее совершенствование способности к продуктивной инфекции (выход из персистенции). Окончательный выход происходит при активации пассажа вируса на не иммунном коллективе. Такое развитие событий предполагает возможность независимого формирования очагов гриппа с новой антигенной разновидностью.
Таким образом, все вышеизложенное свидетельствует о значимости развития ЭП вследствие появления клинически выраженных форм инфекции в результате трансформации носительства в манифестную форму под воздействием факторов риска, влияющих на состояние естественной резистентности и иммунологической реактивности организма.
Источник: А.А. Яковлев, Е.Д. Савилов, «ПРОБЛЕМНЫЕ ВОПРОСЫ ОБЩЕЙ ЭПИДЕМИОЛОГИИ» 2015
А так же в разделе «ГЛАВА 4 О ВОЗМОЖНЫХ МЕХАНИЗМАХ РАЗВИТИЯ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА »
- ПРЕДИСЛОВИЕ
- ОТ АВТОРОВ
- ГЛАВА 1 ОБ ОПРЕДЕЛЕНИИ ЭПИДЕМИОЛОГИИ КАК НАУКИ И ПОНЯТИИ О ЕЕ ПРЕДМЕТЕ И ОБЪЕКТЕ
- Библиографический список
- ГЛАВА 2 СОВРЕМЕННЫЕ НАПРАВЛЕНИЯ В ЭПИДЕМИОЛОГИИ
- Эпидемиология хронических инфекций.
- Эпидемиология медленных инфекций.
- Эпидемиология сапронозов.
- Эпидемиология катастроф.
- Географическая (энвайроментальная) эпидемиология.
- Госпитальная эпидемиология.
- Эпидемиология неинфекционных болезней.
- 2.1. Молекулярная эпидемиология (на модели Mycobacterium tuberculosis)
- 2.1. Морская эпидемиология (история становления и основные направления развития)
- 2.1. Экологическая эпидемиология
- 2.4. Интеграционная эпидемиология
- Библиографический список
- ГЛАВА 3 О ПРИЧИНЕ, УСЛОВИЯХ И МЕХАНИЗМАХ ФОРМИРОВАНИЯ ЗАБОЛЕВАЕМОСТИ
- Классификация факторов риска эпидемического процесса
- Библиографический список
- Библиографический список
- ГЛАВА 5 О ВОЗМОЖНЫХ МЕХАНИЗМАХ ФОРМИРОВАНИЯ ЦИКЛИЧНОСТИ И СЕЗОННОСТИ В ЭПИДЕМИЧЕСКОМ ПРОЦЕССЕ
- Библиографический список
- ГЛАВА 6 ГЕТЕРОГЕННОСТЬ ПОПУЛЯЦИИ ВОЗБУДИТЕЛЯ И ХОЗЯИНА КАК ОСНОВА ТЕОРЕТИЧЕСКИХ ВОЗЗРЕНИЙ АКАДЕМИКА В.Д. БЕЛЯКОВА НА РАЗВИТИЕ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
- Библиографический список
- ГЛАВА 7 СИСТЕМНЫЙ ПОДХОД К ЭПИДЕМИОЛОГИЧЕСКОЙ ОЦЕНКЕ РОЛИ СОЧЕТАННЫХ ИНФЕКЦИЙ В РАЗВИТИИ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА (НА МОДЕЛИ ВИРУСНЫХ ГЕПАТИТОВ)
- Библиографический список
- ГЛАВА 8 ЭВОЛЮЦИЯ ИДЕЙ АКАДЕМИКА В.Д. БЕЛЯКОВА О САМОРЕГУЛЯЦИИ ПАРАЗИТАРНЫХ СИСТЕМ В КОНЦЕПЦИИ ИНТЕГРАЦИОННО-КОНКУРЕНТНОГО РАЗВИТИЯ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
- Библиографический список
- ГЛАВА 9 ИНТЕГРАЦИОННЫЙ ПОДХОД К ЭПИДЕМИОЛОГИЧЕСКОЙ ОЦЕНКЕ НЕКОТОРЫХ НАПРАВЛЕНИЙ ПРОФИЛАКТИКИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
- Библиографический список
- ГЛАВА 10 ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ ЭПИДЕМИОЛОГИЧЕСКОЙ ОЦЕНКИ ПАНДЕМИИ ГРИППА А(H1N1)pdm09 2009-2010 гг.
- Библиографический список
- ГЛАВА 11 ГЛОБАЛЬНЫЙ ЭПИДЕМИОЛОГИЧЕСКИЙ НАДЗОР КАК ОТВЕТ НА ГЛОБАЛИЗАЦИЮ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
- Библиографический список
- ЗАКЛЮЧЕНИЕ
- Библиографический список