ГЛАВА 6 ГЕТЕРОГЕННОСТЬ ПОПУЛЯЦИИ ВОЗБУДИТЕЛЯ И ХОЗЯИНА КАК ОСНОВА ТЕОРЕТИЧЕСКИХ ВОЗЗРЕНИЙ АКАДЕМИКА В.Д. БЕЛЯКОВА НА РАЗВИТИЕ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
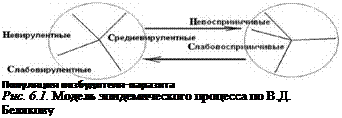
В современный период наиболее емким определением эпидемического процесса, равно справедливым для антропонозов, зоонозов и сапронозов, признано следующее « ... процесс взаимодействия возбудителя - паразита и организма хозяина на популяционном уровне, проявляющийся при определенных социальных и природных условиях единичными и (или) множественными заболеваниями, а также бессимптомными формами инфекций» Г1, 21 (рис. 6.1).
Популяция
хозяина
Высоковирулеитные Высоковосприинчивы*
Средневос приимчнвые
Биологическая основа ЭП - паразитарная система - является результатом сопряженной эволюции и паразита, и хозяина. В своей теории саморегуляции паразитарных систем [3] В.Д. Беляков вскрывает конкретные механизмы - факторы, определяющие популяционную динамику возбудителей - их численность, гетерогенность и изменчивость, а также фазность этих популяционных изменений микроорганизмов в процессе функционирования паразитарной системы. В основу теории положен ряд постулатов, важнейший из которых - генотипическая и фенотипическая гетероген- 134
ность популяций паразита и хозяина по признакам их взаимодействия, являющаяся основной причиной их постоянной изменчивости. Этим подчеркивается тот факт, что главной особенностью природных популяций всех видов живых организмов является их генетически обусловленная гетерогенность. Благодаря этому популяция приобретает необходимую пластичность приспособления к неоднородной и постоянно изменяющейся во времени среде обитания. Следует заметить, что гетерогенность популяции человека во многом сформировалась под влиянием мира микроорганизмов в результате естественного отбора [4]. Вследствие сопряженной эволюции наш организм изначально настроен на возможность защиты от всех потенциальных патогенов. Однако эта адаптация в различных экологических, климатических и социальных условиях развивалась различно, вследствие чего существует широкий диапазон вариаций факторов естественного иммунитета у групп населения и отдельных индивидуумов.
Важнейшими характеристиками гетерогенности взаимодействующих популяций, по В.Д. Белякову, являются вирулентность для микроорганизма и восприимчивость для популяции хозяина. Изменения в составе популяции возбудителя наблюдаются как в ходе инфекционного процесса - высокая вирулентность возбудителя в начале заболевания и его разгаре и снижение ее к концу, так и в эпидемическом процессе - повышенная вирулентность в начале эпидемии и сниженная при ее угасании. При этом распределение в популяции как разных по вирулентности штаммов одного вида, так и разных по восприимчивости людей можно описать кривой нормального распределения Гаусса (рис. 6.2), т.е. больше всего средневирулентных штаммов и средневосприимчивых людей, штаммов более или менее вирулентных, так же как и более и менее восприимчивых лиц, - значительно меньше.
Поскольку различия населения разных регионов по распределению восприимчивых и невосприимчивых несомненно влияют на развитие ЭП, мы считаем более уместным пользоваться термином «степень восприимчивости популяции» - соотношение в ней лиц восприимчивых и невосприимчивых к определенной инфекции (рис. 6.3), которое, по нашему мнению, более корректно, чем
применяемый термин «популяционный иммунитет», отражающий только долю индивидуумов с наличием специфических антител.
Понятие «невосприимчивость» имеет более широкое, чем иммунитет, значение, поскольку включает в себя и лиц с генетически обусловленной невосприимчивостью к определенной инфекции. К сожалению, целенаправленных исследований по изучению
структуры популяции человека в таком аспекте мы не встречали. Но, судя по разным источникам, лиц с генетически обусловленной невосприимчивостью к определенной инфекции, примерно 3-5 % [1, 5]. Необходимо подчеркнуть, что и среди когорты восприимчивых тоже есть лица с генетически обусловленной более или менее высокой восприимчивостью. Так, лица с группой крови A(II) более восприимчивы к натуральной оспе, а с O(I) - к чуме
[6] . Обнаружена положительная ассоциациативная связь между высоким уровнем иммунитета к дифтерии и группой крови B(III)
[7] . Нами установлено, что пациенты с группой более B(III) восприимчивы к токсоплазмозу [8], причем доля таковых в общей структуре восприимчивых не может превышать 3-5 %. Поскольку в природе все находится в определенном равновесии, то для сохранения стабильности популяции соотношение высоковосприимчивых и невосприимчивых тоже должно быть примерно равным [9]. Подробнее о механизмах генетической устойчивости (восприимчивости) к возбудителям инфекционных болезней см. в работах Э.П. Эфроимсона [10], Frodsham Angela J., Hill Adrian V.S. [11], D. Kumar, D Weatheral [12].
Следует заметить, что по мнению В.Д. Белякова [13], в генофонде популяции людей заложено распределение генотипов со специфической предрасположенностью к отдельным нозологиям. В частности, занимаясь проблемой сочетанных вирусных гепатитов в Приморском крае, мы обратили внимание на тот факт, что на их долю от всех зарегистрированных приходится порядка 10 % [14]. Позднее в публикации К.А. Павроз с соавт. [15] из Перми, обнаружили, что и по их материалам доля микст-форм гепатитов В и С тоже составляет примерно 10 %. Близкие данные получены Г.Е. Ефимовым из Башкирии [16]. В пределах 10 % колеблется, например, и доля сочетанных форм ВИЧ-инфекции и туберкулеза, выявленных в Санкт-Петербурге и во Вьетнаме [17]. Вряд ли такие совпадения могут быть случайными. Следовательно, можно полагать, что риск формирования сочетанных инфекций - генетически детерминирован.
Результатом взаимодействия микроорганизмов с популяцией человека и является возникновение тех или иных форм инфекционного процесса (см. гл. 4). Их формирование зависит от ви-
137
рулентности возбудителя, дозы и восприимчивости организма на момент заражения. Спектр инфекционных состояний в популяции человека от клинически выраженных до носительства - это и есть паразитарная система. В этой связи необходимо подчеркнуть, что носительство - неотъемлемый элемент, характеризующий развитие скрыто протекающего ЭП и обеспечивающий сохранение популяции паразита в межэпидемический период.
Гетерогенность популяции микроорганизмов формировалась как ответ на различные неблагоприятные вызовы внешней среды. В частности, наши исследования в области морской эпидемиологии [18] показали, что когда нет таких воздействий извне, гетерогенность популяции существенно уменьшается.
Правомочность такого суждения, в частности, нами обоснована по итогам изучения чувствительности выделенных культур Escherichia coli к ряду антибиотиков членов экипажа в ходе длительного (семимесячного) рейса на плавбазе «Е. Лебедев». Вполне понятно, что широко антибиотики для лечения там не применялись, да и их спектр был ограничен. К тому же в море на судне практически отсутствуют конкурентные микроорганизмы. Как оказалось, устойчивость эшерихий варьировала по ходу рейса (табл. 6.1).
Так, до выхода судна в море (1-й этап исследования) мы выявили резистентность к 10 и более антибиотикам (а/б) у 66±5,3 % выделенных культур, к 9-5 - у 33, 4±5,3 % и менее 5 - у 0, 6 ±0,7 % штаммов.
На втором этапе (первый месяц рейса) число культур нечувствительных к 10 и более а/б уменьшилось до 43,3±8,5 %, а к 9-5 - увеличилось до 46,7±8,5 %. Через 6 мес. плавания к 10 и более а/б осталось устойчивыми не более 40±8,1 %, а к 9-5 - уже 60±8,1 % (р < 0,05). Устойчивых к менее 5 а/б культур E.coli на 2-м и 3-м этапах рейса не выделено.
Таким образом, от этапа к этапу рейса судовая популяция
Е. coli приобретала все большую однородность по отношению к устойчивости к а/б. Причем прежде всего утрачивались крайние ее варианты (т.е. как наиболее, так и наименее устойчивые к а/б).
Дифференцированная оценка изменений отношения выделенных культур Е. coli к некоторым а/б, из числа использованных в эксперименте, позволила выявить три тенденции: формирование более выраженной устойчивости; повышение чувствительности и стабильность сложившихся взаимоотношений. В частности, увеличение чувствительности отмечено к таким антибиотикам, как стрептомицин, левомицетин, пенициллин, полимиксин, канами- цин и гентомицин (р < 0,05). Вместе с тем к ампициллину, карбе- нициллину и рифампицину она даже уменьшилась, к другим - существенно не изменилась.
Особого внимания, на наш взгляд, требует факт появления штаммов, чувствительных к пенициллину и стрептомицину. И тот, и другой антибиотик начали применяться в практической медицине одними из первых. Поэтому и устойчивые варианты к ним стали формироваться раньше, чем к другим антибиотикам. Наши наблюдения свидетельствуют о том, что в гетерогенной популяции Е. coli, а вероятно, и других представителей энтеробактерий, сохраняются клоновые линии, способные к быстрому восстановлению чувствительности к этим и другим антибиотикам при создании соответствующих условий. Это показывает, насколько популяция микроорганизмов пластична и «запаслива». У нее есть варианты на все случаи жизни. Особенно важно, как нам кажется, об этом помнить сейчас, когда и у нас, и за рубежом все чаще пишут «о закате эры антибиотиков».
Аналогичные результаты показали и наши наблюдения по изучению чувствительности культур эшерихий к дезинфектанту (хлорамину) (табл. 6.2). Следует заметить, что на плавбазе в соответствии с «Методическими указаниями для судовых медицинских работников по дезинфекции на морских судах во время рейсов» постоянно применяют для профилактической дезинфекции 0,3-0,5 %-е растворы хлорсодержащих препаратов (хлорная известь, хлорамин). Как показали результаты наблюдений, до выхода судна в рейс среди выделенных культур эшерихий встречались такие (1,96 %), которые не реагировали даже на 1 %-й раствор хлорамина, 3,8 % культур давали 50 %-й рост колоний. 11,1 % оказались практически не чувствительными к действию 0,3 %-го
раствора хлорамина. Напротив, уже к 0,1 %-му раствору оказались чувствительными 5,8 % выделенных культур.
Таблица 6.2
Динамика чувствительности к дезинфектантам (хлорамину) судовой популяции Е.соИ, выделенных на разных этапах промыслового рейса
Однако от этапа к этапу рейса популяция Е. coli по признаку чувствительности к используемым в эксперименте растворам хлорамина, становилась более однородной. В частности, на вто-
141
ром этапе штаммы, резистентные к 1 %-му раствору, уже не были зарегистрированы. Значительно сократилось число культур, чувствительных к 0,1 %-му раствору хлорамина. На третьем эта - пе рейса вся судовая популяция Е. coli была чувствительной к 0,5 %-му раствору и сократилась доля культур, устойчивых к 0,3 %-му раствору (р <0,05). Следовательно, как и по отношению к признаку устойчивости к а/б, первоначально утрачивались крайние варианты популяции эшерихий по чувствительности к хлорамину. Важно подчеркнуть, что реакция судовой популяции эшерихий на действие внешних факторов (применение антибиотиков в судовом коллективе, проведение дезинфекционных мероприятий) не носила характера прямого приспособления к их влиянию, а была более сложной. В частности, могла повышаться устойчивость к антибиотикам, на судне не применявшимся, и снижалась резистентность к хлорамину, несмотря на его широкое использование. Это еще раз подчеркивает необходимость более глубокого изучения механизмов формирования устойчивости у микроорганизмов к антибактериальным препаратам, которая обусловлена не только как зачастую принято считать, широким и бесконтрольным применением антибиотиков населением.
Наряду с изучением фенотипических признаков судовой популяции Е. coli в ходе длительно рейса, нами проводилось и определение плазмидного профиля выделенных микроорганизмов, который, как известно, контролирует факторы чувствительности к антибиотикам и дезинфектантам.
Результаты исследования (табл. 6.3) выделенных на первом этапе рейса эшерихий продемонстрировали колоссальное разнообразие плазмид с разной молекулярной массой и плазмидных вариантов по их сочетанию у одного штамма кишечной палочки.
Только у двух штаммов Е. coli (2,5 %) оказался одинаковый набор плазмид. Все остальные варианты имели самый разнообразный их спектр, не совпадающий ни по их набору, ни по молекулярной массе. Важно подчеркнуть, что до выхода в море 19,6 % штаммов кишечной палочки были бесплазмидными. Одну-две плазмиды содержали 41,2 %, а три и более - 39,2 % выделенных культур (табл. 6.4).
Проведенное нами изучение плазмидного спектра эшерихий на втором этапе рейса показало отсутствие бесплазмидных штаммов при доминировании штаммов кишечной палочки, содержа-
143
щих 1-2 плазмиды (83,3 %). При этом увеличилось до 5 (14,7 %) количество штаммов, содержащих идентичный набор плазмид.
На третьем этапе рейса, напротив, основную массу составили штаммы, не имеющие плазмид, и значительно сократилось количество культур, содержащих 1-2 плазмиды. Впервые были зарегистрированы эшерихии, несущие только одну криптическую плазмиду.
Эти данные убеждают в том, что наличие плазмид более характерно для эшерихий, циркулирующих в береговых условиях. Именно здесь бактерии подвергаются мощному селективному действию химиопрепаратов и именно плазмиды способствуют их выживаемости. Об этом свидетельствуют и результаты обследования лиц, прибывших на плавбазу к концу рейса. Так, штаммы, с характерным разнообразием плазмидного профиля, отмеченного нами у членов экипажа до выхода в море, были получены и от четырех, прибывших на судно с берега уже к концу рейса, членов экипажа.
Заметим, что каждый новый этап обследования характеризовался появлением и новых плазмид как с высокой, так и с низкой молекулярной массой. Но независимо от молекулярной массы, наименьшее селективное преимущество в судовой популяции имели штаммы эшерихий с максимально большим набором плазмид.
Таким образом, проведенный анализ фено- и генотипических признаков судовой популяции Е. coli позволил выявить общую за - кономерность изменения их биологических свойств в ходе длительного рейса: от выраженной гетерогенности, отмеченной перед выходом судна в море, к максимальной однородности. Надо полагать, что это - приспособительный ответ популяции микро
организмов в пределах данного генотипа на изменения среды обитания, ибо «... любая популяция стремится сохранить состав, обеспечивающий среднюю приспособленность к той частной среде, в которой она обитает» [19]. Различия в действии факторов, присущих береговым условиям, и действующих в судовой среде, видимо, и привели к вышеуказанным фено- и генотипическим модификационным изменения в судовой популяции Е. coli.
Принимая во внимание, что выделенные нами штаммы кишечной палочки были непатогенны, тогда как одно из предназначений плазмид - контроль вирулентности [20], вполне закономерно возникал вопрос о причинах такого разнообразия у эшерихий плазмид с разной молекулярной массой. То обстоятельство, что у различных штаммов кишечной палочки нами зарегистрированы плазмиды, встречающиеся, например, у брюшного тифа и других сальмонелл, а также шигелл [21, 22], наводит на мысль, что
Е. coli вследствие постоянного пребывания в кишечнике человека как мы полагаем, способны играть роль своеобразного и реципиента, и донора плазмид. Возможно, патогенные микроорганизмы кишечной группы при переходе в фазу резервации отдают им плазмиды. При формировании эпидемических вариантов соответствующие возбудители получают плазмиды от эшерихий. Судя по имеющимся публикациям [23], подобная вероятность не исключена. При этом важно подчеркнуть, что коньюгативный обмен плазмидами происходит не только среди представителей одного семейства, но и между разными семействами и видами. Вполне вероятно, что подобные механизмы лежат и в основе формирования устойчивости к антибактериальным препаратам у различных видов микроорганизмов в формируемом ими биогеоценозе. Возможности для этого у эшерихий поистине безграничны, поскольку для популяции E.coli характерна убиквитарность, полигостальность, способность к сапрофитическому существованию, свидетельствующей об экологической пластичности этого вида, обеспечивающей его представителям возможность колонизировать различные экониши и вступать в симбиотические взаимодействия с широким кругом естественных хозяев [24].
Изучение гетерогенности микробных популяций в современный период идет весьма интенсивно и уже используется в системе
145
эпидемиологического надзора за различными инфекциями, чего не скажешь о гетерогенности популяции человека по восприимчивости. К сожалению, пока довольно редки исследования по выявлению возможного влияния генетических особенностей населения на распространенность инфекции. Тем не менее, например, у такой инфекции как ВИЧ выявлен ген устойчивости к ней. Среди европеоидов он, в частности, встречается в пределах 20 %. По- мнению В.П. Сергиева, это указывает на то обстоятельство, что ВИЧ - не новая инфекция, поскольку наличие к ней генетически устойчивых лиц - это, так называемые «генетические шрамы», которые появляются только вследствие длительных контактов населения с возбудителем. И это свидетельствует о том, что ВИЧ не пришла к нам из Африки, как принято считать, а видимо, наоборот [25].
Следовательно, наряду с генетическим мониторингом за популяцией возбудителей целесообразно вводить и мониторинг за генетической структурой населения региона в аспекте его восприимчивости к той или иной инфекции. Однако, по справедливому замечанию Мак Мана с соавт. [26], сделанного ими еще в 60-х годах, «... роль микробных агентов в инфекционной болезни считается преобладающей над ролью генетических факторов может быть отчасти потому, что гораздо легче контролировать водоснабжение и истреблять насекомых переносчиков, чем произвести отбор генетически резистентного населения» . К сожалению, воз, что называется, - и ныне там. Тогда как еще в 1941 г. С.М. Гершензон [27] подчеркивал, что гетерогенность популяций является мобилизационным резервом, обеспечивающим устойчивость паразитарной системы во времени, что необходимо учитывать при реализации различных противоэпидемических мероприятий.
В этом плане заметим, что Всемирная организация здравоохранения главным направлением профилактики вполне обоснованно считает вакцинопрофилактику. Однако при этом стратегия ее проведения, начиная со времен Эдварда Дженнера и Луи Пастера, т.е. 200 с лишним лет, практически не претерпела никаких изменений. В ее основе лежит представление о том, что возбудитель обладает однозначно высокой вирулентностью, а индивидуум - высоко восприимчив к определенному инфекту. Эта парадигма сложилась на заре вакцинопрофилактики, поскольку в ту пору ученые, ко- 146
нечно, не располагали современными методами, а соответственно и знаниями о том, насколько гетерогенна популяция микроорганизмов, в частности по вирулентности, а популяция человека - по степени восприимчивости к инфекту. В русле этой парадигмы и стремятся охватить прививками как можно больше населения и вакцинировать всех одинаковой дозой вакцины.
На основе глобальной иммунизации населения планеты ставится задача ликвидации отдельных инфекций. Однако в современный период появляется все больше работ [28-31], авторы которых высказывают обеспокоенность складывающейся ситуацией в отношении иммунопрофилактики. Главный лейтмотив этих публикаций: продолжая действовать таким же образом, мы в перспективе получим результат, аналогичный тому, что получили от широчайшего применения антибиотиков. Вследствие колоссальной изменчивости микроорганизмов и гетерогенности, под влиянием иммунологического пресса идет все большая дивергенция между дикими штаммами и вакцинными. Поэтому иммунный ответ на них уже не всегда обеспечивает защиту от заболевания. Так, в Государственном докладе Федеральной службы в сфере защиты прав потребителей и благополучия человека «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2013 г.» представлены материалы, свидетельствующие о том, что в популяции возбудителя коклюша доминируют штаммы с новыми «невакцинными» ptxAl и ptxC2 аллелями генов, кодирующие S1 и S3 субъединицы коклюшного токсина. В популяции возбудителя дифтерии стали превалировать штаммы с «невакцинными» генотипами (сиквенс-типами). Исследования британских ученых также показали, что возбудитель коклюша активно меняется, что может свидетельствовать об усилении защитных свойств микроба. Выявленные изменения они, в частности, связывают и с применением с 2004 г. новой бесклеточной вакцины против коклюша [32].
Имеются данные, что вакцинация БСЖ не защищает от актуальных генотипов семейства Beijing, а именно они сегодня быстро распространятся по планете (см. гл. 2.1). Выявлен генетический дрейф и дивергенция полевых штаммов краснухи. Массовая иммунизация против менингококка чревата быстрой селекцией
147
возбудителя другого серотипа или даже серогруппы. Подобные преценденты были. Так, в 70-80-х годах прошлого века после массовой иммунизации по эпидемическим показаниям населения вакциной А+С и резкого снижения заболеваемости, в ряде стран Южной Америки и на Кубе разразилась жестокая эпидемия генерализованных форм менингококковой инфекции, вызванная маловирулентным до этого менингококком серогруппы В. Аналогичная ситуация отмечена в 80-90-х годах в некоторых странах Африки. Широкие испытания тетравалентной вакцины А+С+W+Y уже в новом веке привели к селекции и выходу из резервации считавшегося ранее редким возбудителя серогруппы Х, вспышки которого часто сопровождались летальными исходами. А появление вакциноассоциированных штаммов вируса полиомиелита ставит под сомнение возможность ликвидации этого заболевания [33]. К тому же в 2010 г. в Республике Конго отмечена вспышка полиомиелита с необыкновенно высокой летальностью (до 47 %). Как оказалось, вирус полиомиелита приобрел совершенно необычную мутацию. Именно перед этой мутацией иммунитет привитых от полиомиелита оказался беспомощным [34]. Даже по отношению к натуральной оспе М.В. Супотницкий, в своей книге «Микроорганизмы, токсины и эпидемии» [35] высказывает некоторое сомнение, что именно глобальная вакцинация привела к ее ликвидации. Близкие суждения по этому поводу приводятся и в публикации А.Б. Белова и П.И. Огаркова [36].
В свете современных данных об эпидемической ситуации по кори как в мире, так и в России [37] не внушает оптимизма и реализация задачи по региональной ликвидации этой инфекции. Вообще, чем больше мы знаем о гетерогенности микроорганизмов, тем более непростой представляется проблема ликвидации инфекций в целом [38]. И думается, что возможности вакцинопрофилактики в плане влияния на развитие ЭП иногда преувеличиваются, поскольку очень часто исследователи, оценивая влияние иммунизации населения на динамику заболеваемости, допускают одну весьма распространенную методическую ошибку: «после того» (т.е. снижение заболеваемости после введения вакцинации) не значит «вследствие того» [39]. Так, проведенный нами сопряженный анализ заболеваемости ГВ и ГС населения Приморского 148 края позволил прийти к заключению, что снижение заболеваемости острым гепатитом В, возможно, не связано с вакцинопрофилактикой против этой инфекции, поскольку синхронно снижается и заболеваемость острым гепатитом С, в отношении которого вакцинопрофилактика не проводится [11]. Позднее к аналогичному выводу пришли и А.А. Асратян с соавт. [40] на основе анализа материалов по Москве. При этом следует заметить, что, по-мнению И.В. Фельдблюм [41] вакцинопрофилактика ГВ в нашей стране оказала влияние только на риск заболевания острыми формами ГВ и носительство, существенно не повлияв на риск формирования хронического гепатита.
В одном из обзорных докладов ВОЗ констатируется, например, что снижение заболеваемости дифтерией наблюдалось еще до начала массовой вакцинации [42]. Исследованиями А.Я. Миндлиной [43] установлено, что заболеваемость краснухой, коклюшем и дифтерией начала снижаться раньше достижения полноценного охвата прививками. При этом время начала снижения заболеваемости этими инфекциями практически совпало со временем начала снижения заболеваемости антропонозами с фекально-оральным механизмом передачи. Это, по мнению автора, свидетельствует о наличии общих факторов, влияющих на проявления заболеваемости антропонозными инфекциями, независимо от степени управляемости.
В этой связи заметим, что основная вакцинальная нагрузка в соответствии с Национальным календарем прививок приходится на детский возраст. Однако зачастую заболеваемость сдвигается на старшие возрастные группы. Это явление прослеживалось, начиная с вакцинации против натуральной оспы. Позднее, такая же ситуация наблюдалась в отношении иммунизации против кори, дифтерии, краснухи коклюша [44, 45]. По-видимому, подобная перспектива ожидает и вакцинацию против ГВ [46]. Как показывает многолетний опыт вакцинопрофилактики, начиная вакцинацию в детском возрасте, в последующем приходится вводить ревакцинацию [45]. Хотя первоначально, как правило, утверждается, что иммунитет от вводимой вакцины чуть ли не пожизненный, и ревакцинация не потребуется. Все это в конечном итоге ведет к перегруженности календаря прививок [36]. К тому же, нельзя не
149
согласиться с Б.Л. Черкасским [47], что инъекционная нагрузка на детский организм в связи с вакцинацией итак очень высока: ребенок до 1 года получает 10 инъекций. Поэтому введение в последние годы в Национальный календарь прививок новых вакцин (против гемофильной инфекции, пневмококковой), на наш взгляд, усиливает и без того активно формирующееся у населения негативное отношение к прививкам. К тому же, заметим, доля отказавшихся от вакцинации растет не только в нашей стране, но и в развитых государствах Европы и в США [48]. Как мы полагаем, целесообразнее вначале апробировать отечественные ассоциированные вакцины, а потом уже вводить новые в календарь прививок и, конечно, заменять инъекционные методы иммунизации альтернативными - аэрозольным, оральным, транскожным и др. [49]. Но, к сожалению, как говорится, «телега ставится впереди лошади». И еще одно важное замечание. В директивных документах по профилактике гриппа, например, указывается не необходимость вакцинации в первую очередь пожилых людей, у которых возможны неблагоприятные исходы заболевания. Но при этом немало работ, свидетельствующих о том, что иммунный ответ на вакцинацию лиц старше 60 вакциной против гриппа зачастую слабо выражен (кстати, как и в отношении вакцинаций против других инфекций), т.е. эффективность такой защиты невысока [50-52]. Ну и, наконец, нельзя не отметить, что расширение спектра прививок приводит к изменению структуры наиболее значимых инфекций. В 60-70-х годах, к примеру, при введении вакцинации против кори, коклюша, дифтерии, сложно было даже представить, что в современный период значительно возрастет эпидемиологическая значимость ветряной оспы [53], которую в те годы относили к «малым» детским инфекциям, или будет ставиться вопрос о необходимости введении вакцинации против ротавирусной инфекции, особо себя тогда не проявлявшей, не говоря уже о гемофильной инфекции, которая и в современный период регистрируется на уровне 85-115 случаев в год по всей стране [54]. В последние годы увеличивается удельный вес заболевших «ветрянкой» в старших возрастных группах, но объяснения этому явлению не дается, тогда как вопрос о необходимости вакцинации против этой инфекции поднимается довольно активно [53]. К сожалению, пока мы не можем прогно- 150 зировать как в дальнейшем будет развиваться эпидемиологическая ситуация и привить против всех потенциальных возбудителей, которых как минимум более 2 500 [55]. В
Популяция
хозяина
Высоковирулеитные Высоковосприинчивы*
|
Средневос приимчнвые
Биологическая основа ЭП - паразитарная система - является результатом сопряженной эволюции и паразита, и хозяина. В своей теории саморегуляции паразитарных систем [3] В.Д. Беляков вскрывает конкретные механизмы - факторы, определяющие популяционную динамику возбудителей - их численность, гетерогенность и изменчивость, а также фазность этих популяционных изменений микроорганизмов в процессе функционирования паразитарной системы. В основу теории положен ряд постулатов, важнейший из которых - генотипическая и фенотипическая гетероген- 134
ность популяций паразита и хозяина по признакам их взаимодействия, являющаяся основной причиной их постоянной изменчивости. Этим подчеркивается тот факт, что главной особенностью природных популяций всех видов живых организмов является их генетически обусловленная гетерогенность. Благодаря этому популяция приобретает необходимую пластичность приспособления к неоднородной и постоянно изменяющейся во времени среде обитания. Следует заметить, что гетерогенность популяции человека во многом сформировалась под влиянием мира микроорганизмов в результате естественного отбора [4]. Вследствие сопряженной эволюции наш организм изначально настроен на возможность защиты от всех потенциальных патогенов. Однако эта адаптация в различных экологических, климатических и социальных условиях развивалась различно, вследствие чего существует широкий диапазон вариаций факторов естественного иммунитета у групп населения и отдельных индивидуумов.
Важнейшими характеристиками гетерогенности взаимодействующих популяций, по В.Д. Белякову, являются вирулентность для микроорганизма и восприимчивость для популяции хозяина. Изменения в составе популяции возбудителя наблюдаются как в ходе инфекционного процесса - высокая вирулентность возбудителя в начале заболевания и его разгаре и снижение ее к концу, так и в эпидемическом процессе - повышенная вирулентность в начале эпидемии и сниженная при ее угасании. При этом распределение в популяции как разных по вирулентности штаммов одного вида, так и разных по восприимчивости людей можно описать кривой нормального распределения Гаусса (рис. 6.2), т.е. больше всего средневирулентных штаммов и средневосприимчивых людей, штаммов более или менее вирулентных, так же как и более и менее восприимчивых лиц, - значительно меньше.
Поскольку различия населения разных регионов по распределению восприимчивых и невосприимчивых несомненно влияют на развитие ЭП, мы считаем более уместным пользоваться термином «степень восприимчивости популяции» - соотношение в ней лиц восприимчивых и невосприимчивых к определенной инфекции (рис. 6.3), которое, по нашему мнению, более корректно, чем
применяемый термин «популяционный иммунитет», отражающий только долю индивидуумов с наличием специфических антител.
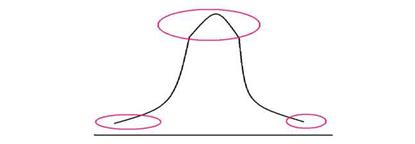
Рис. 6.2. Кривая нормального распределения Гаусса |
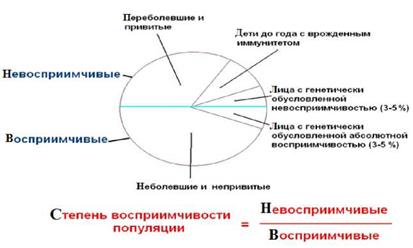
Рис. 6.3. Структура степени восприимчивости популяции к абстрактному возбудителю |
Понятие «невосприимчивость» имеет более широкое, чем иммунитет, значение, поскольку включает в себя и лиц с генетически обусловленной невосприимчивостью к определенной инфекции. К сожалению, целенаправленных исследований по изучению
структуры популяции человека в таком аспекте мы не встречали. Но, судя по разным источникам, лиц с генетически обусловленной невосприимчивостью к определенной инфекции, примерно 3-5 % [1, 5]. Необходимо подчеркнуть, что и среди когорты восприимчивых тоже есть лица с генетически обусловленной более или менее высокой восприимчивостью. Так, лица с группой крови A(II) более восприимчивы к натуральной оспе, а с O(I) - к чуме
[6] . Обнаружена положительная ассоциациативная связь между высоким уровнем иммунитета к дифтерии и группой крови B(III)
[7] . Нами установлено, что пациенты с группой более B(III) восприимчивы к токсоплазмозу [8], причем доля таковых в общей структуре восприимчивых не может превышать 3-5 %. Поскольку в природе все находится в определенном равновесии, то для сохранения стабильности популяции соотношение высоковосприимчивых и невосприимчивых тоже должно быть примерно равным [9]. Подробнее о механизмах генетической устойчивости (восприимчивости) к возбудителям инфекционных болезней см. в работах Э.П. Эфроимсона [10], Frodsham Angela J., Hill Adrian V.S. [11], D. Kumar, D Weatheral [12].
Следует заметить, что по мнению В.Д. Белякова [13], в генофонде популяции людей заложено распределение генотипов со специфической предрасположенностью к отдельным нозологиям. В частности, занимаясь проблемой сочетанных вирусных гепатитов в Приморском крае, мы обратили внимание на тот факт, что на их долю от всех зарегистрированных приходится порядка 10 % [14]. Позднее в публикации К.А. Павроз с соавт. [15] из Перми, обнаружили, что и по их материалам доля микст-форм гепатитов В и С тоже составляет примерно 10 %. Близкие данные получены Г.Е. Ефимовым из Башкирии [16]. В пределах 10 % колеблется, например, и доля сочетанных форм ВИЧ-инфекции и туберкулеза, выявленных в Санкт-Петербурге и во Вьетнаме [17]. Вряд ли такие совпадения могут быть случайными. Следовательно, можно полагать, что риск формирования сочетанных инфекций - генетически детерминирован.
Результатом взаимодействия микроорганизмов с популяцией человека и является возникновение тех или иных форм инфекционного процесса (см. гл. 4). Их формирование зависит от ви-
137
рулентности возбудителя, дозы и восприимчивости организма на момент заражения. Спектр инфекционных состояний в популяции человека от клинически выраженных до носительства - это и есть паразитарная система. В этой связи необходимо подчеркнуть, что носительство - неотъемлемый элемент, характеризующий развитие скрыто протекающего ЭП и обеспечивающий сохранение популяции паразита в межэпидемический период.
Гетерогенность популяции микроорганизмов формировалась как ответ на различные неблагоприятные вызовы внешней среды. В частности, наши исследования в области морской эпидемиологии [18] показали, что когда нет таких воздействий извне, гетерогенность популяции существенно уменьшается.
Правомочность такого суждения, в частности, нами обоснована по итогам изучения чувствительности выделенных культур Escherichia coli к ряду антибиотиков членов экипажа в ходе длительного (семимесячного) рейса на плавбазе «Е. Лебедев». Вполне понятно, что широко антибиотики для лечения там не применялись, да и их спектр был ограничен. К тому же в море на судне практически отсутствуют конкурентные микроорганизмы. Как оказалось, устойчивость эшерихий варьировала по ходу рейса (табл. 6.1).
Так, до выхода судна в море (1-й этап исследования) мы выявили резистентность к 10 и более антибиотикам (а/б) у 66±5,3 % выделенных культур, к 9-5 - у 33, 4±5,3 % и менее 5 - у 0, 6 ±0,7 % штаммов.
На втором этапе (первый месяц рейса) число культур нечувствительных к 10 и более а/б уменьшилось до 43,3±8,5 %, а к 9-5 - увеличилось до 46,7±8,5 %. Через 6 мес. плавания к 10 и более а/б осталось устойчивыми не более 40±8,1 %, а к 9-5 - уже 60±8,1 % (р < 0,05). Устойчивых к менее 5 а/б культур E.coli на 2-м и 3-м этапах рейса не выделено.
Таким образом, от этапа к этапу рейса судовая популяция
Е. coli приобретала все большую однородность по отношению к устойчивости к а/б. Причем прежде всего утрачивались крайние ее варианты (т.е. как наиболее, так и наименее устойчивые к а/б).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Дифференцированная оценка изменений отношения выделенных культур Е. coli к некоторым а/б, из числа использованных в эксперименте, позволила выявить три тенденции: формирование более выраженной устойчивости; повышение чувствительности и стабильность сложившихся взаимоотношений. В частности, увеличение чувствительности отмечено к таким антибиотикам, как стрептомицин, левомицетин, пенициллин, полимиксин, канами- цин и гентомицин (р < 0,05). Вместе с тем к ампициллину, карбе- нициллину и рифампицину она даже уменьшилась, к другим - существенно не изменилась.
Особого внимания, на наш взгляд, требует факт появления штаммов, чувствительных к пенициллину и стрептомицину. И тот, и другой антибиотик начали применяться в практической медицине одними из первых. Поэтому и устойчивые варианты к ним стали формироваться раньше, чем к другим антибиотикам. Наши наблюдения свидетельствуют о том, что в гетерогенной популяции Е. coli, а вероятно, и других представителей энтеробактерий, сохраняются клоновые линии, способные к быстрому восстановлению чувствительности к этим и другим антибиотикам при создании соответствующих условий. Это показывает, насколько популяция микроорганизмов пластична и «запаслива». У нее есть варианты на все случаи жизни. Особенно важно, как нам кажется, об этом помнить сейчас, когда и у нас, и за рубежом все чаще пишут «о закате эры антибиотиков».
Аналогичные результаты показали и наши наблюдения по изучению чувствительности культур эшерихий к дезинфектанту (хлорамину) (табл. 6.2). Следует заметить, что на плавбазе в соответствии с «Методическими указаниями для судовых медицинских работников по дезинфекции на морских судах во время рейсов» постоянно применяют для профилактической дезинфекции 0,3-0,5 %-е растворы хлорсодержащих препаратов (хлорная известь, хлорамин). Как показали результаты наблюдений, до выхода судна в рейс среди выделенных культур эшерихий встречались такие (1,96 %), которые не реагировали даже на 1 %-й раствор хлорамина, 3,8 % культур давали 50 %-й рост колоний. 11,1 % оказались практически не чувствительными к действию 0,3 %-го
раствора хлорамина. Напротив, уже к 0,1 %-му раствору оказались чувствительными 5,8 % выделенных культур.
Таблица 6.2
Динамика чувствительности к дезинфектантам (хлорамину) судовой популяции Е.соИ, выделенных на разных этапах промыслового рейса
| Концентрация раствора, % | Результат | Удельный вес штаммов (M+m), выделенных на разных этапах, % | ||
| 1-й | 2-й | 3-й | ||
| ++++ | 98,0+1,8 | 100 | 100 | |
| +++ | 2,0+1,8 | 0 | 0 | |
| 1 | ++ | 0 | 0 | 0 |
| + | 0 | 0 | 0 | |
| - | 0 | 0 | 0 | |
| ++++ | 82,5+8,2 | 93,4+4,0 | 100 | |
| +++ | 13,7+5,0 | 6,6+4,0 | 0 | |
| 0,5 | ++ | 3,8+2,5 | 0 | 0 |
| + | 0 | 0 | 0 | |
| - | 0 | 0 | 0 | |
| ++++ | 57,4+6,4 | 33,4+8,0 | 42,1+8,7 | |
| +++ | 29,6+5,9 | 30+7,8 | 31,5+8,4 | |
| 0,3 | ++ | 1,9+1,8 | 30+7,8 | 26,4+8,0 |
| + | 3,7+2,5 | 6,6+4,0 | 0 | |
| - | 7,4±3,9 | 0 | 0 | |
| ++++ | 0 | 0 | 0 | |
| +++ | 5,8+3,0 | 0 | 0 | |
| 0,1 | ++ | 3,9+2,5 | 16,6+6,2 | 10+5,4 |
| + | 11,8+4,2 | 56,6+8,5 | 35+7,5 | |
| - | 78,5+5,3 | 26,8+7,5 | 55,0+9,0 | |
| Примечание. (++++) - лизис всех колоний; (+++) - рост единичных колоний; (++) - 50 % рост колоний; (+) - единичные зоны лизиса; (-) - нет лизиса
|
Однако от этапа к этапу рейса популяция Е. coli по признаку чувствительности к используемым в эксперименте растворам хлорамина, становилась более однородной. В частности, на вто-
141
ром этапе штаммы, резистентные к 1 %-му раствору, уже не были зарегистрированы. Значительно сократилось число культур, чувствительных к 0,1 %-му раствору хлорамина. На третьем эта - пе рейса вся судовая популяция Е. coli была чувствительной к 0,5 %-му раствору и сократилась доля культур, устойчивых к 0,3 %-му раствору (р <0,05). Следовательно, как и по отношению к признаку устойчивости к а/б, первоначально утрачивались крайние варианты популяции эшерихий по чувствительности к хлорамину. Важно подчеркнуть, что реакция судовой популяции эшерихий на действие внешних факторов (применение антибиотиков в судовом коллективе, проведение дезинфекционных мероприятий) не носила характера прямого приспособления к их влиянию, а была более сложной. В частности, могла повышаться устойчивость к антибиотикам, на судне не применявшимся, и снижалась резистентность к хлорамину, несмотря на его широкое использование. Это еще раз подчеркивает необходимость более глубокого изучения механизмов формирования устойчивости у микроорганизмов к антибактериальным препаратам, которая обусловлена не только как зачастую принято считать, широким и бесконтрольным применением антибиотиков населением.
Наряду с изучением фенотипических признаков судовой популяции Е. coli в ходе длительно рейса, нами проводилось и определение плазмидного профиля выделенных микроорганизмов, который, как известно, контролирует факторы чувствительности к антибиотикам и дезинфектантам.
Результаты исследования (табл. 6.3) выделенных на первом этапе рейса эшерихий продемонстрировали колоссальное разнообразие плазмид с разной молекулярной массой и плазмидных вариантов по их сочетанию у одного штамма кишечной палочки.
Только у двух штаммов Е. coli (2,5 %) оказался одинаковый набор плазмид. Все остальные варианты имели самый разнообразный их спектр, не совпадающий ни по их набору, ни по молекулярной массе. Важно подчеркнуть, что до выхода в море 19,6 % штаммов кишечной палочки были бесплазмидными. Одну-две плазмиды содержали 41,2 %, а три и более - 39,2 % выделенных культур (табл. 6.4).
| Таблица 6.3
Типичные варианты набора плазмид по молекулярной массе у штаммов E. coli, выделенных на разных этапах промыслового рейса
|
||||||||||||||||||||
| Таблица 6.4
Распределение плазмидосодержащих и бесплазмидных штаммов E. coli, выделенных на разных этапах промыслового рейса
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Проведенное нами изучение плазмидного спектра эшерихий на втором этапе рейса показало отсутствие бесплазмидных штаммов при доминировании штаммов кишечной палочки, содержа-
143
щих 1-2 плазмиды (83,3 %). При этом увеличилось до 5 (14,7 %) количество штаммов, содержащих идентичный набор плазмид.
На третьем этапе рейса, напротив, основную массу составили штаммы, не имеющие плазмид, и значительно сократилось количество культур, содержащих 1-2 плазмиды. Впервые были зарегистрированы эшерихии, несущие только одну криптическую плазмиду.
Эти данные убеждают в том, что наличие плазмид более характерно для эшерихий, циркулирующих в береговых условиях. Именно здесь бактерии подвергаются мощному селективному действию химиопрепаратов и именно плазмиды способствуют их выживаемости. Об этом свидетельствуют и результаты обследования лиц, прибывших на плавбазу к концу рейса. Так, штаммы, с характерным разнообразием плазмидного профиля, отмеченного нами у членов экипажа до выхода в море, были получены и от четырех, прибывших на судно с берега уже к концу рейса, членов экипажа.
Плазмидный профиль штаммов E. coli, выделенных от членов экипажа РМБ «Е. Лебедев», прибывших на базу в конце рейса
 |
Заметим, что каждый новый этап обследования характеризовался появлением и новых плазмид как с высокой, так и с низкой молекулярной массой. Но независимо от молекулярной массы, наименьшее селективное преимущество в судовой популяции имели штаммы эшерихий с максимально большим набором плазмид.
Таким образом, проведенный анализ фено- и генотипических признаков судовой популяции Е. coli позволил выявить общую за - кономерность изменения их биологических свойств в ходе длительного рейса: от выраженной гетерогенности, отмеченной перед выходом судна в море, к максимальной однородности. Надо полагать, что это - приспособительный ответ популяции микро
организмов в пределах данного генотипа на изменения среды обитания, ибо «... любая популяция стремится сохранить состав, обеспечивающий среднюю приспособленность к той частной среде, в которой она обитает» [19]. Различия в действии факторов, присущих береговым условиям, и действующих в судовой среде, видимо, и привели к вышеуказанным фено- и генотипическим модификационным изменения в судовой популяции Е. coli.
Принимая во внимание, что выделенные нами штаммы кишечной палочки были непатогенны, тогда как одно из предназначений плазмид - контроль вирулентности [20], вполне закономерно возникал вопрос о причинах такого разнообразия у эшерихий плазмид с разной молекулярной массой. То обстоятельство, что у различных штаммов кишечной палочки нами зарегистрированы плазмиды, встречающиеся, например, у брюшного тифа и других сальмонелл, а также шигелл [21, 22], наводит на мысль, что
Е. coli вследствие постоянного пребывания в кишечнике человека как мы полагаем, способны играть роль своеобразного и реципиента, и донора плазмид. Возможно, патогенные микроорганизмы кишечной группы при переходе в фазу резервации отдают им плазмиды. При формировании эпидемических вариантов соответствующие возбудители получают плазмиды от эшерихий. Судя по имеющимся публикациям [23], подобная вероятность не исключена. При этом важно подчеркнуть, что коньюгативный обмен плазмидами происходит не только среди представителей одного семейства, но и между разными семействами и видами. Вполне вероятно, что подобные механизмы лежат и в основе формирования устойчивости к антибактериальным препаратам у различных видов микроорганизмов в формируемом ими биогеоценозе. Возможности для этого у эшерихий поистине безграничны, поскольку для популяции E.coli характерна убиквитарность, полигостальность, способность к сапрофитическому существованию, свидетельствующей об экологической пластичности этого вида, обеспечивающей его представителям возможность колонизировать различные экониши и вступать в симбиотические взаимодействия с широким кругом естественных хозяев [24].
Изучение гетерогенности микробных популяций в современный период идет весьма интенсивно и уже используется в системе
145
эпидемиологического надзора за различными инфекциями, чего не скажешь о гетерогенности популяции человека по восприимчивости. К сожалению, пока довольно редки исследования по выявлению возможного влияния генетических особенностей населения на распространенность инфекции. Тем не менее, например, у такой инфекции как ВИЧ выявлен ген устойчивости к ней. Среди европеоидов он, в частности, встречается в пределах 20 %. По- мнению В.П. Сергиева, это указывает на то обстоятельство, что ВИЧ - не новая инфекция, поскольку наличие к ней генетически устойчивых лиц - это, так называемые «генетические шрамы», которые появляются только вследствие длительных контактов населения с возбудителем. И это свидетельствует о том, что ВИЧ не пришла к нам из Африки, как принято считать, а видимо, наоборот [25].
Следовательно, наряду с генетическим мониторингом за популяцией возбудителей целесообразно вводить и мониторинг за генетической структурой населения региона в аспекте его восприимчивости к той или иной инфекции. Однако, по справедливому замечанию Мак Мана с соавт. [26], сделанного ими еще в 60-х годах, «... роль микробных агентов в инфекционной болезни считается преобладающей над ролью генетических факторов может быть отчасти потому, что гораздо легче контролировать водоснабжение и истреблять насекомых переносчиков, чем произвести отбор генетически резистентного населения» . К сожалению, воз, что называется, - и ныне там. Тогда как еще в 1941 г. С.М. Гершензон [27] подчеркивал, что гетерогенность популяций является мобилизационным резервом, обеспечивающим устойчивость паразитарной системы во времени, что необходимо учитывать при реализации различных противоэпидемических мероприятий.
В этом плане заметим, что Всемирная организация здравоохранения главным направлением профилактики вполне обоснованно считает вакцинопрофилактику. Однако при этом стратегия ее проведения, начиная со времен Эдварда Дженнера и Луи Пастера, т.е. 200 с лишним лет, практически не претерпела никаких изменений. В ее основе лежит представление о том, что возбудитель обладает однозначно высокой вирулентностью, а индивидуум - высоко восприимчив к определенному инфекту. Эта парадигма сложилась на заре вакцинопрофилактики, поскольку в ту пору ученые, ко- 146
нечно, не располагали современными методами, а соответственно и знаниями о том, насколько гетерогенна популяция микроорганизмов, в частности по вирулентности, а популяция человека - по степени восприимчивости к инфекту. В русле этой парадигмы и стремятся охватить прививками как можно больше населения и вакцинировать всех одинаковой дозой вакцины.
На основе глобальной иммунизации населения планеты ставится задача ликвидации отдельных инфекций. Однако в современный период появляется все больше работ [28-31], авторы которых высказывают обеспокоенность складывающейся ситуацией в отношении иммунопрофилактики. Главный лейтмотив этих публикаций: продолжая действовать таким же образом, мы в перспективе получим результат, аналогичный тому, что получили от широчайшего применения антибиотиков. Вследствие колоссальной изменчивости микроорганизмов и гетерогенности, под влиянием иммунологического пресса идет все большая дивергенция между дикими штаммами и вакцинными. Поэтому иммунный ответ на них уже не всегда обеспечивает защиту от заболевания. Так, в Государственном докладе Федеральной службы в сфере защиты прав потребителей и благополучия человека «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2013 г.» представлены материалы, свидетельствующие о том, что в популяции возбудителя коклюша доминируют штаммы с новыми «невакцинными» ptxAl и ptxC2 аллелями генов, кодирующие S1 и S3 субъединицы коклюшного токсина. В популяции возбудителя дифтерии стали превалировать штаммы с «невакцинными» генотипами (сиквенс-типами). Исследования британских ученых также показали, что возбудитель коклюша активно меняется, что может свидетельствовать об усилении защитных свойств микроба. Выявленные изменения они, в частности, связывают и с применением с 2004 г. новой бесклеточной вакцины против коклюша [32].
Имеются данные, что вакцинация БСЖ не защищает от актуальных генотипов семейства Beijing, а именно они сегодня быстро распространятся по планете (см. гл. 2.1). Выявлен генетический дрейф и дивергенция полевых штаммов краснухи. Массовая иммунизация против менингококка чревата быстрой селекцией
147
возбудителя другого серотипа или даже серогруппы. Подобные преценденты были. Так, в 70-80-х годах прошлого века после массовой иммунизации по эпидемическим показаниям населения вакциной А+С и резкого снижения заболеваемости, в ряде стран Южной Америки и на Кубе разразилась жестокая эпидемия генерализованных форм менингококковой инфекции, вызванная маловирулентным до этого менингококком серогруппы В. Аналогичная ситуация отмечена в 80-90-х годах в некоторых странах Африки. Широкие испытания тетравалентной вакцины А+С+W+Y уже в новом веке привели к селекции и выходу из резервации считавшегося ранее редким возбудителя серогруппы Х, вспышки которого часто сопровождались летальными исходами. А появление вакциноассоциированных штаммов вируса полиомиелита ставит под сомнение возможность ликвидации этого заболевания [33]. К тому же в 2010 г. в Республике Конго отмечена вспышка полиомиелита с необыкновенно высокой летальностью (до 47 %). Как оказалось, вирус полиомиелита приобрел совершенно необычную мутацию. Именно перед этой мутацией иммунитет привитых от полиомиелита оказался беспомощным [34]. Даже по отношению к натуральной оспе М.В. Супотницкий, в своей книге «Микроорганизмы, токсины и эпидемии» [35] высказывает некоторое сомнение, что именно глобальная вакцинация привела к ее ликвидации. Близкие суждения по этому поводу приводятся и в публикации А.Б. Белова и П.И. Огаркова [36].
В свете современных данных об эпидемической ситуации по кори как в мире, так и в России [37] не внушает оптимизма и реализация задачи по региональной ликвидации этой инфекции. Вообще, чем больше мы знаем о гетерогенности микроорганизмов, тем более непростой представляется проблема ликвидации инфекций в целом [38]. И думается, что возможности вакцинопрофилактики в плане влияния на развитие ЭП иногда преувеличиваются, поскольку очень часто исследователи, оценивая влияние иммунизации населения на динамику заболеваемости, допускают одну весьма распространенную методическую ошибку: «после того» (т.е. снижение заболеваемости после введения вакцинации) не значит «вследствие того» [39]. Так, проведенный нами сопряженный анализ заболеваемости ГВ и ГС населения Приморского 148 края позволил прийти к заключению, что снижение заболеваемости острым гепатитом В, возможно, не связано с вакцинопрофилактикой против этой инфекции, поскольку синхронно снижается и заболеваемость острым гепатитом С, в отношении которого вакцинопрофилактика не проводится [11]. Позднее к аналогичному выводу пришли и А.А. Асратян с соавт. [40] на основе анализа материалов по Москве. При этом следует заметить, что, по-мнению И.В. Фельдблюм [41] вакцинопрофилактика ГВ в нашей стране оказала влияние только на риск заболевания острыми формами ГВ и носительство, существенно не повлияв на риск формирования хронического гепатита.
В одном из обзорных докладов ВОЗ констатируется, например, что снижение заболеваемости дифтерией наблюдалось еще до начала массовой вакцинации [42]. Исследованиями А.Я. Миндлиной [43] установлено, что заболеваемость краснухой, коклюшем и дифтерией начала снижаться раньше достижения полноценного охвата прививками. При этом время начала снижения заболеваемости этими инфекциями практически совпало со временем начала снижения заболеваемости антропонозами с фекально-оральным механизмом передачи. Это, по мнению автора, свидетельствует о наличии общих факторов, влияющих на проявления заболеваемости антропонозными инфекциями, независимо от степени управляемости.
В этой связи заметим, что основная вакцинальная нагрузка в соответствии с Национальным календарем прививок приходится на детский возраст. Однако зачастую заболеваемость сдвигается на старшие возрастные группы. Это явление прослеживалось, начиная с вакцинации против натуральной оспы. Позднее, такая же ситуация наблюдалась в отношении иммунизации против кори, дифтерии, краснухи коклюша [44, 45]. По-видимому, подобная перспектива ожидает и вакцинацию против ГВ [46]. Как показывает многолетний опыт вакцинопрофилактики, начиная вакцинацию в детском возрасте, в последующем приходится вводить ревакцинацию [45]. Хотя первоначально, как правило, утверждается, что иммунитет от вводимой вакцины чуть ли не пожизненный, и ревакцинация не потребуется. Все это в конечном итоге ведет к перегруженности календаря прививок [36]. К тому же, нельзя не
149
согласиться с Б.Л. Черкасским [47], что инъекционная нагрузка на детский организм в связи с вакцинацией итак очень высока: ребенок до 1 года получает 10 инъекций. Поэтому введение в последние годы в Национальный календарь прививок новых вакцин (против гемофильной инфекции, пневмококковой), на наш взгляд, усиливает и без того активно формирующееся у населения негативное отношение к прививкам. К тому же, заметим, доля отказавшихся от вакцинации растет не только в нашей стране, но и в развитых государствах Европы и в США [48]. Как мы полагаем, целесообразнее вначале апробировать отечественные ассоциированные вакцины, а потом уже вводить новые в календарь прививок и, конечно, заменять инъекционные методы иммунизации альтернативными - аэрозольным, оральным, транскожным и др. [49]. Но, к сожалению, как говорится, «телега ставится впереди лошади». И еще одно важное замечание. В директивных документах по профилактике гриппа, например, указывается не необходимость вакцинации в первую очередь пожилых людей, у которых возможны неблагоприятные исходы заболевания. Но при этом немало работ, свидетельствующих о том, что иммунный ответ на вакцинацию лиц старше 60 вакциной против гриппа зачастую слабо выражен (кстати, как и в отношении вакцинаций против других инфекций), т.е. эффективность такой защиты невысока [50-52]. Ну и, наконец, нельзя не отметить, что расширение спектра прививок приводит к изменению структуры наиболее значимых инфекций. В 60-70-х годах, к примеру, при введении вакцинации против кори, коклюша, дифтерии, сложно было даже представить, что в современный период значительно возрастет эпидемиологическая значимость ветряной оспы [53], которую в те годы относили к «малым» детским инфекциям, или будет ставиться вопрос о необходимости введении вакцинации против ротавирусной инфекции, особо себя тогда не проявлявшей, не говоря уже о гемофильной инфекции, которая и в современный период регистрируется на уровне 85-115 случаев в год по всей стране [54]. В последние годы увеличивается удельный вес заболевших «ветрянкой» в старших возрастных группах, но объяснения этому явлению не дается, тогда как вопрос о необходимости вакцинации против этой инфекции поднимается довольно активно [53]. К сожалению, пока мы не можем прогно- 150 зировать как в дальнейшем будет развиваться эпидемиологическая ситуация и привить против всех потенциальных возбудителей, которых как минимум более 2 500 [55]. В
Источник: А.А. Яковлев, Е.Д. Савилов, «ПРОБЛЕМНЫЕ ВОПРОСЫ ОБЩЕЙ ЭПИДЕМИОЛОГИИ» 2015
А так же в разделе «ГЛАВА 6 ГЕТЕРОГЕННОСТЬ ПОПУЛЯЦИИ ВОЗБУДИТЕЛЯ И ХОЗЯИНА КАК ОСНОВА ТЕОРЕТИЧЕСКИХ ВОЗЗРЕНИЙ АКАДЕМИКА В.Д. БЕЛЯКОВА НА РАЗВИТИЕ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА »
- ПРЕДИСЛОВИЕ
- ОТ АВТОРОВ
- ГЛАВА 1 ОБ ОПРЕДЕЛЕНИИ ЭПИДЕМИОЛОГИИ КАК НАУКИ И ПОНЯТИИ О ЕЕ ПРЕДМЕТЕ И ОБЪЕКТЕ
- Библиографический список
- ГЛАВА 2 СОВРЕМЕННЫЕ НАПРАВЛЕНИЯ В ЭПИДЕМИОЛОГИИ
- Эпидемиология хронических инфекций.
- Эпидемиология медленных инфекций.
- Эпидемиология сапронозов.
- Эпидемиология катастроф.
- Географическая (энвайроментальная) эпидемиология.
- Госпитальная эпидемиология.
- Эпидемиология неинфекционных болезней.
- 2.1. Молекулярная эпидемиология (на модели Mycobacterium tuberculosis)
- 2.1. Морская эпидемиология (история становления и основные направления развития)
- 2.1. Экологическая эпидемиология
- 2.4. Интеграционная эпидемиология
- Библиографический список
- ГЛАВА 3 О ПРИЧИНЕ, УСЛОВИЯХ И МЕХАНИЗМАХ ФОРМИРОВАНИЯ ЗАБОЛЕВАЕМОСТИ
- Классификация факторов риска эпидемического процесса
- Библиографический список
- ГЛАВА 4 О ВОЗМОЖНЫХ МЕХАНИЗМАХ РАЗВИТИЯ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
- Библиографический список
- ГЛАВА 5 О ВОЗМОЖНЫХ МЕХАНИЗМАХ ФОРМИРОВАНИЯ ЦИКЛИЧНОСТИ И СЕЗОННОСТИ В ЭПИДЕМИЧЕСКОМ ПРОЦЕССЕ
- Библиографический список
- Библиографический список
- ГЛАВА 7 СИСТЕМНЫЙ ПОДХОД К ЭПИДЕМИОЛОГИЧЕСКОЙ ОЦЕНКЕ РОЛИ СОЧЕТАННЫХ ИНФЕКЦИЙ В РАЗВИТИИ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА (НА МОДЕЛИ ВИРУСНЫХ ГЕПАТИТОВ)
- Библиографический список
- ГЛАВА 8 ЭВОЛЮЦИЯ ИДЕЙ АКАДЕМИКА В.Д. БЕЛЯКОВА О САМОРЕГУЛЯЦИИ ПАРАЗИТАРНЫХ СИСТЕМ В КОНЦЕПЦИИ ИНТЕГРАЦИОННО-КОНКУРЕНТНОГО РАЗВИТИЯ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
- Библиографический список
- ГЛАВА 9 ИНТЕГРАЦИОННЫЙ ПОДХОД К ЭПИДЕМИОЛОГИЧЕСКОЙ ОЦЕНКЕ НЕКОТОРЫХ НАПРАВЛЕНИЙ ПРОФИЛАКТИКИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
- Библиографический список
- ГЛАВА 10 ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ ЭПИДЕМИОЛОГИЧЕСКОЙ ОЦЕНКИ ПАНДЕМИИ ГРИППА А(H1N1)pdm09 2009-2010 гг.
- Библиографический список
- ГЛАВА 11 ГЛОБАЛЬНЫЙ ЭПИДЕМИОЛОГИЧЕСКИЙ НАДЗОР КАК ОТВЕТ НА ГЛОБАЛИЗАЦИЮ ЭПИДЕМИЧЕСКОГО ПРОЦЕССА
- Библиографический список
- ЗАКЛЮЧЕНИЕ
- Библиографический список