2.4. Роль витаминов в системе клеточного метаболизма Межвитаминные взаимоотношения
Между витаминами существует тесное взаимодействие в процессах метаболизма. Оно может выражаться в следующем:
- в непосредственном взаимном влиянии витаминов друг на друга;
- во влиянии одного витамина на образование коферментной формы другого;
- в совместном участии в каком-либо метаболическом процессе.
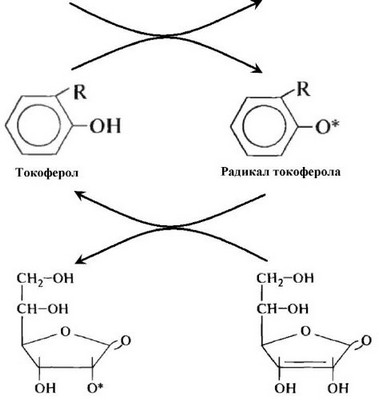
Тесным синергичным антиоксидантным действием обладают витамины С, Е и А. Витамин С в клетках может играть роль как про-, так и ак- тиоксиданта. При этом, введение высоких доз аскорбата на фоне гиповитаминоза Е усиливает прооксидантный эффект витамина С на 2 порядка. Выраженный антиоксидантный эффект витамина С проявляется только при его совместном действии с токоферолом, поскольку последний устраняет свободные радикалы жирных кислот и их перекиси, образующиеся в
реакциях аскорбатстимулированного ПОЛ. С другой стороны, при недостатке аскорбиновой кислоты витамин Е быстро разрушается. Это взаимодействие представлено на рис. 62.
Антиоксидантный эффект токоферола резко усиливается в присутствии витамина А, который устраняет свободные радикалы кислорода и тем самым предупреждает развитие процесса ПОЛ в биомембранах. При нестимулированном ПОЛ облегчается «задача» токоферола по устранению перекисей липидов. Однако витамин А легко окисляется кислородом воздуха и относительно быстро расходуется. Процесс идет аутокаталитически с образованием свободных радикалов. Витамин Е оказывает стабилизирующее действие на ретинол и Р-каротины, препятствуя их окислительной деструкции. Иными словами, достаточно высокие дозы витамина А, которые способны оказывать антиоксидантное действие, следует сочетать с приемом токоферола, а прием токоферола - с витамином А. Как указывалось выше, витамин Е необходимо применять в сочетании с витамином С. Таким образом, эффективность действия витаминов-антиоксидантов зависит от того, применяются они в изолированном виде или в сочетании друг с другом. Отдельно назначенные витамины А и С могут вызвать про- оксидантный эффект в тканях организма. Следует учитывать также, что процессы свободнорадикального окисления в клетке протекают как в водной, так и в липидной ее фазах, поэтому водо- и липидорастворимые витамины для проявления антиоксидантного действия должны назначаться только совместно.
Примером второго типа межвитаминных взаимодействий может служить особая роль рибофлавина в реализации функций других витаминов. Поскольку витамин В2 необходим для образования активных форм витаминов В6, В9, Д и синтеза ниацина из триптофана, его дефицит неизбежно нарушит функцию других витаминов и приведет к развитию их вторичного дефицита даже при достаточном поступлении с пищей.
Витамины С и В12 способствуют образованию коферментной формы фолиевой кислоты, при их недостатке нарушатся многообразные функции фолатов.
Примеры взаимодействия третьего типа особенно многочисленны, так как большинство функций клетки обеспечивается синергичной «работой» нескольких витаминов. Так, пролиферативная активность клеток крови поддерживается витаминами В9, В12, В6, С; образование родопсина в сетчатке глаза - витаминами А, В2, В6, РР; регуляция проницаемости капилляров - витаминами С и Р.
Рассмотрим такие примеры, как взаимодействие витаминов В12, В9 и В6 в поддержании гомеостаза гомоцистеина и взаимодействие функционально связанных витаминов в составе мультиферментных комплексов дегидрогеназ а-кетокислот.
Радикал аскорбата
Аскорбат
Рис. 62. Обезвреживание токоферолом перекиси жирной кислоты и регенерация радикала токоферола аскорбиновой кислотой (по Морозкиной Т.С., Мойсеенок А.Г, 2002).
Коферментная форма витамина В9 - 5-метил-ТГФК - вместе с витамином В12 участвуют путем переноса метильной группы в синтезе метионина, осуществляемом метионинсинтазой (гомоцистеинметил- трансферазой). Соответственно коферментная функция ТГФК в переносе метильной группы (ключевая реакция) зависит от доступности фолата, то есть от адекватного его поступления в организм.
При недостаточности витамина В9, а также при снижении активности метионинсинтазы - В12-зависимого фермента, функциональный пул ТГФК
может быть легко исчерпан путем «секвестрации», что влечет за собой избыточное накопление субстрата метионинсинтазной реакции - гомоцисте- ина. На рис. 63 представлен механизм нарушения обмена метионина и ци- стеина при недостаточности В12, В9 и В6.
Отмечена прямая корреляция между показателями тромбоэмболических осложнений, смертностью от ишемической болезни сердца и уровнем гомоцистеинемии у этих больных. Увеличенный уровень гомоцистеи- на в крови постулируется в настоящее время как независимый фактор риска развития ИБС и ее тромбоэмболических осложнений.
Гипергомоцистеинемия обуславливается выходом гомоцистеина в кровяное русло из тканей, при этом отмечается и гомоцистеинурия. Различают умеренную (15-30 мкМ), промежуточную (30-100 мкМ) и выраженную (более 100 мкМ) гомоцистеинурию. Роль гипергомоцистеинурии как пускового фактора атерогенеза связана с прооксидантным действием го- моцистеина, со способностью этой аминокислоты угнетать рост эндотелиальных клеток, оказывать митогенный эффект на гладкомышечные клетки, стимулировать адсорбцию белков в холестериновой бляшке и интенсифицировать биосинтез коллагена. Принципиально важными являются индуцированное гомоцистеином гиперкоагуляционное состояние, снижение мощности систем антиоксидантной защиты тканей, активация биосинтеза NO-синтазы.
Возможность предупреждения развития и устранения синдрома ги- пергомоцистеинемии, прежде всего, определяется адекватным поступлением в организм эссенциальных факторов (кобаламина, фолата), обеспечивающих нормальное функционирование системы биотрансформации го- моцистеина через метионинсинтетазную реакцию. Поскольку некоторая часть гомоцистеина превращается в цистатионин и далее в цистеин с участием пи-ридоксальзависимых ферментов, обеспечение организма витамином В6 также является важным условием предупреждения развития этого синдрома.
Разработаны рекомендации по суточному потреблению функционально связанных витаминов для профилактики развития синдрома гипер- гомоцистеинемии: фолиевая кислота - 400-500 мкг, витамин В12 - 2,4-3 мкг, пиридоксин - 2,0-2,2 мг. Можно полагать, что включение в пищевой рацион таких продуктов, как печень, бобовые растения, яичный желток, шпинат и др., содержащих фолиевую кислоту в достаточно большом количестве, окажется важным фактором профилактической диетотерапии, хотя на сегодняшний день приему поливитаминных комплексов фактически нет альтернативы.
Следует особо заметить, что в генез гипергомоцистеинемии достаточно весомый вклад вносит ферментопатия, обусловленная недостаточностью метилен-ТГФК-редуктазы. Эта ферментопатия также отнесена к группе риска ИБС. Если последнее подтвердится, потребуется пересмотр
(в сторону увеличения) профилактических доз фолиевой кислоты, а также витамина В6. Кстати, эмпирически обнаружено, что курсовое назначение пиридоксина, применяемое клиницистами при сердечно-сосудистой патологии, оказывает положительный лечебный эффект у больных ИБС.
Примечание: звездочками обозначены реакции, активность ко- торпых снижается или полностью блокируется при недостаточности витаминов.
Другой яркой иллюстрацией межвитаминного взаимодействия является функционирование мультиферментных комплексов - пируватде-
гидрогеназы и а-кетоглутаратдегидрогеназы. При этом следует учитывать, что каждый из входящих в состав комплекса витаминов помимо участия в работе этого комплекса выполняет и свою специфическую эссенциальную (незаменимую) функцию. В формировании пируват- и а- кетоглутаратдегидрогеназных комплексов принимают участие липоевая кислота и четыре витамина, входящие в состав соответствующих кофер- ментов: витамин В1 (в составе ТПФ), В2 (ФАД), В3 (KoA-SH), В5 (НАД).
Как показали недавние исследования, дегидрогеназы а-кетокислот млекопитающих, в том числе и человека, представляют собой сложные высокомолекулярные комплексы. В центральной части комплекса находится фермент - дигидролипоиламид-трансацетилаза, состоящий из 50-60 субъединиц. Этот массивный фермент покрыт симметрично расположенными молекулами пируватдекарбоксилазы (30 субъединиц) и дигидроли- поиламид-дегидрогеназы (6 субъединиц). На рис. 64 представлен механизм взаимодействия ферментов и их коферентов при функционировании пи- руватдегидрогеназного комплекса. На 1 стадии этого процесса пируват теряет свою карбоксильную группу в результате взаимодействия с тиамин- пирофосфатом (ТПФ) в составе активного центра фермента пируватдегид- рогеназы (Е1). На 2 стадии оксиэтильная группа комплекса Е1-ТПФ-СНОН- СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидролипоилацетилтрансферазой (Е2). Этот фермент катализирует 3 стадию - перенос ацетильной группы на HS-KoA с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макро- эргическим) соединением. На 4 стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид-Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидроли- поамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На 5 стадии восстановленный ФАДН2 дигидролипоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н+. Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий.
Ферментативный а-кетоглутарат дегидрогеназный комплекс функционирует аналогичным образом, но он имеет меньшие размеры и несколько иначе регулируется.
Знание механизмов межвитаминных взаимоотношений позволяет целенаправленно осуществлять коррекцию энергетического метаболизма и позволяет понять, почему раздельное введение витаминов В1 В2 и РР оказывается не столь эффективным, как их комплексное применение.
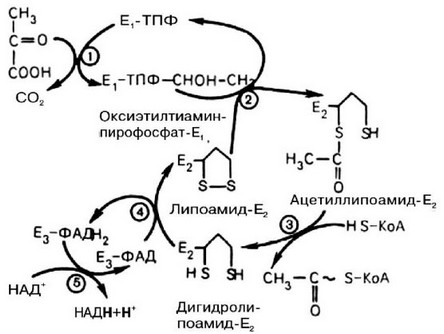
Рис. 64. Механизм действия пируватдегидрогеназного комплекса (по Березову Т.Т., Коровкину Б.Ф., 1998).
Примечание: пояснения в тексте, цифры в кружках обозначают стадии процесса.
А так же в разделе «2.4. Роль витаминов в системе клеточного метаболизма Межвитаминные взаимоотношения »
- Особенности метаболизма клетки в норме и при патологии
- Энергетическое звено метаболизма
- Пластическое звено метаболизма
- Утилизации продуктов метаболизма
- Метаболические механизмы реактивности клеток иммунной системыИзменение метаболизма в лимфоцитах в процессе их функционирования в норме и при патологии
- Метаболизм гранулоцитов и макрофагов в состоянии относительного покоя и при фагоцитозе
- Значение оксидоредуктаз в системе внутриклеточного метаболизма
- Глава 3 ВИТАМИНЫ И НАРУШЕНИЯ ФУНКЦИИ ИММУННОЙ СИСТЕМЫ
- Витаминная недостаточность и их клинические проявления
- Клиническая картина гиповитаминозов Гиповитаминоз A
- Гиповитаминоз В1
- Гиповитаминоз В2
- Гиповитаминоз В6
- Г иповитаминоз фолиевой кислоты (В9)
- Гиповитаминоз В12
- Гиповитаминоз C
- Гиповитаминоз D
- Гиповитаминоз E
- Недостаточность карнитина
- Лабораторные методы исследования витаминов Определение аскорбиновой кислоты в моче по Тильмансу
- Определение рибофлавина (витамина В2) в крови по Берчугу, Бессею и Лоури
- Определение рибофлавина (витамина В2) в моче по Е.М. Масленниковой и Л.Г. Г воздовой
- Определение 4-пиридоксиловой кислоты в моче по Хуффу и Перлцвейгу
- 3.4.8. Определение токоферола (витамина Е) в крови в модификации Фридемана