Метаболизм гранулоцитов и макрофагов в состоянии относительного покоя и при фагоцитозе
Фагоцитарная система человека и животных представлена малоподвижными тканевыми мононуклеарными клетками (макрофаги) и циркулирующими нейтрофильными и мононуклеарными лейкоцитами (моноциты). Адекватное число нормально функционирующих фагоцитов - важнейшее условие для успешной защиты организма от инфекций.
Фагоцитирующие лейкоциты образуются из полипотентных стволовых клеток в костном мозге. Лейкоциты и эритроциты вырабатываются приблизительно в равных количествах, однако из-за более короткой продолжительности жизни лейкоцитов (часы, а не месяцы) обычное соотношение эритроцитов к лейкоцитам в периферической крови составляет 200:1. Нейтрофильные гранулоциты поступают в кровяное русло в виде высокодифференцированных зрелых фагоцитов, а моноциты - в виде незрелых клеток. Оба вида клеток циркулируют в крови в течение 4-10 ч, а затем мигрируют в ткани.
Мононуклеарные клетки превращаются в зрелые фагоциты (макрофаги) в тканях, причем их морфологические и метаболические характеристики зависят от того, в каких органах они задерживаются. Макрофаги присутствуют в селезенке, печени, легких, лимфатических узлах, кишечнике и центральной нервной системе. Циркулирующие мононуклеарные фагоциты также мигрируют в очаги воспаления обычно после их инфильтрации нейтрофилами; мононуклеарные фагоциты играют важную роль в создании вала вокруг инфекционного очага и формировании гранулем. Макрофаги - это основные фагоцитирующие клетки грудного молока.
Обширные запасы зрелых нейтрофилов в норме определяются в костном мозге (костномозговой пул) и удерживаются в пристеночном положении в сосудах (маргинальный пул). При воспалительном процессе происходят мобилизация этих запасов, быстрое размножение клеток- предшественников и ускоренная их дифференцировка; во время острых инфекций нейтрофильные лейкоциты вырабатываются в огромных количествах. Выработка фагоцитирующих клеток костным мозгом, по-
видимому, регулируется циркулирующими факторами, высвобождающимися из лейкоцитов периферической крови.
Основные морфологические особенности нейтрофильных грануло- цитов, позволяющие при их идентификации обходиться без использования дополнительных маркеров, состоят в сегментированном ядре с плотной упаковкой хроматина и наличии в цитоплазме нейтральных (что определило название клеток) гранул, содержащих бактерицидные субстанции и ферменты. Нейтрофилы отличаются высокой подвижностью и отвечаемо- стью на хемотаксические и активационные факторы. Именно это обеспечило им роль наиболее мобильных клеток, ранее всего вовлекаемых в воспалительные и иммунные процессы и обусловливающих пусковые механизмы развития воспаления и ранние защитные реакции.
Существует два типа гранул нейтрофильных гранулоцитов - первичные (азурофильные) и вторичные (специфические). Первые содержат большой набор гидролаз и других ферментов: а-фукозидазу, 5'-
нуклеотидазу, Р-галактозидазу, арилсульфатазу, а-маннозидазу, N-аце- тилглюкозаминидазу, Р-глюкуронидазу, кислую Р-глицерофосфатазу, нейтральные протеиназы - катепсин G, эластазу, коллагеназу, катионные белки, миелопероксидазу, лизоцим (мурамилидаза), а также кислые глико- заминогликаны (мукополисахариды). Во вторичных гранулах кислые гид- ролазы отсутствуют и содержатся ферменты, проявляющие активность при нейтральных и щелочных значениях рН: лактоферрин, щелочная фосфата- за, лизоцим» а также белок, связывающий витамин В12. Содержимое гранул способно облегчить разрушение практически любых микробов. Это достигается в процессе слияния гранул с фагосомами при фагоцитозе или дегрануляции, являющейся разновидностью секреторного процесса. Специфические гранулы быстрее сливаются с фагосомами и выбрасываются клеткой, чем азурофильные. После опорожнения гранул их восстановления не происходит.
Быстрота мобилизации нейтрофилов дополняется их способностью в течение секунд развивать метаболические процессы, приводящие к «кислородному взрыву», а также осуществлять выброс предсуществующих гранул, которые содержат бактерицидные субстанции (дегрануляция). В нейтрофилах обнаружены ферменты, причастные к бактериолизу и перевариванию микроорганизмов. Среди перечисленных выше ферментов этой способностью обладают кислые протеиназы, миелопероксидаза, лактофер- рин, лизоцим и щелочная фосфатаза.
В основе проявлений функциональной активности макрофагов и нейтрофилов лежит активация, которая индуцируется внешними стимулами (как правило, воздействием экзогенных молекул на мембранные рецепторы клеток) и реализуется с помощью цепи внутриклеточных сигналов, приводящих к изменению метаболических процессов и активности генов.
Механизмы активации нейтрофилов и макрофагов в общих чертах сходны, хотя имеются и определенные различия.
Активирующими стимулами для фагоцитов служат факторы, взаимодействующие с рецепторными структурами клеток:
- бактериальные продукты, в частности липополисахариды;
- цитокины, среди которых в качестве активатора наиболее эффективен интерферон-у (ИФН-у);
- активированные компоненты комплемента, их фрагменты;
- тканевые полисахариды, в частности содержащие концевую маннозу;
- прилипание к различным поверхностям, происходящее с участием адгезивных молекул поверхности макрофагов, а также процесс фагоцитоза;
- любые другие факторы, вызывающие активацию протеинкиназы С и повышение содержания Са2+ в клетке (в модельных опытах in vitro - сочетание форболмиристатацетата и ионофоров кальция).
Процесс активации в ряде случаев разделяется на два этапа: прайми- рование и запуск. Праймирующими агентами могут служить ИФН-у и гра- нулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), которые облегчают проявление активации под действием пускового агента
- липополисахарида. На молекулярном уровне эффект праймирования трактуется как процесс, приводящий к активации протеинкиназы С (вследствие накопления 1,2-диацилглицерина) без мобилизации Са2+, то есть как
неполный сигнал. Последующее воздействие липополисахарида завершает
2_|_
формирование сигнала путем мобилизации Са с участием 1,4,5- инозитолтрифосфата - продукта расщепления фосфатидилинозитол-4,5- дифосфата. Активация может осуществляться и одномоментно вследствие одновременного прохождения обоих внутриклеточных процессов. Основные проявления активации макрофагов следующие:
- «кислородный взрыв», накопление свободных радикалов;
- генерация окиси азота;
- изменение активности ряда ферментов, не связанных с кислородным и азотным метаболизмом;
- усиление синтеза ^-молекул (продуктов генов главного комплекса гистосовместимости (МНС) II класса) и их экспрессии;
- усиление синтеза и секреции цитокинов (интерлейкина-1 (ИЛ-1)), фактора некроза опухоли-а (ФНО-а) и т.д.) и других биологически активных молекул;
- повышение фагоцитарной активности и эффективности фагоцитоза;
- увеличение противоопухолевой активности;
- повышение способности обрабатывать антиген и представлять его Т- лимфоцитам;
- проявление регуляторной активности при иммунном ответе.
Основная часть перечисленных проявлений наблюдается и при активации нейтрофилов. Это относится, в частности, к кислородному взрыву, некоторым изменениям метаболизма и повышению фагоцитарной активности.
Кислородный, или дыхательный, взрыв - это процесс образования продуктов частичного восстановления кислорода, свободных радикалов, перекисей и других продуктов, обладающих высокой антимикробной активностью (рис. 54). Образование этих метаболитов в своей основе имеет усиление потребления глюкозы и ее расщепление с участием НАДФ+ по механизму гексозомонофосфатного шунта, что сопровождается накоплением НАДФН. Взаимодействие НАДФН с молекулой кислорода в клеточной мембране при участии НАДФН-оксидазы приводит к генерации супероксид-аниона (О2-).
НАДФН-зависимая оксидаза - это мультикомпонентная система, представляющая собой часть дыхательной цепи митохондрий и состоящая в исходном неактивном состоянии из флавопротеида и цитохрома Ь558. Компонентами НАДФН-оксидазы являются четыре белка, которые образуют фермент после того, как собираются вместе в клеточной мембране. Два из них - белки с молекулярными массами 91000 и 22000 - относятся к мембранным белкам и образуют гетеродимер цитохрома Ь558. Два других белка с молекулярными массами 47000 и 67000 являются цитоплазматическими. Они соединяются с цитохромом b558 после активации фагоцита. В результате возникает НАДФН-оксидаза, необходимая для образования перекиси водорода. При хронической гранулематозной болезни образование перекиси водорода лейкоцитами резко снижено. Гены, мутации которых приводят к каждому из перечисленных дефектов, клонированы, их нуклеотидная последовательность расшифрована. В активации этой системы участвуют фосфолипазы и протеинкиназа С, активируемые теми же пусковыми агентами.
Компоненты НАДФН-зависимой оксидазы - флавопротеид и цитохром Ь558 в нейтрофилах образуют в плазматической мембране непрочный комплекс, который солюбилизируется при действии детергентов. Однако после активации фагоцитов этот комплекс становится значительно более прочным. Причиной такой трансформации оксидазы при активации клеток является встраивание в ее состав двух цитозольных факторов, которые после их фосфорилирования диффундируют из цитозоля и адгезиру- ются на плазматической мембране в районе расположения b-субъединицы цитохрома Ь558. Механизм встраивания цитозольных компонентов в НАДФН-оксидазу в плазматической мембране не известен. Однако можно сказать, что это происходит в процессе активации оксидазы. Встраивание цитозольных белков и активация НАДФН-оксидазы зависели от концентрации стимулятора, времени стимуляции и температуры среды. Наблюдалась хорошая корреляция между уровнем образования активных форм
кислорода (АФК) в процессе стимуляции клеток и скоростью транслокации цитозольных факторов на плазматическую мембрану гранулоцитов.
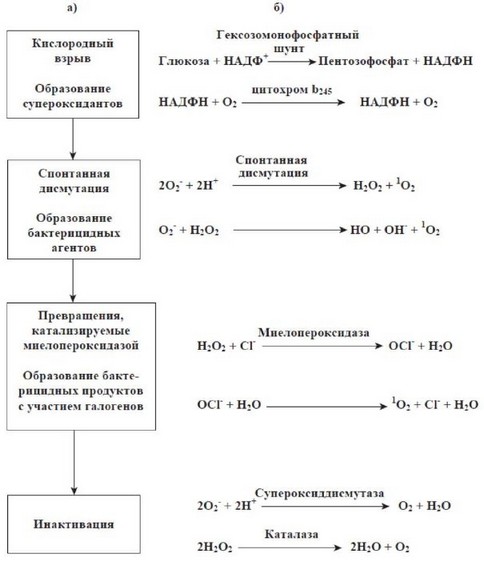
Рис. 54. Кислородзависимые процессы в фагоцитах, приводящие к образованию бактерицидных субстанций.
Примечание: а) - основные стадии превращений продуктов кислородного взрыва; б) - химические реакции, составляющие их основу.
А так же в разделе «Метаболизм гранулоцитов и макрофагов в состоянии относительного покоя и при фагоцитозе »
- Особенности метаболизма клетки в норме и при патологии
- Энергетическое звено метаболизма
- Пластическое звено метаболизма
- Утилизации продуктов метаболизма
- Метаболические механизмы реактивности клеток иммунной системыИзменение метаболизма в лимфоцитах в процессе их функционирования в норме и при патологии
- Значение оксидоредуктаз в системе внутриклеточного метаболизма
- 2.4. Роль витаминов в системе клеточного метаболизма Межвитаминные взаимоотношения
- Глава 3 ВИТАМИНЫ И НАРУШЕНИЯ ФУНКЦИИ ИММУННОЙ СИСТЕМЫ
- Витаминная недостаточность и их клинические проявления
- Клиническая картина гиповитаминозов Гиповитаминоз A
- Гиповитаминоз В1
- Гиповитаминоз В2
- Гиповитаминоз В6
- Г иповитаминоз фолиевой кислоты (В9)
- Гиповитаминоз В12
- Гиповитаминоз C
- Гиповитаминоз D
- Гиповитаминоз E
- Недостаточность карнитина
- Лабораторные методы исследования витаминов Определение аскорбиновой кислоты в моче по Тильмансу
- Определение рибофлавина (витамина В2) в крови по Берчугу, Бессею и Лоури
- Определение рибофлавина (витамина В2) в моче по Е.М. Масленниковой и Л.Г. Г воздовой
- Определение 4-пиридоксиловой кислоты в моче по Хуффу и Перлцвейгу
- 3.4.8. Определение токоферола (витамина Е) в крови в модификации Фридемана