Местные причины
За последние 25 лет все большее число зарубежных исследователей считают ведущими в этиологии и патогенезе заболеваний пародонта местные причины. Оформилась концепция, согласно которой полость рта рассматривается как сбалансированная биологическая система, а заболевания пародонта — в большинстве случаев как результат нарушения равновесия между бактериальным симбиозом и тканями полости рта. G. Cowley и Т. Macphee (1969) считают, что ключом к изучению этиологии заболеваний пародонта являются три группы факторов: 1) состояние и продукты обмена в зубной бляшке и зубном налете; 2) факторы полости рта, способные усиливать или ослаблять патогенетический потенциал микроорганизмов и продуктов их обмена; 3) общие факторы, регулирующие метаболизм тканей полости рта, от которых зависит ответная реакция на патогенные воздействия.
В литературе существуют различные обозначения зубных отложений, однако чаще других используется термин «бляшка». Г.Н. Пахомов (1982) различает две основные группы зубных отложений — неминерализованные и минерализованные и шесть видов зубных отложений. В пародонто- логии, на наш взгляд, наибольшее значение имеют четыре образования: из неминерализованных отложений зубная бляшка и мягкий зубной налет (белое вещество), из мине-
рализованных — наддесневой и поддесневой зубные камни. Таким образом, в структурном отношении зубной камень образуется на основе зубной бляшки за счет минерализаци- и последней. Минеральные компоненты (кальций, фосфор, магний, карбонаты, микроэлементы) наддесневого зубного камня слюнного происхождения, а десневая жидкость является источником поступления минералов для поддесневого камня.
Л.Т. Малышкина (1979), изучая ультраструктуру светлого и темного зубного камня, показала, что поверхность зубного камня, контактирующая со слюной, покрыта бактериальным налетом, тесно связанным со структурой камня. Наддесневой зубной камень состоит из трех зон: 1) зоны бактериального налета без признаков минерализации; 2) промежуточной зоны, представленной глубокими слоями зубного налета, где в совокупности с отдельными кристаллами бактерии образуют центры минерализации; 3) зоны собственно наддесневого зубного камня. Усиление активности щелочной фосфатазы, аминотрансфераз в слюне при образовании зубного камня связано с преципитацией солей кальция из слюны. Повышение в бактериальной бляшке активности щелочной фосфатазы и альдолазы на определенных этапах ее образования, высокое содержание АТФ в зубном налете и слюне при наличии светлого, промежуточного и темного зубного камня указывают на роль зубного налета наряду со слюной в образовании зубного камня. Более высокая активность фосфатаз, аминотрансфераз зубных отложений по сравнению со слюной позволяет считать, что наддесневые зубные отложения в известной мере являются источниками поступления ферментов в смешанную слюну. Поданным Л.Т. Малышкиной, морфологические и биохимические различия светлого и темного наддесневого зубного камня отражают различные стадии образования твердых наддесневых отложений. В соответствии с этим светлый зубной камень можно расценивать как начальный этап образования камня, а темный — как конечный.
Большинство зарубежных исследователей (Bouysson М., 1969; Waerhaug J., 1976; Orsos F., 1980; Gangler P., 1984, и др.) развитие воспалительных изменений в пародонте объясняют влиянием зубной бляшки. Она содержит большое количество микробов: от 100 до 300 млн в 1 мг зубного налета. Скорость роста зубной бляшки зависит непосредственно от количества углеводов в пище. Максимальная скорость роста отмечается при поступлении сахарозы, затем глюкозы и фруктозы; исключение составляет рафиноза. Сахара являются источниками синтеза интра- и экстрацел- люлярных полисахаридов кокковыми микроорганизмами (Carlsson Н., Egelberg J., 1965).
Н. Ьоё и соавт. (1965) у лиц, не соблюдавших правила гигиены полости рта, выявили в зубном налете различное содержание представителей микрофлоры в зависимости от времени культивирования (табл. 4).
Зубная бляшка, продвигаясь по мере роста под десневой край, вызывает раздражение тканей за счет микроорганизмов и их токсинов, что в дальнейшем приводит к повреждению эпителия десневого кармана и воспалению прилежащих тканей.
На состояние тканей пародонта оказываюг влияние продукты жизнедеятельности микробов — токсины. Экзотоксины — производные грамположительной микрофлоры — являются обычными для полости рта и не имеют выраженного патогенетического потенциала. Эндотоксины — производные грамотрицательной микрофлоры — устойчивы к температурным воздействиям, проявляют агрессивное действие в месте бактериальной аппликации, стимулируют формирование антител, вызывают вазомоторные расстрой-
Таблица 4
Состав микрофлоры зубного налета
ства, нарушают клеточный обмен, сопровождающийся гипергликемией с последующей гипогликемией, приводят к геморрагическому некрозу.
Нарушение целостности эпителия — наиболее важная деталь в генезе воспаления десны. В результате действия ферментов (гиалуронидаза, хондроитинсульфатаза, протеаза, глюкуронидаза, коллагеназа) производных нескольких видов микроорганизмов полости рта — отмечается деполимеризация гликозаминогликанов основного вещества, вследствие чего становится возможной инвазия эндотоксинов в ткани. Протеазы больше, чем другие ферменты, разрушают коллаген. Коллагеназа играет важную роль, но не является, по-видимому, основной, так как под влиянием кислой среды быстро теряет свойства (Schultz-Haudt S., 1964). Н. Matis (1976), наоборот, считает, что коллаген в основном разрушается под действием коллагеназы.
Гингивит является типичной реакцией воспаления соединительной ткани в ответ на деятельность микрофлоры зубного налета, которая приводит к необратимым повреждениям зубодесневого эпителия. Если лечение не проводится, то гингивит как первичное заболевание с прогрессирующим течением переходит в пародонтит, что имеет решающее значение для потери зубов. За исключением редко встречающихся воспалительных процессов, обусловленных травмой, гингивит имеет инфекционное происхождение, причем в составе местной микрофлоры преобладают анаэробы и актиномицеты. Патогенность микрофлоры в постоянно углубляющемся зубодесневом кармане, где имеются оптимальные условия для накопления зубного налета, играет главную роль в процессе прогрессирования гингивита и перехода его в пародонтит. Различные виды воспаления десны и соответствующие им формы гингивитов, по-видимому, обусловлены только индивидуальной реактивностью больного.
Один из возможных механизмов развития воспаления пародонтальных тканей схематично можно представить следующим образом:
Какова же действительно роли микробной флоры зубной бляшки в этиологии и патогенезе заболеваний пародонта? По нашему мнению, она должна оцениваться в соответствии с нозологическими формами поражения пародонта. Многие отечественные авторы (Евдокимов А.М., 1967; Рыбаков А.И., 1967; Ребреева Л.Н., Кускова В.Ф., 1967; Данилевский Н.Ф. Колесова Е.А., 1975, и др.) считают, что первично вследствие поражения сосудов и микроциркуляр- ных расстройств возникают дистрофические изменения тканей пародонта, а микрофлора полости рта на фоне снижения барьерной функции пародонта вызывает воспалительный процесс, который при наличии первичной дистрофии способствует прогрессированию деструктивных изменений пародонтальных тканей. Следовательно, микробам при данной патологии (дистрофически-воспалительная форма пародонтоза) отводится роль вторичного звена патогенетических механизмов заболевания.
При гингивите и генерализованном прогрессирующем пародонтите большинство зарубежных авторов (Mergenha- gen S., 1967, 1970; Simon J. et al., 1970; Page R., Schroe- der H., 1973; Snyderman R., 1973; Ьоё H., 1973; Krupin- ska A., 1976, и др.), как отмечают В.В. Хазанова и Е.А. Земская (1975), В.В. Хазанова (1979), Н. Ьоё (1984), расценивают зубодесневой налет как причину воспалительно-деструктивных изменений в тканях пародонта.
Поскольку многие авторы не без основания считают зубные отложения одной из основных причин развития заболеваний пародонта, низкое гигиеническое состояние полости рта является одним из ведущих этиологических факторов. При изучении в течение пяти лет влияния как недостаточного соблюдения правил гигиены полости рта, так и наличия зубного камня на развитие заболеваний пародонта, частоту и глубину зубодесневых карманов у 800 рабочих и служащих в возрасте от 20 до 59 лет отмечена прямая зависимость частоты гингивита от гигиенического состояния полости рта. Среди лиц, плохо и удовлетворительно соблюдавших правила гигиены полости рта, гингивит обнаруживался у 80 %, при надлежащем выполнении этих правил — у 20 %.
Н. Ьоё и соавт. (1965) в экспериментах установили прямую зависимость между формированием зубной бляшки и развитием гингивита у лиц со здоровыми деснами. В работе указывается, что гингивит развивается через 15—21 день при полном несоблюдении гигиены полости рта. На роль гигиены полости рта как этиологического фактора в развитии заболеваний пародонта указывают и ряд других авторов (Бульда И.Д., Н Kotzschke, I. Glickman и др.). В работах Г.И. Кадниковой (1975), J. Ericksson (1973), A. Rizzo (1973) и др. показано, что контролируемая чистка зубов и применение хлоргексидина для полоскания не только дают лечебный эффект при гингивите, но и могут быть использованы для профилактики этого заболевания.
Особое значение в этиологии заболеваний пародонта имеет слюна (ее состав и свойства, скорость секреции, влияющая на накопление зубного налета, его химический состав, кальцификация). Кроме того, известно, что слюна растворяет составные части пищи и осуществляет их ферментативное расщепление. Согласно одной из теорий формирования зубного камня, микроорганизмы зубной бляшки способны вырабатывать из мочевины слюны (в местах ее застоя) аммиак, в результате чего ощелачивается окружающая среда и выпадают в осадок компоненты зубного камня.
В смешанной слюне обнаружено около 30 ферментов: амилаза, бета-глюкуронидаза, лизоцим, кислая и щелочная фосфатазы, алистераза, липаза, ацетилхолинэстераза, псевдохолинэстераза, каталаза, пероксидаза, сукциндегидроге- наза, ангидраза, альдолаза и др. Роль всех этих энзимов в развитии заболеваний пародонта полностью не выяснена, но она несомненна. Описана патология пародонта — акаталазия, развивающаяся вследствие недостатка каталазы в слюне и тканях (Takahara R. et al., 1960).
Р. Brandstzaeg (1964) показал, что слюнные иммуноглобулины, адсорбируясь на бактериях, обитающих в полости рта, действуют по принципу реакции антитело — антиген.
Секреторный IgA из околоушной железы действует аг- глютинирующе на поверхность определенных микробов.
S. Mergenhagen и соавт. (1961) установили, что слюна из околоушной слюнной железы содержит антитела, которые разрушают бактерии полости рта. Как отмечает С. Gibbons (19б4), лизоцим малоэффективен в отношении микроорганизмов полости рта, однако автор полагает, что лизоцим действует синергично с другими факторами, такими, как иммунобактериологическая система жидкости десневого кармана, гидролитические энзимы, в результате чего происходит лизис бактерий путем гидролиза связей между N-ацетилмурамовой кислотой, N-ацетилглюкозамином и полисахаридами клеточной оболочки бактерий.
L. Jwamoto и соавт. (1961) предполагают, что слюнная пероксидаза играет важную роль в экологии зубной бляшки. Смешанная слюна содержит две пероксидазы, которые способны задерживать бактериальный рост (большая пероксидаза — производное слюны, малая — лейкоцитов). Оба этих фермента сходны с лактопероксидазой, которая в определенных условиях полностью ингибирует гексокиназу и другие гликолитические энзимы. Помимо того, слюнная пероксидаза оказывает антибактериальное действие на лактобациллы и стрептококки.
Иммунологические аспекты воспаления. Длительный контакт между микробами зубной бляшки и тканями пародонта чреват возникновением аутоиммунных процессов, которые могут обусловливать цеп-
ную реакцию, сопровождающуюся прогрессирующими альтернативными изменениями тканей пародонта. В связи с этим широко изучаются микробная флора зубодесневых карманов, возможность микробной аллергизации организма и развития аутоиммунологических реакций. Исследование видового состава микроорганизмов содержимого зубодесневых карманов показало, что основную роль в развитии воспаления пародонтальных тканей играют стрептококки и стафилококки. Значительное место отводится бактероидам, фузобактериям, вейлонеллам, спирохетам и др.
Изучая роль патогенных стафилококков в воспалительных и аллергических реакциях при пародонтозе с помощью обнаружения антител к патогенным стафилококкам и другой микрофлоре пародонтального кармана, Л.В. Ларионова (1974) у 80 ± 15 % больных гнойно-воспалительную реакцию связывает с действием патогенных стафилококков. Кроме того, она определила высокий уровень антител к патогенным стафилококкам в сыворотке крови больных пародонтозом до лечения (в 10 раз выше титра сывороток здоровых людей).
По мнению L. Stetson (1961), не первичная биологическая активность эндотоксинов, а циркуляция выработанных ими антител (комплексов) имеет значение в нарушении реакции тканей. Как полагает Н. Slavkin (1976), в период це- ментогенеза в составе цемента появляются дериваты белков эмали, которые могут быть антигенами и вызвать аутоиммунный ответ. При агрессивном течении патологии пародонта с выраженной деструкцией цемента происходит деминерализация его, в связи с чем белки эмали могут быть демаскированы и не распознаны иммунными системами. В этом случае они становятся антигенами и развивается аутоиммунный процесс, вызывающий усиление воспалительной реакции.
A. Rizzo и S. Mergenhagen (1964), используя методику получения феномена Шварцмана (вводился эндотоксин, приготовленный из В. veillinella бляшки), экспериментально получили характерную для указанного феномена картину с обширными инфильтратами. Тяжесть поражения десны зависела от степени вирулентности микроорганизмов бляшки (Loe Н. et al., 1965). На то, что микрофлора, ее ферменты способны аллергизировать ткани полости рта и вызывать в них реакции типа аллергического феномена Артюса и Шварцмана, указывал G. Gus-
tafson (1968). Известно, что в патогенезе реакции Шварцмана принимают участие ферменты лизосом полиморфно-ядерных лейкоцитов.
С помощью электронной микроскопии в тканях десны человека, поврежденных эндотоксином, Н. Freedman и со- авт. (1967) наблюдали своеобразную дегрануляцию полиморфно-ядерных лейкоцитов, сопровождающуюся выталкиванием лизосом из клеток. Ферменты и другие продукты лизосомного происхождения вступают во взаимодействие с окружающими структурами, что, по-видимому, приводит к нарушению проницаемости гистогематических барьеров, вызывая или усиливая явление альтерации.
Важно отметить, что вследствие повышенной проницаемости гистогематических барьеров бактериальные антигены проходят через эпителиальное прикрепление, являющееся серьезным тканевым барьером. Вырабатываемые микробами бактериальной бляшки ферменты, обладая литическими свойствами, обуславливают альтернативные изменения (разрежение межклеточных связей клеток), что в конечном итоге способствует образованию зубодесневого кармана.
J. Simon и соавт. (1972) и др., могут сопровождаться общими иммунологическими сдвигами в организме.
Что касается механизмов иммунологического воздействия антигенных компонентов микробной бляшки, то, по данным R. Snyderman и соавт. (1971), эндотоксины микробов приводят в действие такие эффекторные системы организма, как комплемент, кинины и другие медиаторы иммунитета. При этом полиморфно-ядерные лейкоциты в результате хемотаксиса скапливаются в области воспаления. S. Mergenhagen и соавт. (1970), J. Thonard (1976), говоря о механизме иммунологического воздействия антигенов микробной бляшки, считают, что полиморфно-ядерные лейкоциты, помимо выделения альтерирующих ткани ферментов, с помощью хемотаксической реакции привлекают к области поражения иммунокомпетентные клетки, вырабатывающие антитела. В этой реакции значительная роль отводится комплементу, являющемуся важным медиатором в воспалительном процессе.
В настоящее время общеизвестно, что реакция связывания комплемента складывается из последовательных этапов взаимодействия 9 отдельных компонентов. Хотя конечным этапом последовательных реакций всех компонентов является лизис микробных клеток, эритроцитов, не следует забывать, что при данном процессе образуются важные побочные продукты, имеющие прямое отношение к воспалению. Повышение проницаемости сосудов, изменение хемотакси- ческой реакции полиморфно-ядерных лейкоцитов, появление отека десны — все это способствует аккумуляции и внедрению новой порции бактериальных антигенов зубной бляшки, которые вновь атакуют иммунную систему организма. Хемотаксис вызывается бактериальной бляшкой так же, как и механизм реакции антиген — антитело и комплементарной системы. В этой реакции действуют клеточный и гуморатьный иммунные механизмы. Наиболее важными антигенами являются мукопептиды клеточной оболочки грамположительных и липополисахариды (эндотоксины) грамотрицательных бактерий. Белки, продуцируемые бактериями, также могут функционировать как антигены.
Наиболее подробные сведения о роли состава бактериальной зубной бляшки, проникновении бактериальных продуктов в ткани пародонта, ответной реакции полиморфноядерных лейкоцитов (и их дегрануляции), макрофагов, лимфоцитов, иммуноглобулинов, комплемента и специфических антител, а также иммунного ответа организма приведены W. Wilton и Т. Lehner (1983). Нельзя не согласиться с ними, что иммунные механизмы ответа на влияние ингредиентов бактериальной бляшки довольно сложны и окончательно не изучены. В частности, неясно, какому из четырех известных типов иммунного ответа принадлежит главенствующая роль в развитии заболевания пародонта.
К местным травматическим (ятрогенным) причинам относятся дефекты протезирования (коронка, глубоко продвинутая под десну, базис съемного протеза, сдавливающий десневые сосочки, и др.), дефекты лечения зубов (избыток амальгамы или цемента и попадание мышьяковистой пасты в межзубной промежуток, воздействие мономера пломб и протезов), вредное влияние неправильно сконструированных ортодонтических аппаратов.
Из причин, способствующих появлению зубного налета, необходимо указать на анатомические особенности зубов (аномалии формы, размеров и др.), их неправильное расположение в зубной дуге и кариозные поражения. Эти причины могут вызвать папиллит, гингивит, реже более глубокие изменения пародонта (пародонтит), причем поражения, как правило, носят локальный характер.
Перегрузка тканей пародонта, как показывают эксперименты и клинические наблюдения, вызывает комплекс патологических изменений в тканях пародонта с преобладанием воспалительных и дистрофических явлений (В.Ю. Курляндский, Х.А. Каламкаров и др.). Деструктивно-воспалительные процессы вследствие перегрузки пародонта могут наблюдаться при аномалиях прикуса (глубокий прикус, глубокое резцовое перекрытие, открытый, прогнатический, прогенический прикус и др.), аномалиях положения зубов (скученность зубов), ранней потере моляров и премоляров, после удаления большого количества зубов (постэкстракционные передвижения зубов), при неправильном определении показаний к мосто- видному протезированию, неправильно сформированном преддверии полости рта, после хейло- и уранопластики, при бруксизме (скрежетание зубами во сне) и др. (рис. 8).
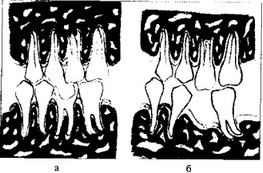
Рис. 8. Изменение пародонта вследствие постэкстракционного перемещения зубов (схема): а — до потери первого нижнего моляра; б — после его потери
чяг
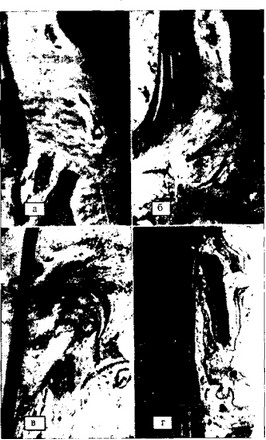
Характерно, что ткани пародонта (связочный аппарат, кость) сравнительно хорошо переносят вертикальную перегрузку и значительно хуже горизонтальную. Превышение адаптационных возможностей пародонта может привести к нарушению его кровоснабжения и в дальнейшем к резорбции костной ткани. При этом морфологическим субстратом развивающихся в пародонте дистрофических изменений является вначале тромбоз сосудов кости, а в дальнейшем развивается ее резорбция. При травматических поражениях пародонта клинические и рентгенологические изменения локализуются обычно в области отдельных зубов или их групп (рис. 9).
Перегрузка пародонта всегда сопровождается изменениями гидростатического давления крови в сосудах, крово- и лимфотока и как следствие этого появлением гемо- и лим- фостазов, нарушением проницаемости гистогематических барьеров (ГТБ) периваскулярным отеком, диападезом форменных элементов крови, агрегацией эритроцитов, эмболией и, наконец, тромбозом сосудов. Развиваются явления гипоксии. Все это не может не сказаться на структуре па- родонтальных тканей. Вследствие нарушения фиксирующей функции коллагеновых и эластичных волокон периодонта возникает подвижность зубов, их болезненность при надкусывании.

Рис. 9. Изменение пародонта при окклюзионной травме: а — тромбоз сосудов, X 100; б — дегенерация пародонта, X 100; в — гиалиновая дегенерация периодонта, X 100; г — разрыв волокон периодонта, X 100 (Thoma М., Goldman Н., 1964); д — костный карман, образовавшийся вследствие окклюзионной травмы (рентгенограмма)
В дальнейшем отмечается не только набухание коллагеновых волокон, но также их деструкция. Нарушается целость эпителиального покрова в области зубодесневого соединения, образуется карман, а затем вследствие инфекции десневой щели, пролиферации и погружного роста эпителия развиваются воспалительные явления. В дальнейшем воспалительно-деструктивный процесс приводит к резорбции межзубных костных перегородок.
Таким образом, травматические факторы могут быть причиной локализованных, но не генерализованных поражений пародонта. Вместе с тем перегрузка отдельных зубов в значительной степени усугубляет течение генерализованных процессов, усиливая воспалительные и атрофически- резорбтивные процессы в околозубных тканях, способствуя разрушению связочного аппарата и в конечном итоге элиминации зубов.
Функциональная недостаточность может быть причиной заболевания пародонта. Недостаточность функции жевания является порождением современной цивилизации. Тщательно обработанная, мягкая пища лишает ткани пародонта полноценной нагрузки, вследствие чего могут развиваться атрофические процессы. Кроме того, такая пища содействует образованию зубных отложений, нередко являющихся единственной причиной воспаления маргинального пародонта. При этом существенное значение имеет индивидуальная предрасположенность к заболеванию пародонта. Другой вариант функциональной недостаточности — локальная, например в отсутствии антагонистов, при открытом прикусе и т. д. Недостаток функции жевательного аппарата снижает резистентность тканей пародонта к внешним воздействиям (микробы, травма) и одновременно способствует отложению зубного камня. В связи с этим при функциональной недостаточности чаще всего развиваются воспалительные изменения в тканях пародонта.
Недогрузка группы зубов или отдельных зубов оказывает неблагоприятное влияние на пародонт. R. Ктоп- feld (1955) и I. Glickman (1967) утверждали, что в пародон- те зубов со сниженной функцией развивается дистрофический процесс с поражением коллагеновых волокон периодонта и атрофией прилежащей костной ткани. Согласно теории функциональной патологии зубочелюстной системы Курляндского, в результате частичной адентии пародонт распадается на отдельные разнофункционирующие звенья (функционирующий центр, травматический узел и нефункционирующее звено). В пародонте разнофункционирующих, в том числе недогруженных, зубов развиваются деструктивные процессы.
Влияние бляшки и зубного камня на ткани пародонта нельзя считать чисто местной причиной, ибо их образование и активность зависят от состояния реактивности организма (изменение минерального и белкового состава слюны, десневой жидкости, их ферментативной активности, иммуноглобулинов, кининовой системы и т. д.). Уместно напомнить, что деление на общие и местные факторы носит искусственный характер, ибо, хотя местные факторы могут выступать как организаторы патологического процесса, ответная реакция организма всегда обусловлена общими факторами.
В литературе существуют различные обозначения зубных отложений, однако чаще других используется термин «бляшка». Г.Н. Пахомов (1982) различает две основные группы зубных отложений — неминерализованные и минерализованные и шесть видов зубных отложений. В пародонто- логии, на наш взгляд, наибольшее значение имеют четыре образования: из неминерализованных отложений зубная бляшка и мягкий зубной налет (белое вещество), из мине-
рализованных — наддесневой и поддесневой зубные камни. Таким образом, в структурном отношении зубной камень образуется на основе зубной бляшки за счет минерализаци- и последней. Минеральные компоненты (кальций, фосфор, магний, карбонаты, микроэлементы) наддесневого зубного камня слюнного происхождения, а десневая жидкость является источником поступления минералов для поддесневого камня.
Л.Т. Малышкина (1979), изучая ультраструктуру светлого и темного зубного камня, показала, что поверхность зубного камня, контактирующая со слюной, покрыта бактериальным налетом, тесно связанным со структурой камня. Наддесневой зубной камень состоит из трех зон: 1) зоны бактериального налета без признаков минерализации; 2) промежуточной зоны, представленной глубокими слоями зубного налета, где в совокупности с отдельными кристаллами бактерии образуют центры минерализации; 3) зоны собственно наддесневого зубного камня. Усиление активности щелочной фосфатазы, аминотрансфераз в слюне при образовании зубного камня связано с преципитацией солей кальция из слюны. Повышение в бактериальной бляшке активности щелочной фосфатазы и альдолазы на определенных этапах ее образования, высокое содержание АТФ в зубном налете и слюне при наличии светлого, промежуточного и темного зубного камня указывают на роль зубного налета наряду со слюной в образовании зубного камня. Более высокая активность фосфатаз, аминотрансфераз зубных отложений по сравнению со слюной позволяет считать, что наддесневые зубные отложения в известной мере являются источниками поступления ферментов в смешанную слюну. Поданным Л.Т. Малышкиной, морфологические и биохимические различия светлого и темного наддесневого зубного камня отражают различные стадии образования твердых наддесневых отложений. В соответствии с этим светлый зубной камень можно расценивать как начальный этап образования камня, а темный — как конечный.
Большинство зарубежных исследователей (Bouysson М., 1969; Waerhaug J., 1976; Orsos F., 1980; Gangler P., 1984, и др.) развитие воспалительных изменений в пародонте объясняют влиянием зубной бляшки. Она содержит большое количество микробов: от 100 до 300 млн в 1 мг зубного налета. Скорость роста зубной бляшки зависит непосредственно от количества углеводов в пище. Максимальная скорость роста отмечается при поступлении сахарозы, затем глюкозы и фруктозы; исключение составляет рафиноза. Сахара являются источниками синтеза интра- и экстрацел- люлярных полисахаридов кокковыми микроорганизмами (Carlsson Н., Egelberg J., 1965).
Н. Ьоё и соавт. (1965) у лиц, не соблюдавших правила гигиены полости рта, выявили в зубном налете различное содержание представителей микрофлоры в зависимости от времени культивирования (табл. 4).
Зубная бляшка, продвигаясь по мере роста под десневой край, вызывает раздражение тканей за счет микроорганизмов и их токсинов, что в дальнейшем приводит к повреждению эпителия десневого кармана и воспалению прилежащих тканей.
На состояние тканей пародонта оказываюг влияние продукты жизнедеятельности микробов — токсины. Экзотоксины — производные грамположительной микрофлоры — являются обычными для полости рта и не имеют выраженного патогенетического потенциала. Эндотоксины — производные грамотрицательной микрофлоры — устойчивы к температурным воздействиям, проявляют агрессивное действие в месте бактериальной аппликации, стимулируют формирование антител, вызывают вазомоторные расстрой-
Таблица 4
Состав микрофлоры зубного налета
|
Характер микрофлоры |
Содержание микроорганизмов, % |
|
|
48 ч |
6—7 дней |
|
|
Кокки грамположительные |
38 |
10 |
|
Бациллы » |
40 |
22 |
|
Кокки грамотрицательные |
3 |
11 |
|
Бациллы » |
2 |
8 |
|
Нитевидные |
5 |
3 |
|
Спирохеты |
0,6 |
17 |
|
Вибрионы |
1 |
11 |
|
Актиномицеты |
4 |
2 |
|
Фузиформные бактерии |
7 |
15 |
|
Другие виды |
0,5 |
0,2 |
ства, нарушают клеточный обмен, сопровождающийся гипергликемией с последующей гипогликемией, приводят к геморрагическому некрозу.
Нарушение целостности эпителия — наиболее важная деталь в генезе воспаления десны. В результате действия ферментов (гиалуронидаза, хондроитинсульфатаза, протеаза, глюкуронидаза, коллагеназа) производных нескольких видов микроорганизмов полости рта — отмечается деполимеризация гликозаминогликанов основного вещества, вследствие чего становится возможной инвазия эндотоксинов в ткани. Протеазы больше, чем другие ферменты, разрушают коллаген. Коллагеназа играет важную роль, но не является, по-видимому, основной, так как под влиянием кислой среды быстро теряет свойства (Schultz-Haudt S., 1964). Н. Matis (1976), наоборот, считает, что коллаген в основном разрушается под действием коллагеназы.
Гингивит является типичной реакцией воспаления соединительной ткани в ответ на деятельность микрофлоры зубного налета, которая приводит к необратимым повреждениям зубодесневого эпителия. Если лечение не проводится, то гингивит как первичное заболевание с прогрессирующим течением переходит в пародонтит, что имеет решающее значение для потери зубов. За исключением редко встречающихся воспалительных процессов, обусловленных травмой, гингивит имеет инфекционное происхождение, причем в составе местной микрофлоры преобладают анаэробы и актиномицеты. Патогенность микрофлоры в постоянно углубляющемся зубодесневом кармане, где имеются оптимальные условия для накопления зубного налета, играет главную роль в процессе прогрессирования гингивита и перехода его в пародонтит. Различные виды воспаления десны и соответствующие им формы гингивитов, по-видимому, обусловлены только индивидуальной реактивностью больного.
Один из возможных механизмов развития воспаления пародонтальных тканей схематично можно представить следующим образом:
- Бактериальные эндотоксины + протеазы зубной бляшки и десневой жидкости.
- Дегрануляция тучных клеток (накопление серотонина, гистамина, гепарина) + изменение активности ферментов калликреин-кининовой системы и их ингибиторов.
- Дезинтеграция гликозаминогликанов — изменение проницаемости сосудов.
- Нарушение ресинтеза коллагена (изменение активности коллагеназы), изменение барьерной функции пародонта (местная реактивность) и общей реактивности организма.
Какова же действительно роли микробной флоры зубной бляшки в этиологии и патогенезе заболеваний пародонта? По нашему мнению, она должна оцениваться в соответствии с нозологическими формами поражения пародонта. Многие отечественные авторы (Евдокимов А.М., 1967; Рыбаков А.И., 1967; Ребреева Л.Н., Кускова В.Ф., 1967; Данилевский Н.Ф. Колесова Е.А., 1975, и др.) считают, что первично вследствие поражения сосудов и микроциркуляр- ных расстройств возникают дистрофические изменения тканей пародонта, а микрофлора полости рта на фоне снижения барьерной функции пародонта вызывает воспалительный процесс, который при наличии первичной дистрофии способствует прогрессированию деструктивных изменений пародонтальных тканей. Следовательно, микробам при данной патологии (дистрофически-воспалительная форма пародонтоза) отводится роль вторичного звена патогенетических механизмов заболевания.
При гингивите и генерализованном прогрессирующем пародонтите большинство зарубежных авторов (Mergenha- gen S., 1967, 1970; Simon J. et al., 1970; Page R., Schroe- der H., 1973; Snyderman R., 1973; Ьоё H., 1973; Krupin- ska A., 1976, и др.), как отмечают В.В. Хазанова и Е.А. Земская (1975), В.В. Хазанова (1979), Н. Ьоё (1984), расценивают зубодесневой налет как причину воспалительно-деструктивных изменений в тканях пародонта.
Поскольку многие авторы не без основания считают зубные отложения одной из основных причин развития заболеваний пародонта, низкое гигиеническое состояние полости рта является одним из ведущих этиологических факторов. При изучении в течение пяти лет влияния как недостаточного соблюдения правил гигиены полости рта, так и наличия зубного камня на развитие заболеваний пародонта, частоту и глубину зубодесневых карманов у 800 рабочих и служащих в возрасте от 20 до 59 лет отмечена прямая зависимость частоты гингивита от гигиенического состояния полости рта. Среди лиц, плохо и удовлетворительно соблюдавших правила гигиены полости рта, гингивит обнаруживался у 80 %, при надлежащем выполнении этих правил — у 20 %.
Н. Ьоё и соавт. (1965) в экспериментах установили прямую зависимость между формированием зубной бляшки и развитием гингивита у лиц со здоровыми деснами. В работе указывается, что гингивит развивается через 15—21 день при полном несоблюдении гигиены полости рта. На роль гигиены полости рта как этиологического фактора в развитии заболеваний пародонта указывают и ряд других авторов (Бульда И.Д., Н Kotzschke, I. Glickman и др.). В работах Г.И. Кадниковой (1975), J. Ericksson (1973), A. Rizzo (1973) и др. показано, что контролируемая чистка зубов и применение хлоргексидина для полоскания не только дают лечебный эффект при гингивите, но и могут быть использованы для профилактики этого заболевания.
Особое значение в этиологии заболеваний пародонта имеет слюна (ее состав и свойства, скорость секреции, влияющая на накопление зубного налета, его химический состав, кальцификация). Кроме того, известно, что слюна растворяет составные части пищи и осуществляет их ферментативное расщепление. Согласно одной из теорий формирования зубного камня, микроорганизмы зубной бляшки способны вырабатывать из мочевины слюны (в местах ее застоя) аммиак, в результате чего ощелачивается окружающая среда и выпадают в осадок компоненты зубного камня.
- Frostel (1960), определяя уролитическую активность зубной бляшки путем измерения количества аммиака — производного мочевины слюны, установил, что емкость (мощность) щелочных продуктов бляшки значительно больше, чем кислых. Автор указывает, что высокое содержание аммиака в зубной бляшке не играет существенной роли в развитии кариеса, но важно при заболеваниях пародонта. Зубной камень, собранный у таких больных, имел щелочную реакцию и выраженную способность вырабатывать аммиак. I. Mandel и N. Thopson (1965), определявшие содержание мочевины в слюне больных с обильными зубными отложениями и без них, нашли более высокое содержание мочевины в слюне подчелюстной железы и в сформированном зубном камне у больных с обильными зубными отложениями. Ю.А. Петрович (1959), анализируя результаты исследований различных авторов и собственных наблюдений, считает, что в основе усиленного образования зубного камня при пародонтозе лежит нарушение биохимических процессов в слюнных железах.
В смешанной слюне обнаружено около 30 ферментов: амилаза, бета-глюкуронидаза, лизоцим, кислая и щелочная фосфатазы, алистераза, липаза, ацетилхолинэстераза, псевдохолинэстераза, каталаза, пероксидаза, сукциндегидроге- наза, ангидраза, альдолаза и др. Роль всех этих энзимов в развитии заболеваний пародонта полностью не выяснена, но она несомненна. Описана патология пародонта — акаталазия, развивающаяся вследствие недостатка каталазы в слюне и тканях (Takahara R. et al., 1960).
Р. Brandstzaeg (1964) показал, что слюнные иммуноглобулины, адсорбируясь на бактериях, обитающих в полости рта, действуют по принципу реакции антитело — антиген.
Секреторный IgA из околоушной железы действует аг- глютинирующе на поверхность определенных микробов.
S. Mergenhagen и соавт. (1961) установили, что слюна из околоушной слюнной железы содержит антитела, которые разрушают бактерии полости рта. Как отмечает С. Gibbons (19б4), лизоцим малоэффективен в отношении микроорганизмов полости рта, однако автор полагает, что лизоцим действует синергично с другими факторами, такими, как иммунобактериологическая система жидкости десневого кармана, гидролитические энзимы, в результате чего происходит лизис бактерий путем гидролиза связей между N-ацетилмурамовой кислотой, N-ацетилглюкозамином и полисахаридами клеточной оболочки бактерий.
L. Jwamoto и соавт. (1961) предполагают, что слюнная пероксидаза играет важную роль в экологии зубной бляшки. Смешанная слюна содержит две пероксидазы, которые способны задерживать бактериальный рост (большая пероксидаза — производное слюны, малая — лейкоцитов). Оба этих фермента сходны с лактопероксидазой, которая в определенных условиях полностью ингибирует гексокиназу и другие гликолитические энзимы. Помимо того, слюнная пероксидаза оказывает антибактериальное действие на лактобациллы и стрептококки.
Иммунологические аспекты воспаления. Длительный контакт между микробами зубной бляшки и тканями пародонта чреват возникновением аутоиммунных процессов, которые могут обусловливать цеп-
ную реакцию, сопровождающуюся прогрессирующими альтернативными изменениями тканей пародонта. В связи с этим широко изучаются микробная флора зубодесневых карманов, возможность микробной аллергизации организма и развития аутоиммунологических реакций. Исследование видового состава микроорганизмов содержимого зубодесневых карманов показало, что основную роль в развитии воспаления пародонтальных тканей играют стрептококки и стафилококки. Значительное место отводится бактероидам, фузобактериям, вейлонеллам, спирохетам и др.
Изучая роль патогенных стафилококков в воспалительных и аллергических реакциях при пародонтозе с помощью обнаружения антител к патогенным стафилококкам и другой микрофлоре пародонтального кармана, Л.В. Ларионова (1974) у 80 ± 15 % больных гнойно-воспалительную реакцию связывает с действием патогенных стафилококков. Кроме того, она определила высокий уровень антител к патогенным стафилококкам в сыворотке крови больных пародонтозом до лечения (в 10 раз выше титра сывороток здоровых людей).
По мнению L. Stetson (1961), не первичная биологическая активность эндотоксинов, а циркуляция выработанных ими антител (комплексов) имеет значение в нарушении реакции тканей. Как полагает Н. Slavkin (1976), в период це- ментогенеза в составе цемента появляются дериваты белков эмали, которые могут быть антигенами и вызвать аутоиммунный ответ. При агрессивном течении патологии пародонта с выраженной деструкцией цемента происходит деминерализация его, в связи с чем белки эмали могут быть демаскированы и не распознаны иммунными системами. В этом случае они становятся антигенами и развивается аутоиммунный процесс, вызывающий усиление воспалительной реакции.
A. Rizzo и S. Mergenhagen (1964), используя методику получения феномена Шварцмана (вводился эндотоксин, приготовленный из В. veillinella бляшки), экспериментально получили характерную для указанного феномена картину с обширными инфильтратами. Тяжесть поражения десны зависела от степени вирулентности микроорганизмов бляшки (Loe Н. et al., 1965). На то, что микрофлора, ее ферменты способны аллергизировать ткани полости рта и вызывать в них реакции типа аллергического феномена Артюса и Шварцмана, указывал G. Gus-
tafson (1968). Известно, что в патогенезе реакции Шварцмана принимают участие ферменты лизосом полиморфно-ядерных лейкоцитов.
С помощью электронной микроскопии в тканях десны человека, поврежденных эндотоксином, Н. Freedman и со- авт. (1967) наблюдали своеобразную дегрануляцию полиморфно-ядерных лейкоцитов, сопровождающуюся выталкиванием лизосом из клеток. Ферменты и другие продукты лизосомного происхождения вступают во взаимодействие с окружающими структурами, что, по-видимому, приводит к нарушению проницаемости гистогематических барьеров, вызывая или усиливая явление альтерации.
Важно отметить, что вследствие повышенной проницаемости гистогематических барьеров бактериальные антигены проходят через эпителиальное прикрепление, являющееся серьезным тканевым барьером. Вырабатываемые микробами бактериальной бляшки ферменты, обладая литическими свойствами, обуславливают альтернативные изменения (разрежение межклеточных связей клеток), что в конечном итоге способствует образованию зубодесневого кармана.
- Aurer-Kozely (1971) даже обнаружил в экссудате десневых карманов факторы, приводящие к разрушению поврежденных лейкоцитов и клеток эпителиального прикрепления. Подобные местные изменения, по мнению М. Bouysson (1969),
J. Simon и соавт. (1972) и др., могут сопровождаться общими иммунологическими сдвигами в организме.
Что касается механизмов иммунологического воздействия антигенных компонентов микробной бляшки, то, по данным R. Snyderman и соавт. (1971), эндотоксины микробов приводят в действие такие эффекторные системы организма, как комплемент, кинины и другие медиаторы иммунитета. При этом полиморфно-ядерные лейкоциты в результате хемотаксиса скапливаются в области воспаления. S. Mergenhagen и соавт. (1970), J. Thonard (1976), говоря о механизме иммунологического воздействия антигенов микробной бляшки, считают, что полиморфно-ядерные лейкоциты, помимо выделения альтерирующих ткани ферментов, с помощью хемотаксической реакции привлекают к области поражения иммунокомпетентные клетки, вырабатывающие антитела. В этой реакции значительная роль отводится комплементу, являющемуся важным медиатором в воспалительном процессе.
В настоящее время общеизвестно, что реакция связывания комплемента складывается из последовательных этапов взаимодействия 9 отдельных компонентов. Хотя конечным этапом последовательных реакций всех компонентов является лизис микробных клеток, эритроцитов, не следует забывать, что при данном процессе образуются важные побочные продукты, имеющие прямое отношение к воспалению. Повышение проницаемости сосудов, изменение хемотакси- ческой реакции полиморфно-ядерных лейкоцитов, появление отека десны — все это способствует аккумуляции и внедрению новой порции бактериальных антигенов зубной бляшки, которые вновь атакуют иммунную систему организма. Хемотаксис вызывается бактериальной бляшкой так же, как и механизм реакции антиген — антитело и комплементарной системы. В этой реакции действуют клеточный и гуморатьный иммунные механизмы. Наиболее важными антигенами являются мукопептиды клеточной оболочки грамположительных и липополисахариды (эндотоксины) грамотрицательных бактерий. Белки, продуцируемые бактериями, также могут функционировать как антигены.
Наиболее подробные сведения о роли состава бактериальной зубной бляшки, проникновении бактериальных продуктов в ткани пародонта, ответной реакции полиморфноядерных лейкоцитов (и их дегрануляции), макрофагов, лимфоцитов, иммуноглобулинов, комплемента и специфических антител, а также иммунного ответа организма приведены W. Wilton и Т. Lehner (1983). Нельзя не согласиться с ними, что иммунные механизмы ответа на влияние ингредиентов бактериальной бляшки довольно сложны и окончательно не изучены. В частности, неясно, какому из четырех известных типов иммунного ответа принадлежит главенствующая роль в развитии заболевания пародонта.
К местным травматическим (ятрогенным) причинам относятся дефекты протезирования (коронка, глубоко продвинутая под десну, базис съемного протеза, сдавливающий десневые сосочки, и др.), дефекты лечения зубов (избыток амальгамы или цемента и попадание мышьяковистой пасты в межзубной промежуток, воздействие мономера пломб и протезов), вредное влияние неправильно сконструированных ортодонтических аппаратов.
Из причин, способствующих появлению зубного налета, необходимо указать на анатомические особенности зубов (аномалии формы, размеров и др.), их неправильное расположение в зубной дуге и кариозные поражения. Эти причины могут вызвать папиллит, гингивит, реже более глубокие изменения пародонта (пародонтит), причем поражения, как правило, носят локальный характер.
Перегрузка тканей пародонта, как показывают эксперименты и клинические наблюдения, вызывает комплекс патологических изменений в тканях пародонта с преобладанием воспалительных и дистрофических явлений (В.Ю. Курляндский, Х.А. Каламкаров и др.). Деструктивно-воспалительные процессы вследствие перегрузки пародонта могут наблюдаться при аномалиях прикуса (глубокий прикус, глубокое резцовое перекрытие, открытый, прогнатический, прогенический прикус и др.), аномалиях положения зубов (скученность зубов), ранней потере моляров и премоляров, после удаления большого количества зубов (постэкстракционные передвижения зубов), при неправильном определении показаний к мосто- видному протезированию, неправильно сформированном преддверии полости рта, после хейло- и уранопластики, при бруксизме (скрежетание зубами во сне) и др. (рис. 8).

Рис. 8. Изменение пародонта вследствие постэкстракционного перемещения зубов (схема): а — до потери первого нижнего моляра; б — после его потери

чяг
Характерно, что ткани пародонта (связочный аппарат, кость) сравнительно хорошо переносят вертикальную перегрузку и значительно хуже горизонтальную. Превышение адаптационных возможностей пародонта может привести к нарушению его кровоснабжения и в дальнейшем к резорбции костной ткани. При этом морфологическим субстратом развивающихся в пародонте дистрофических изменений является вначале тромбоз сосудов кости, а в дальнейшем развивается ее резорбция. При травматических поражениях пародонта клинические и рентгенологические изменения локализуются обычно в области отдельных зубов или их групп (рис. 9).
Перегрузка пародонта всегда сопровождается изменениями гидростатического давления крови в сосудах, крово- и лимфотока и как следствие этого появлением гемо- и лим- фостазов, нарушением проницаемости гистогематических барьеров (ГТБ) периваскулярным отеком, диападезом форменных элементов крови, агрегацией эритроцитов, эмболией и, наконец, тромбозом сосудов. Развиваются явления гипоксии. Все это не может не сказаться на структуре па- родонтальных тканей. Вследствие нарушения фиксирующей функции коллагеновых и эластичных волокон периодонта возникает подвижность зубов, их болезненность при надкусывании.

Рис. 9. Изменение пародонта при окклюзионной травме: а — тромбоз сосудов, X 100; б — дегенерация пародонта, X 100; в — гиалиновая дегенерация периодонта, X 100; г — разрыв волокон периодонта, X 100 (Thoma М., Goldman Н., 1964); д — костный карман, образовавшийся вследствие окклюзионной травмы (рентгенограмма)
В дальнейшем отмечается не только набухание коллагеновых волокон, но также их деструкция. Нарушается целость эпителиального покрова в области зубодесневого соединения, образуется карман, а затем вследствие инфекции десневой щели, пролиферации и погружного роста эпителия развиваются воспалительные явления. В дальнейшем воспалительно-деструктивный процесс приводит к резорбции межзубных костных перегородок.
Таким образом, травматические факторы могут быть причиной локализованных, но не генерализованных поражений пародонта. Вместе с тем перегрузка отдельных зубов в значительной степени усугубляет течение генерализованных процессов, усиливая воспалительные и атрофически- резорбтивные процессы в околозубных тканях, способствуя разрушению связочного аппарата и в конечном итоге элиминации зубов.
Функциональная недостаточность может быть причиной заболевания пародонта. Недостаточность функции жевания является порождением современной цивилизации. Тщательно обработанная, мягкая пища лишает ткани пародонта полноценной нагрузки, вследствие чего могут развиваться атрофические процессы. Кроме того, такая пища содействует образованию зубных отложений, нередко являющихся единственной причиной воспаления маргинального пародонта. При этом существенное значение имеет индивидуальная предрасположенность к заболеванию пародонта. Другой вариант функциональной недостаточности — локальная, например в отсутствии антагонистов, при открытом прикусе и т. д. Недостаток функции жевательного аппарата снижает резистентность тканей пародонта к внешним воздействиям (микробы, травма) и одновременно способствует отложению зубного камня. В связи с этим при функциональной недостаточности чаще всего развиваются воспалительные изменения в тканях пародонта.
Недогрузка группы зубов или отдельных зубов оказывает неблагоприятное влияние на пародонт. R. Ктоп- feld (1955) и I. Glickman (1967) утверждали, что в пародон- те зубов со сниженной функцией развивается дистрофический процесс с поражением коллагеновых волокон периодонта и атрофией прилежащей костной ткани. Согласно теории функциональной патологии зубочелюстной системы Курляндского, в результате частичной адентии пародонт распадается на отдельные разнофункционирующие звенья (функционирующий центр, травматический узел и нефункционирующее звено). В пародонте разнофункционирующих, в том числе недогруженных, зубов развиваются деструктивные процессы.
Влияние бляшки и зубного камня на ткани пародонта нельзя считать чисто местной причиной, ибо их образование и активность зависят от состояния реактивности организма (изменение минерального и белкового состава слюны, десневой жидкости, их ферментативной активности, иммуноглобулинов, кининовой системы и т. д.). Уместно напомнить, что деление на общие и местные факторы носит искусственный характер, ибо, хотя местные факторы могут выступать как организаторы патологического процесса, ответная реакция организма всегда обусловлена общими факторами.
Источник: Иванов В.С., «Заболевания пародонта. — 3-е изд., перераб. и доп. » 1998