ЦИТОЛОГИЧЕСКИЕ МЕТОДЫ
Цитологический метод используют для исследования содержимого паро- донтальных карманов и других очагов поражения пародонта. Содержимое изучают по методике П.М.Покровской и М.С.Макаровой (1942) в модификации И.А.Бенюмовой (1962). Пародонтальные карманы предварительно промывают изотоническим раствором хлорида натрия, стерильной иглой с турундой производят забор материала и переносят его на предметное стекло. Препарат фиксируют смесью Никифорова и окрашивают по Граму и Гимзе—Романовскому.
Микроскопически изучают клеточный состав экссудата, оценка которого позволяет получить представление о защитной реакции тканей пародонта (наличие или отсутствие фагоцитоза, незавершенный фагоцитоз). Определяют качественное состояние и количество нейтрофилов, стадию их дистрофии. Обращают внимание на состояние других клеточных элементов: лимфоцитов, полибластов, эпителиальных и плазматических клеток.
Эксфолиативная цитология позволяет вести динамические наблюдения за течением заболевания, так как степень кератинизации слизистой оболочки характеризует ее барьерную функцию. Материал для цитологического исследования берут с поверхности межзубных сосочков при помощи резиновых полосок или кубиков и переносят на предметное стекло. Окраска мазков-отпечатков определяется целью исследования. Для общего обзора мазки окрашивают по методу Романовского—Гимзы. Под микроскопом с помощью иммерсионной системы изучают качественный и количественный состав клеточных элементов крови, эпителиальных клеток. Гистохимические методы исследования позволяют уточнить состояние различных видов обмена веществ в клетках. Для определения индекса кератинизации подсчитывают общее количество эпителиальных клеток в поле зрения микроскопа, затем число обнаруженных ороговевших клеток умножают на 100 и делят на общее количество. Иногда индекс кератинизации высчитывают отдельно для слизистой оболочки каждой челюсти. Уменьшение степени кератинизации свидетельствует о снижении защитной функции.
Ротовая цитодиагностика основана на данных о циклических изменениях многослойного плоского эпителия полости рта синхронно с менструальным циклом. Материал для исследования берут со слизистой оболочки щеки выше линии смыкания зубов — это место, благодаря минимальному травмированию, наиболее удачное для такого исследования. Различают четыре степени эстрогенной насыщенности (М.Г.Синица, 1992):
Ш степень — умеренное снижение эстрогенов. В мазках встречаются промежуточные клетки с ядрами средней величины, единичные парабазальные и поверхностные клетки;
IV степень характерна для хорошей эстрогенной насыщенности (в мазках преобладают поверхностные клетки). Достоверное заключение о функциональной активности яичников можно получить при биохимических исследованиях гормонального статуса.
Реакция адсорбции микроорганизмов - РАМ (Н.Ф.Данилевский,
А.П.Самойлов, Т.А.Беленчук, 1985; Т.А.Беленчук, 1985) клетками эпителия слизистой оболочки рта может быть применена для комплексного обследования больных, определения эффективности предпринятых лечебных мероприятий, при заболеваниях пародонта и слизистой оболочки полости рта (рис. 118). Путем соскоба берут мазок со здорового участка слизистой оболочки альвеолярной части десны и окрашивают по Романовскому, Лейшману или Паппенгейму. В окрашенных мазках изучают взаимоотношение микрофлоры полости рта с эпителиальными клетками слизистой оболочки. Флора полости рта в основном представлена кокками. Подсчитывают количество кокков, адсорбированных на поверхности эпителиальных клеток, и последние делят на 4 группы:
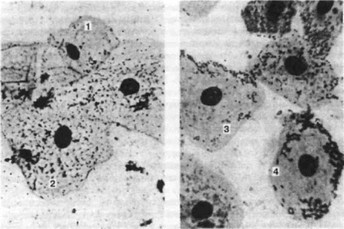
Рис. 118. Реакция адсорбции микроорганизмов (РАМ) эпителиальными клетками разных групп, х 200;
I — 1-й группы; 2 — 4-й группы; 3 — 2-й группы. 4 - 3-й группы
Расчет производится на 100 эпителиальных клетках. Клетки 1 -й и 2-й групп
относят к группе клеток с отрицательной РАМ, 3—4-Й — с положительной РАМ. При микроскопии в каждом мазке выводят процент клеток с положительной и отрицательной РАМ. По проценту положительной РАМ судят о неспецифической резистентности организма: при РАМ 70% и выше функциональное состояние организма хорошее, 31—69% — удовлетворительное, 30% и ниже - неудовлетворительное,
Метод последовательных полосканий - миграция лейкоцитов в полость рта (М.А.Ясиновский, 1931) позволяет судить о защитных реак-; циях тканей пародонта, степени фагоцитоза, характере воспалительной реакции. Подсчитывают количество мигрировавших в полость рта лейкоцитов в единице объема смывной жидкости. Для полоскания рта используют 10 мл изотонического раствора хлорида натрия. Длительность полоскания — 30 с. Промежутки между полосканиями 5 мин. Первые 3 порции выплевывают, 3 следующие собирают в пробирки для исследования. Пробирки закрывают, взбалтывают содержимое. Пипеткой отмеряют 1 мл смыва, переносят в другую пробирку, делают разведение в 9 раз. Тщательно взбалтывают, подкрашивают 1 % водным раствором трипанового синего и 1 % водным раствором конго красного (по 1 калле). Пипеткой заполняют камеру для подсчета. Через 51—10 мин после оседания лейкоцитов проводят подсчет в 30 полях зрения. Камера пред— ставляет собой предметное стекло, на которое наклеено второе толщиной 1 мм с отверстием в центре. Для работы используют окуляр с ограниченным полем зрения, равным 45 квадратикам по камере Горяева.
Подсчитывают в 10 полях зрения количество живых, мертвых лейкоцитов и клеток плоского эпителия. Затем производят расчеты:
Для суждения о качественном составе клеточных элементов смыва готовят мазки из осадка, которые фиксируют в этиловом спирте и окрашивают по Романовскому—Гимзе. Затем в мазках проводят дифференцированный подсчет относительного количества неизмененных нейтрофилов и находящихся в стадии дистрофии. Учитывают количество фагоцитов и лимфоцитов. Дифференцируют эпителиальные клетки по степени зрелости. Определяют количество ороговевших, промежуточных и парабазальных клеток. Степень ороговения устанавливают по клеточной морфологии в дополнение к реакциям окрашивания. Всего подсчитывают 100 клеток и выводят их процентное содержание. В норме 80% мигрировавших в полость рта жизнеспособных лейкоцитов со— храняют подвижность и функцию фагоцитоза в течение 2,5 ч. По интенсивности миграции лейкоцитов и десквамации можно судить о реактивности слизи— стой оболочки рта, степени тяжести патологического процесса.
Этот метод объективно оценивает результаты различных способов лечения заболеваний пародонта.
Г емограмма — совокупность качественного и количественного исследования крови. Для подсчета гемограммы мазки готовят по обычной методике. В морфологической картине периферической крови определяют отклонения от нормы: уменьшение числа эритроцитов, снижение уровня гемоглобина, сдвиг лейкоцитарной формулы, увеличение СОЭ и др.
Моноцитограмма (О.П.Григорова, 1958) — это тест функционального состояния активности мезенхимы, который определяют путем дифференцированного подсчета и определения процентного соотношения различных форм (юных и старых) моноцитов в периферической крови. В норме процентное соотношение различных групп моноцитов следующее: промоноцитов 20—23%, собственно моноцитов 26—32%, полиморфноядерных 42—62%, полинук- леаров 0,1%.
Микроскопически изучают клеточный состав экссудата, оценка которого позволяет получить представление о защитной реакции тканей пародонта (наличие или отсутствие фагоцитоза, незавершенный фагоцитоз). Определяют качественное состояние и количество нейтрофилов, стадию их дистрофии. Обращают внимание на состояние других клеточных элементов: лимфоцитов, полибластов, эпителиальных и плазматических клеток.
Эксфолиативная цитология позволяет вести динамические наблюдения за течением заболевания, так как степень кератинизации слизистой оболочки характеризует ее барьерную функцию. Материал для цитологического исследования берут с поверхности межзубных сосочков при помощи резиновых полосок или кубиков и переносят на предметное стекло. Окраска мазков-отпечатков определяется целью исследования. Для общего обзора мазки окрашивают по методу Романовского—Гимзы. Под микроскопом с помощью иммерсионной системы изучают качественный и количественный состав клеточных элементов крови, эпителиальных клеток. Гистохимические методы исследования позволяют уточнить состояние различных видов обмена веществ в клетках. Для определения индекса кератинизации подсчитывают общее количество эпителиальных клеток в поле зрения микроскопа, затем число обнаруженных ороговевших клеток умножают на 100 и делят на общее количество. Иногда индекс кератинизации высчитывают отдельно для слизистой оболочки каждой челюсти. Уменьшение степени кератинизации свидетельствует о снижении защитной функции.
Ротовая цитодиагностика основана на данных о циклических изменениях многослойного плоского эпителия полости рта синхронно с менструальным циклом. Материал для исследования берут со слизистой оболочки щеки выше линии смыкания зубов — это место, благодаря минимальному травмированию, наиболее удачное для такого исследования. Различают четыре степени эстрогенной насыщенности (М.Г.Синица, 1992):
- степень — резкая недостаточность эстрогенов (в мазках обнаруживают атрофические клетки);
- степень — средняя степень дефицита эстрогенов (мазки состоят преимущественно из парабазальных клеток с крупными ядрами);
Ш степень — умеренное снижение эстрогенов. В мазках встречаются промежуточные клетки с ядрами средней величины, единичные парабазальные и поверхностные клетки;
IV степень характерна для хорошей эстрогенной насыщенности (в мазках преобладают поверхностные клетки). Достоверное заключение о функциональной активности яичников можно получить при биохимических исследованиях гормонального статуса.
Реакция адсорбции микроорганизмов - РАМ (Н.Ф.Данилевский,
А.П.Самойлов, Т.А.Беленчук, 1985; Т.А.Беленчук, 1985) клетками эпителия слизистой оболочки рта может быть применена для комплексного обследования больных, определения эффективности предпринятых лечебных мероприятий, при заболеваниях пародонта и слизистой оболочки полости рта (рис. 118). Путем соскоба берут мазок со здорового участка слизистой оболочки альвеолярной части десны и окрашивают по Романовскому, Лейшману или Паппенгейму. В окрашенных мазках изучают взаимоотношение микрофлоры полости рта с эпителиальными клетками слизистой оболочки. Флора полости рта в основном представлена кокками. Подсчитывают количество кокков, адсорбированных на поверхности эпителиальных клеток, и последние делят на 4 группы:

Рис. 118. Реакция адсорбции микроорганизмов (РАМ) эпителиальными клетками разных групп, х 200;
I — 1-й группы; 2 — 4-й группы; 3 — 2-й группы. 4 - 3-й группы
- эпителиальные клетки, на поверхности которых нет адсорбированных микроорганизмов или встречаются единичные кокки;
- адсорбция эпителиальной клеткой от 5 до 25 кокков;
- эпителиальные клетки, имеющие на своей поверхности 26—50 кокков;
- адсорбция 51 и более кокков на поверхности клеток типа муравейника.
Расчет производится на 100 эпителиальных клетках. Клетки 1 -й и 2-й групп
относят к группе клеток с отрицательной РАМ, 3—4-Й — с положительной РАМ. При микроскопии в каждом мазке выводят процент клеток с положительной и отрицательной РАМ. По проценту положительной РАМ судят о неспецифической резистентности организма: при РАМ 70% и выше функциональное состояние организма хорошее, 31—69% — удовлетворительное, 30% и ниже - неудовлетворительное,
Метод последовательных полосканий - миграция лейкоцитов в полость рта (М.А.Ясиновский, 1931) позволяет судить о защитных реак-; циях тканей пародонта, степени фагоцитоза, характере воспалительной реакции. Подсчитывают количество мигрировавших в полость рта лейкоцитов в единице объема смывной жидкости. Для полоскания рта используют 10 мл изотонического раствора хлорида натрия. Длительность полоскания — 30 с. Промежутки между полосканиями 5 мин. Первые 3 порции выплевывают, 3 следующие собирают в пробирки для исследования. Пробирки закрывают, взбалтывают содержимое. Пипеткой отмеряют 1 мл смыва, переносят в другую пробирку, делают разведение в 9 раз. Тщательно взбалтывают, подкрашивают 1 % водным раствором трипанового синего и 1 % водным раствором конго красного (по 1 калле). Пипеткой заполняют камеру для подсчета. Через 51—10 мин после оседания лейкоцитов проводят подсчет в 30 полях зрения. Камера пред— ставляет собой предметное стекло, на которое наклеено второе толщиной 1 мм с отверстием в центре. Для работы используют окуляр с ограниченным полем зрения, равным 45 квадратикам по камере Горяева.
Подсчитывают в 10 полях зрения количество живых, мертвых лейкоцитов и клеток плоского эпителия. Затем производят расчеты:
- среднее число лейкоцитов в 1 поле зрения (живых и мертвых отдельно) и клеток плоского эпителия;
- среднее число лейкоцитов в 1 поле зрения (живых и мертвых отдельно) и клеток плоского эпителия умножают на 400 и на разведение и делят на 45. Полученное число показывает количество мигрировавших лейкоцитов в 1 мл смывной жидкости по Ясиновскому.
Для суждения о качественном составе клеточных элементов смыва готовят мазки из осадка, которые фиксируют в этиловом спирте и окрашивают по Романовскому—Гимзе. Затем в мазках проводят дифференцированный подсчет относительного количества неизмененных нейтрофилов и находящихся в стадии дистрофии. Учитывают количество фагоцитов и лимфоцитов. Дифференцируют эпителиальные клетки по степени зрелости. Определяют количество ороговевших, промежуточных и парабазальных клеток. Степень ороговения устанавливают по клеточной морфологии в дополнение к реакциям окрашивания. Всего подсчитывают 100 клеток и выводят их процентное содержание. В норме 80% мигрировавших в полость рта жизнеспособных лейкоцитов со— храняют подвижность и функцию фагоцитоза в течение 2,5 ч. По интенсивности миграции лейкоцитов и десквамации можно судить о реактивности слизи— стой оболочки рта, степени тяжести патологического процесса.
Этот метод объективно оценивает результаты различных способов лечения заболеваний пародонта.
Г емограмма — совокупность качественного и количественного исследования крови. Для подсчета гемограммы мазки готовят по обычной методике. В морфологической картине периферической крови определяют отклонения от нормы: уменьшение числа эритроцитов, снижение уровня гемоглобина, сдвиг лейкоцитарной формулы, увеличение СОЭ и др.
Моноцитограмма (О.П.Григорова, 1958) — это тест функционального состояния активности мезенхимы, который определяют путем дифференцированного подсчета и определения процентного соотношения различных форм (юных и старых) моноцитов в периферической крови. В норме процентное соотношение различных групп моноцитов следующее: промоноцитов 20—23%, собственно моноцитов 26—32%, полиморфноядерных 42—62%, полинук- леаров 0,1%.
Источник: Данилевский Н.Ф., Борисенко А.В., «Заболевания пародонта» 2000