Изготовление титановых имплантатов
На примере изготовления пластиночного импланта из титана можно проследить схему предложенного нами штамповочно-фрезерного способа. Из листа титана толщиной 3 мм в помощью штампа и пресса получают заготовки имплантатов (рис. 20). На фрезерном станке толщину эндооссальной части имплантата доводят до 1,3 мм. Этим же штампом изготавливают аналог имплантатов из титана толщиной 1 мм. На пластине имплантатов делаются углубления для установки имплантатовода и фаски на краях отверстий. Образовавшиеся заусеницы снимают галтовкой. Во время штамповки и фрезеровки в металле создаются напряжения, для снятия которых производят термическую обработку С этой целью имплантаты вносят на 1 мин в нагретую до 700 °С муфельную печь, затем вынимают и опускают в воду. Предлагаемый режим отжига установлен нами в процессе отработки описанной выше технологии При температуре более 700°С титан поглощает водород и становится хрупким. Без термообработки при знакопеременной нагрузке наблюдаются переломы шейки имплантата. Предлагаемый режим отжига был разработан методом проб на скручивание до появления микротрещины на шейке имплантата, выявляемой с помощью микроскопа МБС-1 при 24-кратном увеличении. После нормальной термообработки поверхность имплантата имеет светло-синюю окраску. Золотистая окраска указывает на недостаточный нагрев и необходимость повторения отжига. Светло-серая окраска свидетельствует о сильном перегреве, при котором имеет место водородная хрупкость металла. Такой имплантат не должен использоваться. Примечательно, что фирма "Oratronics corporation", рекламируя свои имплантаты, указывает, что их головку можно повернуть на 45° и согнуть под углом 90°. При испытании наших имплантатов установлено, что головку легко можно повернуть на 130° без появления трещины и согнуть под углом ?!° (рис. 21).
Следующим этапом является полирование поверхности имплантата. Часто применяемые, довольно эффективные механические методы полирования изменяют структуру металла, что неблагоприятно отражается на прочностных, усталостных и коррозионных свойствах металлов. При механическом полировании нарушается структура кристаллов и образуются активные зоны, оказывающие малое сопротивление действию коррозионной среды, поверхность титана обладает малой прочностью на истирание, и в контакте с другими металлами происходит проедание. Трудно получить блестящую поверхность титанового имплантата механическим полированием всей конструкции (рис. 22).
Многочисленные данные свидетельствуют об улучшении качества изделия после электрохимической полировки (ЭХП). Свойства, определяемые по ГОСТам на гладких образцах, имеют важное значение, но во многих случаях не характеризуют этих материалов в реальных условиях. Исходя из этого, полировку изделий из титана ВТ 1-00 мы производим в предложенном
М. Штанько и П. П. Карязиным (1979) электролите следующего состава: 60 % серной кислоты, 10 % азотной кислоты, 25 % плавиковой кислоты, 5 % воды, технологический режим: постоянное напряжение 8 — 15 В, плотность тока 80 А/дм2, температура электролита —40°С, катод — свинец, анод — титановый имплантат.
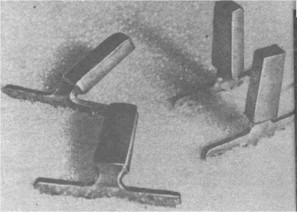
Рис. 21. Высокая пластичность шеек ЭИ, изготовленных по разработанной нами технологии.

Рис. 22. Механически полированный титан со следами за рения поверхности. Растровая микроскопия. X 1000.

Рис. 23. Электрохимически полированный титан без следов старения поверхности. Растровая микроскопия^ 1000.
Анализ полученных с помощью рентгеномикроскопического анализатора IXA-50A (Япония) 90 фотографий механически и электрохимически полированных имплантатов показал, что механическое полирование заглаживает все дефекты, создавая картину мнимого благополучия. Работая с титаном, надо особенно осторожно производить механическую обработку, потому что этот металл склонен к заеданию. Органические и неорганические загрязнения поверхности имплантата не всегда можно удалить с помощью спирта и ацетона (см. рис. 22).
В таких случаях необходимо дополнительно применять ультразвуковую очистку.
Более перспективна ЭХП, при которой открываются инклюзии, границы кристаллов, снимается напряжение и выравнивается деформированный механической обработкой слой поверхности. Все это повышает толерантность металлических имплантатов. Указанный выше электролит для ЭХП обеспечивает требуемую чистоту поверхности имплантатов (рис. 23). Использование ЭХП иногда дает "слабый блеск", причинами возникновения которого являются низкая плотность тока, загрязненная поверхность, низкая концентрация кислот в электролите. Появление серого налета, который плохо
смывается водой, требует отключения тока и помещения имплантата на 1—2 с в электролит. После этого имплантат обычно блестит, но это указывает, что электролит перегрет или соотношение кислот неправильное
Полируя большую партию имплантатов, нужно одевать хирургические перчатки, так как при испарении плавиковой и азотной кислот может возникнуть химический ожог кожи. Полировка в вытяжном шкафу с плохой вентиляцией недопустима. Применяемое напряжение не опасно для жизни, но небрежное обращение с имплантатами может вызвать термический ожог.
Целесообразно также указать на явление контаминации (лат. contaminatio — соприкосновение, смыкание) при изготовлении имплантатов. Контаминация - процесс передачи частиц материала при соприкосновении двух предметов. На твердом материале остаются микрочастицы более мягкого материала. Это создает условия для засорения поверхности имплантата, образования на ней микрогальванопары на поверхности, повреждения костной ткани и возникновения асептического воспаления которое может перейти в инфекционный процесс. Контаминация может иметь место и в случае небрежного отношения при обработке имплантатов и во время операции имплантации.
С целью выявления контаминации мы исследовали изменения анодно-поляризационных кривых (АПК) электропотенциалов образцов из титана и КХС. Оценивая с помощью растрового микроскопа качество поверхности имплантатов после установки в подготовленную костную траншею с растровым микроскопом обнаружили, что поверхность повреждается инструментом и костной тканью. Проведены две серии опытов. Сначала с помощью осциллографа универсального запоминающего СВ-13 записывали АПК, применяя
(рац. предложение № 2476). Образцы из ВТ и КХС размером 3X3X8 мм подсоединяли к аноду и фиксировали в ванночке с изотоническим раствором хлорида натрия. Катодом служила титановая пластина 2X8 см2, положенная на две ванночки. Во время исследования на анод подавали возрастающее напряжение от 0,1 до 1,8 В. Записывали АПК до и после контактирования разных пар металлов: титан — титан КХС — КХС, титан — нержавеющая сталь, КХС - нержавеющая сталь, титан — рубин, КХС — рубин. Образцы из разных контактируемых материалов проводили
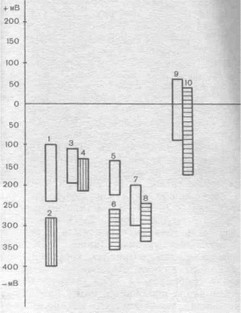
Рис. 24. Электропгаенциалы металлов, применяемых для изготовления имплантатов и протезов.
1 - титан ВТ 1-00: 2 - титан ВТ 1-00+сталь; 3 — КХС: 4 - КХС+сталь; 5 - стальной мост без припоя; 6 — стальной мост, покрытый нитридом титана; 7- стальной мост паяный; 8 — стальной мост паяный и покрытый нитридом титана; 9 — золотые протезы; 10 — стальная коронка.
друг о друга по всей длине плоскостей 2 раза при каждом исследовании. После записи стабильной АПК контаминации записывали повторную АПК, сравнивали результаты и фотографировали кривые с экрана зеркальной фотокамерой «Зенит». В дальнейшем определяли изменение электропотенциала титановых и кобальтохромовых сплавов после контактирования со стальным пинцетом (марка 20X13). Для измерения применяли вольтметр В7-27А и осциллограф-мультиметр С1-112.
С целью повышения точности и получения более стабильных результатов вход в прибор делали через высокоомный усилитель с коэффициентом усиления.
В ячейку с изотоническим раствором хлорида натрия при 15 —20°С подвешивали образцы. Вторым электродом служил хлорсеребряный электрод типа ЭВЛ-1 промышленного производства. Результаты измерений представлены на рис. 24. Исследование контаминирую- щих пар убедительно показало изменения АПК титана и КХС. В этом отношении стальной стоматологический пинцет (марки 20X13) наиболее опасен для титана и в меньшей степени — для КХС. Повреждение оксидной пленки рубином на титановых и кобальтовых образцах не вызывает появления пика коррозионного тока, что указывает на хорошую самопассивируемость металла и отсутствие засорения.
Контаминация титана с нержавеющей сталью способствует образованию пика коррозионного тока при напряжении 0,2—0,3 В, а плотность тока достигает 16-10-8 А/см2 (рис. 25). При повторных записях плотность тока уменьшается и кривая возвращается к исходному уровню. Запись АПК в течении 10 мин показала, что возникает коррозия, продукты которой с самого начала отрицательно действуют на формирование фибринового слоя вокруг импланта. После контаминации понижается порог пробоя оксидной пленки образцов, увеличивается возможность коррозии металла. Так, по Ноаг (1986) (цит. по Вильямс) в норме потенциал пробоя составляет для титана 0,8 для КХС 0,8 В, что соответствует нашим наблюдениям
Нами установлено, что после контаминации меняется не только АПК, но и электропотенциал металла (см. рис. 24): величина его смещается в отрицательную сторону. При испытании титана марки ВТ из двух разных партий обнаружено изменение электропотенциала в среднем на 121,58 мВ. КХС менее подвержен явлению контаминации как более твердый материал; электропотенциал увеличивается только на 3060 мВ. Исходный потенциал образца получаем только после ЭХП.
Таким образом, изменение потенциала в отрицательную сторону указывает на плохое качество импланта. От чистоты поверхности имплантата зависят элекро- потенциал, смачивание, поверхностная энергия, биоадгезия. Результаты изучения контаминации показали, что
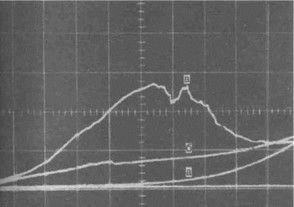
Рис. 25. Анодно-поляризационные кривые титана после контакта со сталью и рубином.
Исходная кривая; б — после контакта с рубином; в—после контакта со сталью.
пренебрегать этим нельзя. Так, контаминация титана со сталью (20X13) снижает потенциал пробоя оксидной пленки до критических значений 0,2—0,3 В, тогда как амальгамовая пломба имеет потенциал 0,3—0,4 В, а алюминиевая ложка, используемая для еды,— 0,6 В. Это весьма реальные ситуации в полости рта.
В литературе мы не обнаружили данных об измерении электропотенциала при контаминации и возможности его использования как показателя качества имплантата, определяемого милливольтметром. Измерение элекропотенциала особенно полезно при обработке поверхности имплантатов начинающими зубными техниками. Нами установлено, что применение осциллографа в автоматическом режиме позволяет в течение 3 мин произвести пассивацию имплантатов в изотоническом растворе хлорида натрия и одновременно контролировать их качество (рис. 2 6). Этот провоцирующий потенциодинамический экспресс-метод можно с успехом применять и для оценки качества протезов. Для изучения воздействия на поверхность титанового имплантата процедуры введения его в подготов-
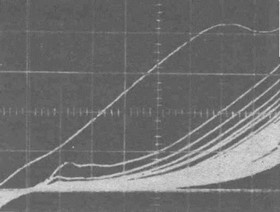
Рис. 26. Пассивация титанового имплантата в изотоническом растворе хлорида натрия потенциодинамическим методом
ленную костную траншею мы изготовили три имплантата и в каждом сделали механическую пометку в одном и том же месте. Поверхность имплантата и метки фотографировали до и после внедрения в костную ткань с помощью растрового микроскопа JESM-IC-25S (Япония). Один имплантат вводили 1 раз, другой — 2 раза, третий — 3 раза. Анализ снимков показал, что во время первого внедрения наиболее заметные царапины на поверхности имплантата наблюдаются при разнице толщины бора и имплантата. При последующих внедрениях образуются более слабые повреждения поверхности, но общее их число возрастает. Чтобы облегчить операцию, предохранить ложа от излишнего травмирования и в наименьшей степени повредить поверхность имплантата, мы предложили аналог имплантата — пластинку толщиной 1 мм, по форме аналогичную внедряемому импланту.
Окончательно качество готовых имплантатов проверяли с помощью прибора LAS-600 (Франция), меняя ожеэлектронную спектроскопию в растровой электронной микроскопии. Установлено, что в поверхностном слое имплантата из титана на глубине до 3 нм содержатся в основном титан, кислород, углерод, т. е.
поверхность не засорена. На поверхности имплантатов из КХС найдены углерод, кислород, кобальт, азот и хром. Исследуя поверхность нескольких имплантатов, мы обнаружили цинк, который, как выяснилось, попал на нее во время транспортировки имплантата в бутылке, где ранее находился порошок фосфатцемента. Это показывает, что хранить и транспортировать имплантат следует только в тщательно очищенной посуде из стекла или пластмассы. Несоблюдение требований, исключающих контаминацию, ухудшает биотолерантные свойства металлических имплантатов.
При имплантации необходимо использовать инструменты (особенно те, которые соприкасаются с костной тканью) из того же металла, что и имплантат. Всегда следует брать имплантат только за головку. Из-за большой твердости материала нужно осторожно применять керамические, сапфировые имплантаты, в которых явление контаминации имеет место на всех этапах. Изучение возможности применения сапфировых имплантатов, выпускаемых НПО «Монокристаллреактив» (Харьков), показало высокую культуру производства. При доводке имплантатов по длине, согласно рентгенограмме,
при последующем исследовании, как и предполагалось, было обнаружено засорение поверхности никелем от алмазного диска. Применение таких имплантатов возможно только после кипячения в царской водке в течение 10 — 15 мин, промывки и стерилизации.
Наши исследования показали, что явление контаминации имеет большое значение для имплантологии. Вследствие засорения поверхности имплантата изменяется электропотенциал, а в результате этого и электростатическое воздействие на окружающие ткани. Образование микрогальванических пар, продуктов коррозии и нарушенная оксидная пленка на поверхности имплантата вызывают асептическое воспаление. Особенно это относится к титану. При обработке, транспортировке, стерилизации, операции имплантации надо исключить засоренные поверхности имплантата и костного ложа.
Говоря о качестве имплантатов, нельзя обойти вопрос о том, какой должна быть поверхность: ровная,
нужной геометрии, гладкая, рифленая, шершавая. Каждый имплантат имеет определенную опорную площадь. Известно также, что металл имплантатов не безвреден. Логично предположить, что опорную площадь поверхности на микроуровне надо уменьшать, чтобы отрицательное действие металла имплантата на окружающие ткани было минимальным. Необходимо обратить внимание на то, что объем опорной костной ткани при любом виде микрорельефа остается тем же.
A. Schroeder (1976) ввел в имплантологию покрытие плазменным способом поверхности титановых имплантатов химически чистым титаном и таким образом в 6 раз увеличил площадь поверхности. L. Linkow, (1968), J. Weiss (1973), Н. Grafelmann (1983) делают поверхность имплантатов рифленой, обрабатывают ее в пескоструйном аппарате.
В своей работе мы исходили из того, что зубы имеют подвижность и что не всегда можно расчитывать на репаративную способность костной ткани.
В связи с этим имплантат должен прочно стоять в костном ложе благодаря натягу. Для того чтобы при микроподвижности поверхность имплантата не травмировала окружающие ткани, мы делаем ее ровной и полированной. Со временем оголяются шейка и плечи имплантата; лишь полированные части не создают условия для развития воспаления. Следовательно, протез на имплантате послужит дольше. Учитывая это, мы всегда стараемся ввести полированные имплантаты с натягом и достичь множественного, плотного контакта имплантата с костной тканью. Наблюдение за 1330 имплантатами в течение 9 лет показало обоснованность такого подхода (малое количество компликаций и удалений имплантатов).
В течение последних 30 лет ведется интенсивный поиск оптимального материала и конструкции имплантата. Предлагались различные конструкции для восстановления жевательной функции и эстетики. Однако вопрос остается спорным. Как видно из табл. 4, в 1968—1982 гг. было подано 32 заявки на изобретения только по пластиночным имплантатам. Поиск оптимальной конструкции идет методом проб и ошибок. Каждый оригинальный подход к решению проблемы способствует изысканиям в новом направлении. По данным литературы, наибольшее распространение нашли пластиночные ЭИ из титановых сплавов с закругленной и сплошной базой [Linkow L., 1968; Weiss J., 1975; Zak R.,
Grafebmann H., Linkow L., 1980; Vassos D.]
При разработке отечественных пластиночных ЭИ использовалось техническое решение по заявке № 3230 от 19.08.82 г. (ФРГ), касающееся соотношения пло-

Рис. 27. Первые ЭИ отечественного производства.
щади отверстий и всей площади имплантата. Фирмы "Fratronic Incorporation", "Ultimatic Incorporation", "Amec SA" выпускают наборы вариантов имплантатов для верхней и нижней челюстей. Изготавливать такое количество вариантов штамповочно-фрезерным способом очень дорого. G. Muratori и L. Linkow (1981) предлагают выпускать стандартные имплантаты-заготовки и в каждом случае подгонять их по рентгенограмме. Наш клинический опыт показал, что шести вариантов пластиночных ЭИ вполне достаточно для восстановления дефектов зубных рядов. Чаще всего использовались I, II, III варианты (рис. 27). Соответственно этому в стоматологическом комплекте имплантатов и инструментов количество имплантатов было перераспределено. При лечении больных нами использовано 770 пластиночных имплантатов, в том числе 378 титановых. Получается, что в комплекте имеющиеся титановые имплантаты решают проблему только наполовину. Для решения вопроса необходимо включить в комплект шесть аналогичных вариантов пластмассовых заготовок имплантатов для отливки из КХС на местах. Имплантаты из КХС можно делать более тонкими или длинными и таким образом расширять их возможности. По нашему мнению, можно использовать как стандартные, так и изготавливаемые по заказу ЭИ из титана и КХС. Организация изготовления только III варианта пластмассовой заготовки для нужд нашей лаборатории намного повысила качество работы и расширила возможности лаборатории. Благодаря биотолерантным свойствам, прочности и широким показаниям к применению металлические имплантаты, по-видимому, никогда не потеряют своего значения.
Биотолерантные свойства металлических имплантов зависят от качества обработки поверхности. Необхоимо отметить отсутствие специальных приборов, позволяющих определить качество имплантатов и протезов. Все оценивается на глаз, а этого недостаточно для успешного развития имплантологии.
Следующим этапом является полирование поверхности имплантата. Часто применяемые, довольно эффективные механические методы полирования изменяют структуру металла, что неблагоприятно отражается на прочностных, усталостных и коррозионных свойствах металлов. При механическом полировании нарушается структура кристаллов и образуются активные зоны, оказывающие малое сопротивление действию коррозионной среды, поверхность титана обладает малой прочностью на истирание, и в контакте с другими металлами происходит проедание. Трудно получить блестящую поверхность титанового имплантата механическим полированием всей конструкции (рис. 22).
Многочисленные данные свидетельствуют об улучшении качества изделия после электрохимической полировки (ЭХП). Свойства, определяемые по ГОСТам на гладких образцах, имеют важное значение, но во многих случаях не характеризуют этих материалов в реальных условиях. Исходя из этого, полировку изделий из титана ВТ 1-00 мы производим в предложенном
М. Штанько и П. П. Карязиным (1979) электролите следующего состава: 60 % серной кислоты, 10 % азотной кислоты, 25 % плавиковой кислоты, 5 % воды, технологический режим: постоянное напряжение 8 — 15 В, плотность тока 80 А/дм2, температура электролита —40°С, катод — свинец, анод — титановый имплантат.

Рис. 21. Высокая пластичность шеек ЭИ, изготовленных по разработанной нами технологии.

Рис. 22. Механически полированный титан со следами за рения поверхности. Растровая микроскопия. X 1000.

Рис. 23. Электрохимически полированный титан без следов старения поверхности. Растровая микроскопия^ 1000.
Анализ полученных с помощью рентгеномикроскопического анализатора IXA-50A (Япония) 90 фотографий механически и электрохимически полированных имплантатов показал, что механическое полирование заглаживает все дефекты, создавая картину мнимого благополучия. Работая с титаном, надо особенно осторожно производить механическую обработку, потому что этот металл склонен к заеданию. Органические и неорганические загрязнения поверхности имплантата не всегда можно удалить с помощью спирта и ацетона (см. рис. 22).
В таких случаях необходимо дополнительно применять ультразвуковую очистку.
Более перспективна ЭХП, при которой открываются инклюзии, границы кристаллов, снимается напряжение и выравнивается деформированный механической обработкой слой поверхности. Все это повышает толерантность металлических имплантатов. Указанный выше электролит для ЭХП обеспечивает требуемую чистоту поверхности имплантатов (рис. 23). Использование ЭХП иногда дает "слабый блеск", причинами возникновения которого являются низкая плотность тока, загрязненная поверхность, низкая концентрация кислот в электролите. Появление серого налета, который плохо
смывается водой, требует отключения тока и помещения имплантата на 1—2 с в электролит. После этого имплантат обычно блестит, но это указывает, что электролит перегрет или соотношение кислот неправильное
Полируя большую партию имплантатов, нужно одевать хирургические перчатки, так как при испарении плавиковой и азотной кислот может возникнуть химический ожог кожи. Полировка в вытяжном шкафу с плохой вентиляцией недопустима. Применяемое напряжение не опасно для жизни, но небрежное обращение с имплантатами может вызвать термический ожог.
Целесообразно также указать на явление контаминации (лат. contaminatio — соприкосновение, смыкание) при изготовлении имплантатов. Контаминация - процесс передачи частиц материала при соприкосновении двух предметов. На твердом материале остаются микрочастицы более мягкого материала. Это создает условия для засорения поверхности имплантата, образования на ней микрогальванопары на поверхности, повреждения костной ткани и возникновения асептического воспаления которое может перейти в инфекционный процесс. Контаминация может иметь место и в случае небрежного отношения при обработке имплантатов и во время операции имплантации.
С целью выявления контаминации мы исследовали изменения анодно-поляризационных кривых (АПК) электропотенциалов образцов из титана и КХС. Оценивая с помощью растрового микроскопа качество поверхности имплантатов после установки в подготовленную костную траншею с растровым микроскопом обнаружили, что поверхность повреждается инструментом и костной тканью. Проведены две серии опытов. Сначала с помощью осциллографа универсального запоминающего СВ-13 записывали АПК, применяя
(рац. предложение № 2476). Образцы из ВТ и КХС размером 3X3X8 мм подсоединяли к аноду и фиксировали в ванночке с изотоническим раствором хлорида натрия. Катодом служила титановая пластина 2X8 см2, положенная на две ванночки. Во время исследования на анод подавали возрастающее напряжение от 0,1 до 1,8 В. Записывали АПК до и после контактирования разных пар металлов: титан — титан КХС — КХС, титан — нержавеющая сталь, КХС - нержавеющая сталь, титан — рубин, КХС — рубин. Образцы из разных контактируемых материалов проводили

Рис. 24. Электропгаенциалы металлов, применяемых для изготовления имплантатов и протезов.
1 - титан ВТ 1-00: 2 - титан ВТ 1-00+сталь; 3 — КХС: 4 - КХС+сталь; 5 - стальной мост без припоя; 6 — стальной мост, покрытый нитридом титана; 7- стальной мост паяный; 8 — стальной мост паяный и покрытый нитридом титана; 9 — золотые протезы; 10 — стальная коронка.
друг о друга по всей длине плоскостей 2 раза при каждом исследовании. После записи стабильной АПК контаминации записывали повторную АПК, сравнивали результаты и фотографировали кривые с экрана зеркальной фотокамерой «Зенит». В дальнейшем определяли изменение электропотенциала титановых и кобальтохромовых сплавов после контактирования со стальным пинцетом (марка 20X13). Для измерения применяли вольтметр В7-27А и осциллограф-мультиметр С1-112.
С целью повышения точности и получения более стабильных результатов вход в прибор делали через высокоомный усилитель с коэффициентом усиления.
В ячейку с изотоническим раствором хлорида натрия при 15 —20°С подвешивали образцы. Вторым электродом служил хлорсеребряный электрод типа ЭВЛ-1 промышленного производства. Результаты измерений представлены на рис. 24. Исследование контаминирую- щих пар убедительно показало изменения АПК титана и КХС. В этом отношении стальной стоматологический пинцет (марки 20X13) наиболее опасен для титана и в меньшей степени — для КХС. Повреждение оксидной пленки рубином на титановых и кобальтовых образцах не вызывает появления пика коррозионного тока, что указывает на хорошую самопассивируемость металла и отсутствие засорения.
Контаминация титана с нержавеющей сталью способствует образованию пика коррозионного тока при напряжении 0,2—0,3 В, а плотность тока достигает 16-10-8 А/см2 (рис. 25). При повторных записях плотность тока уменьшается и кривая возвращается к исходному уровню. Запись АПК в течении 10 мин показала, что возникает коррозия, продукты которой с самого начала отрицательно действуют на формирование фибринового слоя вокруг импланта. После контаминации понижается порог пробоя оксидной пленки образцов, увеличивается возможность коррозии металла. Так, по Ноаг (1986) (цит. по Вильямс) в норме потенциал пробоя составляет для титана 0,8 для КХС 0,8 В, что соответствует нашим наблюдениям
Нами установлено, что после контаминации меняется не только АПК, но и электропотенциал металла (см. рис. 24): величина его смещается в отрицательную сторону. При испытании титана марки ВТ из двух разных партий обнаружено изменение электропотенциала в среднем на 121,58 мВ. КХС менее подвержен явлению контаминации как более твердый материал; электропотенциал увеличивается только на 3060 мВ. Исходный потенциал образца получаем только после ЭХП.
Таким образом, изменение потенциала в отрицательную сторону указывает на плохое качество импланта. От чистоты поверхности имплантата зависят элекро- потенциал, смачивание, поверхностная энергия, биоадгезия. Результаты изучения контаминации показали, что

Рис. 25. Анодно-поляризационные кривые титана после контакта со сталью и рубином.
Исходная кривая; б — после контакта с рубином; в—после контакта со сталью.
пренебрегать этим нельзя. Так, контаминация титана со сталью (20X13) снижает потенциал пробоя оксидной пленки до критических значений 0,2—0,3 В, тогда как амальгамовая пломба имеет потенциал 0,3—0,4 В, а алюминиевая ложка, используемая для еды,— 0,6 В. Это весьма реальные ситуации в полости рта.
В литературе мы не обнаружили данных об измерении электропотенциала при контаминации и возможности его использования как показателя качества имплантата, определяемого милливольтметром. Измерение элекропотенциала особенно полезно при обработке поверхности имплантатов начинающими зубными техниками. Нами установлено, что применение осциллографа в автоматическом режиме позволяет в течение 3 мин произвести пассивацию имплантатов в изотоническом растворе хлорида натрия и одновременно контролировать их качество (рис. 2 6). Этот провоцирующий потенциодинамический экспресс-метод можно с успехом применять и для оценки качества протезов. Для изучения воздействия на поверхность титанового имплантата процедуры введения его в подготов-

Рис. 26. Пассивация титанового имплантата в изотоническом растворе хлорида натрия потенциодинамическим методом
ленную костную траншею мы изготовили три имплантата и в каждом сделали механическую пометку в одном и том же месте. Поверхность имплантата и метки фотографировали до и после внедрения в костную ткань с помощью растрового микроскопа JESM-IC-25S (Япония). Один имплантат вводили 1 раз, другой — 2 раза, третий — 3 раза. Анализ снимков показал, что во время первого внедрения наиболее заметные царапины на поверхности имплантата наблюдаются при разнице толщины бора и имплантата. При последующих внедрениях образуются более слабые повреждения поверхности, но общее их число возрастает. Чтобы облегчить операцию, предохранить ложа от излишнего травмирования и в наименьшей степени повредить поверхность имплантата, мы предложили аналог имплантата — пластинку толщиной 1 мм, по форме аналогичную внедряемому импланту.
Окончательно качество готовых имплантатов проверяли с помощью прибора LAS-600 (Франция), меняя ожеэлектронную спектроскопию в растровой электронной микроскопии. Установлено, что в поверхностном слое имплантата из титана на глубине до 3 нм содержатся в основном титан, кислород, углерод, т. е.
поверхность не засорена. На поверхности имплантатов из КХС найдены углерод, кислород, кобальт, азот и хром. Исследуя поверхность нескольких имплантатов, мы обнаружили цинк, который, как выяснилось, попал на нее во время транспортировки имплантата в бутылке, где ранее находился порошок фосфатцемента. Это показывает, что хранить и транспортировать имплантат следует только в тщательно очищенной посуде из стекла или пластмассы. Несоблюдение требований, исключающих контаминацию, ухудшает биотолерантные свойства металлических имплантатов.
При имплантации необходимо использовать инструменты (особенно те, которые соприкасаются с костной тканью) из того же металла, что и имплантат. Всегда следует брать имплантат только за головку. Из-за большой твердости материала нужно осторожно применять керамические, сапфировые имплантаты, в которых явление контаминации имеет место на всех этапах. Изучение возможности применения сапфировых имплантатов, выпускаемых НПО «Монокристаллреактив» (Харьков), показало высокую культуру производства. При доводке имплантатов по длине, согласно рентгенограмме,
при последующем исследовании, как и предполагалось, было обнаружено засорение поверхности никелем от алмазного диска. Применение таких имплантатов возможно только после кипячения в царской водке в течение 10 — 15 мин, промывки и стерилизации.
Наши исследования показали, что явление контаминации имеет большое значение для имплантологии. Вследствие засорения поверхности имплантата изменяется электропотенциал, а в результате этого и электростатическое воздействие на окружающие ткани. Образование микрогальванических пар, продуктов коррозии и нарушенная оксидная пленка на поверхности имплантата вызывают асептическое воспаление. Особенно это относится к титану. При обработке, транспортировке, стерилизации, операции имплантации надо исключить засоренные поверхности имплантата и костного ложа.
Говоря о качестве имплантатов, нельзя обойти вопрос о том, какой должна быть поверхность: ровная,
нужной геометрии, гладкая, рифленая, шершавая. Каждый имплантат имеет определенную опорную площадь. Известно также, что металл имплантатов не безвреден. Логично предположить, что опорную площадь поверхности на микроуровне надо уменьшать, чтобы отрицательное действие металла имплантата на окружающие ткани было минимальным. Необходимо обратить внимание на то, что объем опорной костной ткани при любом виде микрорельефа остается тем же.
A. Schroeder (1976) ввел в имплантологию покрытие плазменным способом поверхности титановых имплантатов химически чистым титаном и таким образом в 6 раз увеличил площадь поверхности. L. Linkow, (1968), J. Weiss (1973), Н. Grafelmann (1983) делают поверхность имплантатов рифленой, обрабатывают ее в пескоструйном аппарате.
В своей работе мы исходили из того, что зубы имеют подвижность и что не всегда можно расчитывать на репаративную способность костной ткани.
В связи с этим имплантат должен прочно стоять в костном ложе благодаря натягу. Для того чтобы при микроподвижности поверхность имплантата не травмировала окружающие ткани, мы делаем ее ровной и полированной. Со временем оголяются шейка и плечи имплантата; лишь полированные части не создают условия для развития воспаления. Следовательно, протез на имплантате послужит дольше. Учитывая это, мы всегда стараемся ввести полированные имплантаты с натягом и достичь множественного, плотного контакта имплантата с костной тканью. Наблюдение за 1330 имплантатами в течение 9 лет показало обоснованность такого подхода (малое количество компликаций и удалений имплантатов).
В течение последних 30 лет ведется интенсивный поиск оптимального материала и конструкции имплантата. Предлагались различные конструкции для восстановления жевательной функции и эстетики. Однако вопрос остается спорным. Как видно из табл. 4, в 1968—1982 гг. было подано 32 заявки на изобретения только по пластиночным имплантатам. Поиск оптимальной конструкции идет методом проб и ошибок. Каждый оригинальный подход к решению проблемы способствует изысканиям в новом направлении. По данным литературы, наибольшее распространение нашли пластиночные ЭИ из титановых сплавов с закругленной и сплошной базой [Linkow L., 1968; Weiss J., 1975; Zak R.,
Grafebmann H., Linkow L., 1980; Vassos D.]
При разработке отечественных пластиночных ЭИ использовалось техническое решение по заявке № 3230 от 19.08.82 г. (ФРГ), касающееся соотношения пло-

Рис. 27. Первые ЭИ отечественного производства.
щади отверстий и всей площади имплантата. Фирмы "Fratronic Incorporation", "Ultimatic Incorporation", "Amec SA" выпускают наборы вариантов имплантатов для верхней и нижней челюстей. Изготавливать такое количество вариантов штамповочно-фрезерным способом очень дорого. G. Muratori и L. Linkow (1981) предлагают выпускать стандартные имплантаты-заготовки и в каждом случае подгонять их по рентгенограмме. Наш клинический опыт показал, что шести вариантов пластиночных ЭИ вполне достаточно для восстановления дефектов зубных рядов. Чаще всего использовались I, II, III варианты (рис. 27). Соответственно этому в стоматологическом комплекте имплантатов и инструментов количество имплантатов было перераспределено. При лечении больных нами использовано 770 пластиночных имплантатов, в том числе 378 титановых. Получается, что в комплекте имеющиеся титановые имплантаты решают проблему только наполовину. Для решения вопроса необходимо включить в комплект шесть аналогичных вариантов пластмассовых заготовок имплантатов для отливки из КХС на местах. Имплантаты из КХС можно делать более тонкими или длинными и таким образом расширять их возможности. По нашему мнению, можно использовать как стандартные, так и изготавливаемые по заказу ЭИ из титана и КХС. Организация изготовления только III варианта пластмассовой заготовки для нужд нашей лаборатории намного повысила качество работы и расширила возможности лаборатории. Благодаря биотолерантным свойствам, прочности и широким показаниям к применению металлические имплантаты, по-видимому, никогда не потеряют своего значения.
Биотолерантные свойства металлических имплантов зависят от качества обработки поверхности. Необхоимо отметить отсутствие специальных приборов, позволяющих определить качество имплантатов и протезов. Все оценивается на глаз, а этого недостаточно для успешного развития имплантологии.
Источник: Суров О. Н., «Зубное протезирование на имплантатах» 1993