Арсенал методов гистологии, эмбриологии и цитологии включает (наряду с классической гистологической техникой) методы исследования структуры и функции клетки, применяемые в клеточной биологии. В главе дан краткий обзор методов (собственно гистологическая техника [А], гистохимические и цитохимические методы [Б], культивирование in vitro [В], цитофотометрия [Г], радиоавтография [Д], генетические маркёры [Е]).
А. Гистологическая техника. Кратко рассмотрены: подготовка материала [А I] к окрашиванию и микроскопии, окрашивание [А 2] и микроскопирование в CM и ЭМ [А 3].
- Подготовка материала к микроскопии. Основные типы материала для микроскопии: срезы, мазки (гематологические [например, крови и красного костного мозга] и гинекологические [например, ЯЛ/7-мазки]), мазки-отпечатки (например, слизистой оболочки щеки для определения тельца Барра), сколы \см. А 3 б (3)], смывы.
а. Фиксация сохраняет структуру клеток, тканей и органов, предотвращает их бактериальное загрязнение и ферментное переваривание, стабилизирует макромолекулы путём химического их сшивания. Фиксирующая жидкость. Быстрое проникновение химического фиксатора в живую ткань — условие сохранности структур in situ. Лучшую сохранность структур обеспечивает мгновенное замораживание образцов (в т.ч. при лиофилизации). Лиофилизация — один из способов подготовки материала как для CM, так и для ЭМ. Небольшие кусочки ткани подвергают быстрому замораживанию, прекращающему метаболические процессы. Последующее высушивание в вакууме вызывает возгонку льда. Метод позволяет исключить обработку ткани в промежуточных средах (обезвоживание и заливка).
- Светооптическая микроскопия. Наиболее распространённые фиксаторы — формалин, спирты, глутаральдегид. Небольшие кусочки ткани фиксируют, помещая их в раствор фиксатора. Целые органы перед выделением перфузируют, т.е. прокачивают фиксатор через сосудистую систему органа.
- Электронная микроскопия. Для фиксации материала применяют глутаральдегид и тетраоксид осмия.
б. Обезвоживание готовит фиксированную ткань к проникновению в неё сред для заливки. Вода живой ткани, а также вода фиксирующих смесей (большинство фиксаторов — водные растворы) после фиксации должна быть полностью удалена. Стандартная процедура удаления воды — обезвоживание в спиртах возрастающей от 60° до 100° крепости.
в. Заливка — необходимая процедура, предваряющая приготовление срезов. Заливка делает ткань прочной, предотвращает её раздавливание и сминание при резании, даёт возможность получить тонкие срезы стандартной толщины. Наиболее распространённая среда для заливки — парафин. Используют также целлоидин, пластические среды и смолы.
г. Приготовление срезов
- Микротом. Серийные и отдельные срезы различной толщины и площади для CM готовят при помощи специального устройства — микротома (рис. 1-1). Стальной нож микротома позволяет получить срезы толщиной 3-8 мкм из залитых в парафин,
целлоидин или полиэтиленгликоль кусочков ткани. Стеклянные или алмазные ножи позволяют получить срезы толщиной I -5 мкм из материала, залитого в смолу. Приготовленные для последующей световой микроскопии срезы монтируют на предметное стекло.
- Криостат. Если фиксация приводит к инактивации предполагаемых для изучения молекул (например, ферментов, биогенных аминов), используют криостат, позволяющий получить для CM срезы толщиной 5-25 мкм в термически изолированной камере с низкой и регулируемой температурой.
- Ультратом (ультрамикротом) позволяет получать срезы из материала, залитого в смолу. При помощи стеклянных или алмазных ножей готовят ультратонкие срезы толщиной от 0,08-0,1 мкм (ЭМ) до 0,5 мкм (полутонкие срезы для CM).
- Вибротом. Для получения тонких срезов фиксированных и нефиксированных тканей без замораживания используют вибротом.
- Подготовка материала к микроскопии методом криосколов [замораживание- скалывание, см. А 3 б (3)].
- Мазки и смывы готовят для микроскопии высушиванием на предметном стекле либо кратковременной фиксацией.
- Окрашивание срезов и мазков. Перед окрашиванием срезы депарафинируют и доводят до воды в спиртах нисходящей крепости, после чего стекло со срезами помещают в водный раствор красителя. Клеточные структуры, как правило, неразличимы даже при большом увеличении микроскопа, они бесцветны и прозрачны. Для выявления тканевых компонентов, отдельных клеток и клеточных структур с 50-х годов прошлого века используют красители-лиганды с высоким сродством к различным компонентам ткани и с определёнными цветооптическими свойствами. Способность тканевых компонентов по-разному окрашиваться зависит от кислотно-основных (щелочных) свойств веществ, входящих в их состав,
а. Светооптическая микроскопия
- Кислые красители (например, эозин, конгокрасный, разные оранжевые) связываются со структурами или веществами, имеющими щелочную реакцию. Это аци-
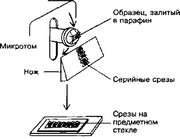
Рис. 1-1. Микротом — устройство для получения гистологических срезов. Различают санные и ротационные микротомы. На рисунке — ротационный микротом. Блоки, содержащие кусочек органа, закрепляют в подвижном объектодержателе. При его опускании на ноже остаются серийные срезы, их снимают с ножа и монтируют на предметное стекло для последующей обработки и мик- роскопирования [из Alberts Betal, 1989]
дофильные (основные) компоненты ткани (например, разные цитоплазматические белки [типичный пример — гемоглобин эритробластов и эритроцитов]).
- Щелочные красители (например, гематоксилин, метиленовый синий, толуиди- новый синий, азур) связываются с базофильными (кислыми) компонентами ткани (например, нуклеиновые кислоты ядра и рибосом).
- Стандартные красители. Часто используют смеси кислых и щелочных красителей (например, гематоксилин и эозин). В гематологической практике мазки и срезы окрашивают специальными смесями (гематологические красители, см. главу 18).
б. Электронная микроскопия. Для ЭМ материал контрастируют солями тяжёлых металлов, используют преимущественно цитрат свинца и уранилацетат.
3. Микроскопия а. Световая микроскопия (рис. 1-2)
(I) Оптические свойства линз
(а) Увеличение — физическое свойство линз объектива и окуляра. Увеличение микроскопа приблизительно оценивают как произведение увеличения объектива и увеличения окуляра.
Минимальный размер d наблюдаемого объекта определён формулой:
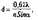
где а — половина угловой ширины конуса световых лучей, собираемых линзами объектива; п — коэффициент преломления среды, отделяющей изучаемый объект от линз объектива или конденсора; X — длина волны света. nSina — апертура.
(б) Разрешение микроскопа — величина, обратная d. Чем больше апертура, тем выше разрешение, но при этом уменьшается глубина резкости.
- Повысить разрешение можно за счёт увеличения апертуры. Увеличить апертуру можно путём увеличения коэффициента преломления. Коэффициент преломления жидких сред (иммерсионные среды) больше коэффициента преломления
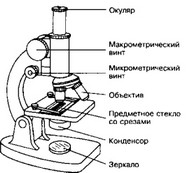
Рис. 1-2. Микроскоп. Этот оптический прибор позволяет наблюдать мелкие объекты. Увеличение изображения достигается системой линз объектива и окуляра. Зеркало, конденсор и диафрагма направляют световой поток и регулируют освещение объекта. Механическая часть микроскопа включает штатив, предметный столик, макро- и микрометрический винт, тубус, тубусодержатель [из Alberts В et al, 1989]
воздуха (п = 1,0). В микроскопии используют несколько иммерсионных сред: масляную, глицериновую, водную.
- Предел разрешения светового микроскопа определяется длиной световой волны и апертурой линз. Теоретически возможный предел разрешения светового микроскопа — 0,2 мкм (минимальное расстояние, на котором различимы два объекта).
- Оптические артефакты. Объектив состоит из нескольких стеклянных линз. Первая линза — сферическая или полусферическая — предназначена для получения увеличенного изображения. Все остальные линзы корригируют оптические артефакты (аберрации).
(а) Хроматические аберрации. Фокусное расстояние линзы для лучей разной длины волны различно. Поэтому при использовании немонохроматического света формируемое линзой изображение предмета имеет окрашенные края. Хроматические аберрации устраняют ахроматические и апохроматические объективы.
(б) Сферические аберрации. Различие оптических свойств центральной и периферической частей сферической линзы — причина сферических аберраций. Их устраняют апохроматические объективы. Сферическая линза не позволяет одновременно фокусировать изображение по всему полю. Для устранения этого недостатка применяют специальные объективы — планахроматы и планапохроматы. Наилучшим объективом считают планапохромат с высокой числовой апертурой.
- Специальные типы микроскопии
(а) Темнопольная. Используют специальный конденсор, выделяющий контрастирующие структуры неокрашенного материала. Темнопольная микроскопия позволяет наблюдать живые объекты. Наблюдаемый объект выглядит как освещённый на тёмном поле. При этом лучи от осветителя падают на объект сбоку, а в линзы микроскопа поступают только рассеянные лучи.
(б) Фазово-контрастная микроскопия позволяет изучать живые и неокрашенные объекты. При прохождении света через окрашенные объекты изменяется амплитуда световой волны, а при прохождении света через неокрашенные — фаза световой волны, что и используют для получения высококонтрастного изображения в фазово-контрастной и интерференционной микроскопии.
(в) Поляризационная микроскопия — формирование изображения неокрашенных анизотропных структур (например, коллагеновые волокна и мио- фибриллы).
(г) Интерференционная микроскопия объединяет принципы фазово-контраст- ной и поляризационной микроскопии и применяется для получения контрастного изображения неокрашенных объектов. Специальная интерференционная оптика (оптика Номарского) нашла применение в микроскопах с дифференциальным интерференционным контрастом.
(д) Люминесцентная микроскопия применяется для наблюдения флюоресцирующих (люминесцирующих) объектов. В люминесцентном микроскопе свет от мощного источника проходит через два фильтра. Один фильтр задерживает свет перед образцом и пропускает свет длины волны, возбуждающей флюоресценцию образца. Другой фильтр пропускает свет длины волны, излучаемой флюоресцирующим объектом. Таким образом, флюоресцирующие объекты поглощают свет одной длины волны и излучают в другой области спектра.
- Катехоловые амины. Объект может флюоресцировать после специальной обработки ткани. Так, катехоламины, включая адреналин и норадреналин, флюоресцируют после обработки ткани в парах параформальдегида при 60-80 °С. Метод разработан группой шведских учёных и известен как метод Фалька.
- Флюоресцирующие красители (флюоресцеин, родамин и др.) избирательно связываются со специфическими макромолекулами (табл. 1-1).
Таблица 1-1. Гистохимическое выявление разных веществ
|
Определяемое вещество |
Реакция или выявляющий реактив |
|
Нуклеиновые кислоты |
Реакция Фёльгена (реактив Шиффа-фуксж) Акридиновый оранжевый (с ДНК флюоресценция жёлто-зелёного цвета, с РНК — красно-оранжевого) Щелочные красители (толуидиновый синий, метиленовый синий, гематоксилин) |
|
Белки: |
|
|
гистоны и протамины |
Прочный зелёный |
|
аминокислоты: |
|
|
тирозин |
Реакция Мимона |
|
аргинин |
Реакция Сакагуши |
|
аминогруппы |
Нафтоловый жёлтый |
|
Углеводы: |
|
|
поли-и олигосахариды |
Реакция Шйффа с перйодной кислотой |
|
полисахариды |
Рутениевый красный |
|
гликозаминогликаны |
Альциановый синий |
|
a-D-глюкоза и a-D-манноза |
Конканавалин А |
|
N-ацетилглюкозамин |
Агглютинин из зародышей пшеницы |
|
фукоза |
Лектин из семян лотоса |
|
а-галактоза |
Агглютинин из земляного ореха, лектин из сои |
|
Липиды |
Проционовый жёлтый, суданы |
б. Электронная микроскопия. Теоретически разрешение просвечивающего ЭМ составляет 0,002 нм. Реальное разрешение современных микроскопов приближается к
- 1 нм. Для биологических объектов разрешение ЭМ на практике составляет 2 нм.
- Просвечивающий электронный микроскоп состоит из колонны, через’кото- рую в вакууме проходят электроны, излучаемые катодной'нитью. Пучок электронов, фокусируемый кольцевыми магнитами, проходит через подготовленный образец. Характер рассеивания электронов зависит от плотности образца. Проходящие через образец электроны фокусируют, наблюдают на флюоресцирующем экране и регистрируют при помощи фотопластинки.
- Для получения трёхмерного изображения поверхности исследуемого объекта применяют сканирующий электронный микроскоп.
- Для изучения внутреннего строения клеточных мембран применяют метод сколов (замораживание-скалывание). Клетки замораживают при температуре жидкого азота (-196 ”С) в присутствии криопротектора и используют для изготовления сколов. Плоскости скола проходят через гидрофобную середину двойного слоя липидов. Обнажённую внутреннюю поверхность мембран оттеняют платиной, полученные реплики изучают в сканирующем ЭМ.
в. Другие технологии визуализации биологических объектов.
- Компьютерная интерференционная микроскопия позволяет получить высококонтрастное изображение при наблюдении субклеточных структур.
- Лазерная конфокальная микроскопия даёт возможность получить отчётливое изображение и наблюдать объекты в фокусе по всему полю. При сочетании с компьютерной техникой возможна пространственная реконструкция изучаемого объекта.
- Для решения специальных задач применяются ЯМР-интроскопия, позитрон- ная эмиссионная томография, рентгеновская микроскопия (позволяет наблюдать объекты не в вакууме, а в обычных условиях).
Б. Гистохимические методы позволяют установить локализацию определённых веществ или биохимических процессов в тканевых и клеточных структурах. Для проведения гистохимической реакции обычно используют криостатные срезы, реже — срезы лиофилизиро- ванной ткани. О локализации исследуемого вещества судят по отложению окрашенного продукта реакции. Более высокого разрешения добиваются в ЭМ (цитохимические методы). В этом случае применяют специальные методы подготовки объекта (криоультрамикро- томия, замещение в замороженном состоянии, инертное обезвоживание и др.).
- Гистохимия ферментов. В гистохимической практике ферменты подразделены на 6 главных классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы). В ходе стандартной гистоферментной реакции срезы ткани помещают в раствор субстрата и специального вещества, способного образовать конечный продукт реакции в виде окрашенного осадка. Следует исключить возможность инактивации фермента и диффузию конечного продукта реакции. Для некоторых клеток и органелл характерны ферменты-маркёры:
а. Кислая фосфатаза — лизосомы.
б. Щелочная фосфатаза — эндотелий кровеносных капилляров.
в. Сукцинатдегидрогеназа (СДГ) и цитохромоксидаза — митохондрии.
г. Глюкозо-6-фосфатаза — эндоплазматическая сеть.
- Цитохимические методы исследования мазков крови приведены в главе 18.
- Иммуногистохимия. Принцип проведения иммуногистохимической реакции основан на специфическом взаимодействии меченых антител (AT) с тканевыми антигенами (Ar). Метка: AT метят различными способами: флюорохромами (флюоресцеин, родамин и др.), при помощи ферментной реакции (пероксидаза хрена) или электроноплотными частицами (ферритин, коллоидное золото). Применяют два варианта иммуногистохимичес- ких реакций: прямой (рис. 1-3) и непрямой (рис. 1-4).
- Химические компоненты. В таблице 1-1 приведены наиболее распространённые методы идентификации разных химических компонентов.
- Гибридизация in situ. Метод позволяет выявить нужные последовательности ДНК или РНК. Последовательности нуклеиновых кислот, связанные с меткой (32P1 биотин, характеризующийся высоким сродством к авидину), находят комплементарную последовательность в клетке. Метод гибридизации in situ даёт возможность изучать локализацию генов и их экспрессию. В ходе дифференцировки клеток координированно включаются и выключаются большие группы генов. Гибридизация одноцепочечной молекулы ДНК (ДНК-зонд) с комплементарной клеточной РНК позволяет ответить на вопрос, происходит или нет экспрессия определённого гена, и установить уровень, на котором она может меняться, — транскрипция ДНК, сплайсинг РНК, трансляция.
В. Клеточная, тканевая и органная культуры. Методы культивирования применяют для исследования функции изолированных живых клеток и тканей вне влияния регулятор-
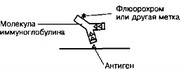
Рис. 1-3. Иммуноцитохимическая реакция. Прямой метод предполагает использование меченых AT к интересующему Ar. AT взаимодействуют с Ar в местах их локализации. Эти места выявляют при помощи метки, связанной с AT [из Polak JM, VanNorden S, 1984]
ных механизмов целостного организма. Следует помнить, что ситуации in vivo и in vitro не идентичны, клетки и ткани проявляют в этих состояниях различные свойства и по-разному реагируют на одинаковые воздействия.
- Питательная среда для культивирования содержит аминокислоты, витамины, гормоны, факторы роста, углеводы, антибактериальные и антигрибковые препараты и другие добавки на буферном изотоническом солевом растворе.
- Получение клеточных культур. Кусочки ткани измельчают, обрабатывают гидролитическими ферментами (трипсин, коллагеназа, гиалуронидаза и др.), после чего клетки могут быть разделены в зависимости от их размеров и массы путём центрифугирования. Для сортировки клеток используют меченные флюоресцирующими веществами AT, которые избирательно связываются с Ar, специфичными для определённых клеточных типов. Используемое для этой цели устройство называют сортер.
- Типы культур
а. Клеточная культура содержит суспензию клеток или клетки, прикрепившиеся к субстрату. Культивирование проводят в стеклянной или пластиковой посуде, поверхность которой предварительно покрывают желатином, полилизином, коллагеном и другими компонентами внеклеточного матрикса. Культивируемые клетки формируют монослой или отдельные клеточные колонии — клоны. Культивирование проводят в атмосфере строго определённого газового состава в специальном устройстве — COj- инкубаторе.
б. Клеточная линия. Клетки, полученные для культивирования из ткани или органа, сначала составляют небольшую популяцию — первичная культура. При длительном культивировании и многочисленных пересевах из первичной культуры может быть получена клеточная линия — клетки, способные многократно размножаться. Линии трансформированных клеток неопределённо долго хранятся в жидком азоте, их в любое время можно использовать для получения клеточных культур и проведения различных исследований.
- Клетки линии HeLa широко применяют для исследования влияния на клетки фармакологических препаратов, токсических агентов, тератогенов, бактерий, вирусов и т.д.
- Клеточная линия Нер-2 необходима при определении аутоантител в диагностике системной красной волчанки.
в. Тканевая и органная культуры. Культивируют фрагменты тканей или органов. Метод часто используют для исследования механизмов эмбриональной дифференци- ровки и морфогенеза.
Г. Цитофотометрия. Метод предназначен для количественного определения различных веществ и их локализации в клетке по характеристическому поглощению этими веществами
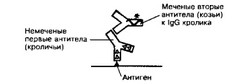
Рис. 1-4. Иммуноцитохимическая реакция. Непрямой метод предполагает использование двух различных AT. Первые AT реагируют с Ar ткани. Связанные с меткой вторые AT специфически взаимодействуют с первыми AT, которые для вторых AT являются Ar. Метод значительно чувствительнее прямого, т.к. с каждой молекулой первых AT связывается несколько молекул вторых AT, содержащих метку (например, пероксидазу) [из PolakJM, VanNorden S, 1984)
Таблица 1-2. Радиоавтографическое выявление некоторых веществ
|
Определяемое вещество |
Изотоп и предшественник |
|
ДНК |
3Н-тимидин, 14С-ТИМИДИН |
|
РНК |
3Н-уридин, 3Н-цитидин |
|
Белок |
355-аминокислоты |
света определённого спектра. Цитофотометрию проводят в ультрафиолетовом, видимом, инфракрасном, рентгеновском диапазонах и применяют для определения количества нуклеиновых кислот, белка, активности ряда ферментов, поэлементного анализа химического состава клеток. Чувствительность метода — IO'12 г, что на несколько порядков выше чувствительности микрохимических методов исследования.
Д. Радиоавтография (табл. 1-2). Метод позволяет судить о синтезе различных макромолекул в субклеточных структурах. В среду обитания клеток in vivo или in vitro вводят радиоактивный предшественник синтеза макромолекул. Радиоактивность поглотившей метку структуры регистрируют по восстановлению зёрен серебра в покрывающей препарат фотоэмульсии.
Е. Генетические маркёры. В экспериментальной и клинической практике нашли применение хромосомные маркёры, т.н. кластеры дифференцировки (CD-маркёры), мутантные линии животных (модели болезней человека), клонированные гены (нормальные и патологические аллели) и полипептиды — продукты их экспрессии. Для диагностики ряда моногенных заболеваний возможно определение дефекта гена.
- Клонированные гены. В настоящее время выполняется многолетняя программа Геном Человека, цель которой — описание нуклеотидной последовательности и хранение клонированных генов человека (в идеале —- всех аллелей). На старте находится ещё более грандиозная программа — Разнообразие Генов Человека. Значение этих программ для медицины переоценить невозможно. Уже сейчас получены впечатляющие результаты, позволяющие оценивать риск развития наследуемых болезней, проводить их диагностику и терапию (полученные методами генной инженерии и применяемые для заместительной терапии полипептиды человека [например, инсулин, гормон роста, ин- терфероны], трансфекция генов [см. главу 18]).
- Хромосомные маркёры известны давно (например, тельце Барра, Y-хромосома — детерминанта генетически мужского пола, филадельфийская хромосома). Шесть из 1000 детей рождаются с различными хромосомными нарушениями.
а. Общая характеристика
- Тип поражения. Большинство хромосомных заболеваний возникает в результате мутаций de novo, по этой причине у других членов семьи их не обнаруживают. Хромосомные заболевания подразделяют на мозаицизм, аномалии числа и аномалии структуры хромосом.
(а) Аномалии числа хромосом. Примеры заболеваний, связанных с аномалией числа хромосом, — трисомии: хромосомы 21 (синдром Дауна), 18, 13, синдромы Кляйнфёлтера и Тёрнера.
(б) Аномалии структуры хромосом — асимметричная транслокация, деле- ции, дупликации, инверсии и многие другие. Примеры заболеваний: синдромы Прадер-Вйми, кошачьего крика, опухоль Вйлъмса.
(в) Мозаицизм — хромосомная аномалия, характеризующаяся наличием двух и более клеточных линий с различным хромосомным набором. Мозаицизм — следствие нарушения митотического деления клеток на раннем этапе эмбрионального развития.
- Методы хромосомного анализа. Исследуют находящиеся в метафазе митоза клетки из любой культуры тканей.
(а) Периферическая кровь. Стимулированные фитогемагглютинином клетки культивируют in vitro не менее трёх дней.
(б) Костный мозг. Исследование клеток костного мозга позволяет сократить время анализа до 6 часов. Наиболее часто исследование костного мозга проводят у больных лейкозами.
(в) Внутренние органы. Изучают также клетки внутренних органов и новообразований.
б. Аномалии числа аутосом. Хромосомная аномалия, при которой обнаруживают дополнительную хромосому какой-либо пары, — следствие нерасхождения хромосом в мейозе при ово- или сперматогенезе — трисомия. Лишь несколько типов трисо- мий совместимо с жизнью.
- Синдром Дауна встречают у одного ребёнка из 700 новорождённых. Как правило, при синдроме Дауна обнаруживают трисомию хромосомы 21, но возможны её транслокация и реже мозаицизм. Критический возраст матери, после которого вероятность рождения больного ребёнка резко возрастает, составляет 35 лет.
(а) Трисомия 21. У 95% детей с синдромом Дауна обнаруживают 47 хромосом, причём три из них из 21 пары. В небольшом числе случаев дополнительную хромосому 21 ребёнок получает от отца. Возвратный риск — 1-2% (с возрастом матери увеличивается).
(б) Транслокация. У 4% детей с синдромом Дауна в кариотипе 46 хромосом и транслокация дополнительной хромосомы 21 [обычно в хромосомы группы D (13, 14, 15) или группы G (21, 22)].
- Три из четырёх всех случаев транслокаций при синдроме Дауна обусловлены мутацией de novo.
- 25% случаев транслокаций носит семейный характер, т.е. у одного из родителей выявляется симметричная транслокация с вовлечением хромосомы
- В таких случаях возвратный риск гораздо выше (до 15%).
(в) Мозаицизм. У 1-2% детей с синдромом Дауна находят мозаицизм, когда наряду с нормальной клеточной линией, содержащей 46 хромосом с двумя хромосомами из 21 пары, прослеживается и другая, где определяется 47 хромосом с трисомией хромосомы 21.
- Трисомия 13. Частота — до I на 4000 новорождённых. Прогноз неблагоприятный: 50% больных умирают на первом месяце жизни, 70% не доживают до 6 месяцев, 90% больных умирают, не достигнув I года.
(а) Трисомия. 75% случаев — появление дополнительной хромосомы 13. Между частотой возникновения этой трисомии и возрастом матери также прослеживается зависимость.
(б) Транслокация. 20% случаев — следствие транслокации.
- Три из четырёх таких случаев — мутация de novo.
- В четверти случаев транслокация имеет наследственный характер (возвратный риск 15%).
(в) Мозаицизм. В 5% случаев наблюдается мозаицизм: наряду с нормальными клетками, имеющими 46 хромосом, присутствует клеточная линия с 47 хромосомами.
- Трисомия 18 встречается у I из 8000 новорождённых детей. В 90% случаев трисомии 18 — нарушение расхождения хромосом в мейозе, в 10% — мозаицизм, редко — транслокация. Прогноз крайне неблагоприятный: 90% больных не доживают до I года.
в. Аномалии половых хромосом
- Синдром Тёрнера встречается у одной из 2500 новорождённых девочек. Характерно наличие только одной нормальной Х-хромосомы (ХО-синдром). Прогноз зависит от вида и тяжести нарушений. В большинстве случаев заболевание не сказывается на продолжительности жизни.
(а) У 55% девочек с синдромом Тернера обнаруживают кариотип 45Х.
(б) В 25% случаев наблюдают изменение структуры одной из Х-хромосом. Как правило, такие структурные аномалии проявляются как делеция участка хромосомы либо как дупликация длинного или короткого плеча хромосомы с последующей утратой второго плеча.
(в) В 15% случаев выявляют мозаичность в виде двух или более клеточных линий, одна из которых имеет кариотип 45Х, а другая представлена кариоти- пом 46ХХ или 46XY. Возможны и три клеточные линии с кариотипами 45Х, 46ХХ, 47ХХХ.
(г) Синдром Нунан имеет схожие фенотипические проявления, однако этиологически не связан с синдромом Тернера. В отличие от последнего, при синдроме Нунан заболеванию подвержены как мальчики, так и девочки, а в клинике доминирует задержка умственного развития.
- Синдром Кляйнфёлтера развивается при появлении дополнительной Х-хромо- сомы и встречается у I из 1000 новорождённых мальчиков.
(а) У 80% мальчиков с синдромом Кляйнфёлтера найден кариотип 47XXY.
(б) В 20% случаев находят мозаицизм (одна из клеточных линий имеет кариотип 47XXY).
- Кариотип 46ХХ фенотипически похож на кариотип при синдроме Кляйнфёлтера. Кариотип 46ХХ находят у I из 25000 новорождённых. Причина — транслокация короткого плеча Y-хромосомы в другую хромосому.
- Кариотип 47ХХХ. Частота — I на 1000 новорождённых девочек. Как правило, не обнаруживают никаких фенотипических особенностей, за исключением высокого роста. Среднее значение IQ составляет 90. У больных прослеживается тенденция к развитию шизофрении.
- Кариотип 47XYY. Частота — I на 1000 новорождённых мальчиков. Рост в среднем составляет 180 см. Мнение о том, что у этих лиц наблюдаются различные отклонения в поведении, не имеет оснований.
г. Аномалии структуры хромосом
- Делеции. Некоторые синдромы могут быть обусловлены утратой концевого участка хромосомы (концевая делеция) или потерей генетического материала в середине хромосомы (интерстициальная делеция). Причина большинства деле- ций — мутация de novo. Однако при терминальных делециях может наследоваться асимметричная хромосомная транслокация (обмен между хромосомами неравными участками) от родителей, несущих симметричную ре- ципрокную транслокацию (эквивалентный обмен генетическим материалом между двумя хромосомами).
(а) Диагностика. Для выявления малых делеций необходим хромосомный анализ высокой разрешающей способности (в прометафазе, когда наиболее чётко видна структура хромосом).
(б) Синдром кошачьего крика встречается у I из 50000 новорождённых. Причина — терминальная делеция хромосомы 5р.
(в) Синдром Прадер-Вйлди
- У 70% больных наблюдается делеция хромосомы 15 (отцовский аллель).
- У 5% больных — перестройка хромосомы 15.
- В редких случаях у больного с внешне нормальным хромосомным набором выявляется материнская дисомия, когда в ходе мейоза происходит потеря отцовской хромосомы 15, но в зиготу попадает две хромосомы 15 от матери. Материнская дисомия, находящаяся в основе синдрома Прадер-Вими, — пример импринтного гена (см. ген в главе 18).
(г) Ретинобластома. При одной из форм ретинобластомы имеется интерстициальная делеция хромосомы 13q.
(д) Опухоль Вйльмса. В прометафазе клеток у детей с опухолью Вильмса и аниридйей — интерстициальная делеция 11р13.
- Парциальные трисомии — наличие в кариотипе дополнительного хромосомного материала, включённого в конец длинного или короткого плеча хромосомы или в любой её участок. Часть дополнительной хромосомы может быть расположена и отдельно от других хромосом, имея собственную центромеру — малая, или маркерная хромосома.
- Дефекты гена. Описано около 5000 наследуемых заболеваний (дефекты одного гена — моногенные болезни) с различным типом наследования: аутосомно-до- минантный — 91, аутосомно-рецессивный — р, сцепленный с полом (точнее, с X- или с Y-хромосомой) -— К.
а. Аутосомно-доминантные синдромы обычно (хотя и не всегда) — результат мутации гена, кодирующего конкретный белок. Каждый ребёнок при одном больном родителе имеет 50% риск унаследовать заболевание. Обычно мутантный ген наследуется от одного из родителей, но иногда это может быть первым случаем проявления аутосомно-доминантного заболевания в данной семье — новая мутация, произошедшая в яйцеклетке или сперматозоиде.
- Индивидуальная вариабельность проявления — характерный признак экспрессии мутантного гена. Например, поликистоз почек у одних больных проявляется ранней почечной недостаточностью, в то время как у других и в том же возрасте — только гипертензией при сохранении нормальной функции почек.
- Плейотропность. Мутантный доминантный ген обычно оказывает влияние на несколько тканей или органов.
- Методы диагностики
(а) Анализ сцепления. Многие рестрикционные фрагменты (РФ) располагаются близко от исследуемого гена в той же хромосоме и сегрегируют вместе с геном, что позволяет провести анализ сцепления.
- Для большинства заболеваний необходимо обследование нескольких членов семьи,
включая хотя бы одного больного. В информативных семьях исследуют ДНК лейкоцитов или фибробластов кожи, а также амниоциты или клетки ворсин хориона. Под информативными понимают семьи, в которых РФ хромосом с мутантным геном отличаются от РФ хромосом с нормальным геном, или же такие семьи, в которых РФ у родителей с мутантным геном отличаются от РФ родителей без мутантного гена. Семья, в которой у обоих родителей РФ одинаковы, не является информативной.
- Анализ сцепления может быть использован при некоторых наследуемых заболеваниях (например, хорея Хантингтона, кистозный фиброз, мышечная дистрофия Дюшённа). В связи с расшифровкой многих мутаций генов кистозного фиброза и дистрофина, соответственно приводящих к развитию муковисцидоза и мышечной дистрофии, диагностику этих заболеваний в настоящее время проводят преимущественно прямым определением патологического гена.
(б) Прямое исследование ДНК значительно упрощает диагностику моноген- ных заболеваний даже в тех случаях, когда ген не идентифицирован; благодаря использованию рестрикционных эндонуклеаз и технологии рекомбинантной ДНК стало возможным выявлять полиморфизм длины рестрикционных фрагментов, что позволяет обнаруживать аномальные гены. При некоторых заболеваниях (например, при серповидно-клеточной анемии) генетический анализ позволяет при помощи комплементарных ДНК-зондов напрямую выявить патологический ген. В этих случаях отпадает необходимость обследования других членов семьи.
- Синдром Марфана встречается с частотой I на 20000 новорождённых. Причина — мутация гена фибриллина, структурного белка соединительной ткани. Характерны нарушения обмена кислых мукополисахаридов (гликозаминогли- канов) типа хондроитинсерной и гиалуроновой кислот как в волокнах, так и в основном веществе соединительной
