Показатели, характеризующие вторую фазу:
Протромбиновое время
Протромбинове время для взрослых в норме 11—15 с, для новорожденных — 13—18 с.
Протромбиновое время (ПВ) характеризует первую {протромбинообразование) и вторую (тромбинообразование) фазы плазменного гемостаза и отражает активность протромбиново- го комплекса (факторов VII, V, X и собственно протромбина — фактора II).
Увеличение протромбинового времени говорит о наклонности к гипокоагуляции и может зависеть от различных причин:
Укорочение протромбинового времени говорит о наклонности к гиперкоагуляции и может быть отмечено в начальных стадиях тромбоза глубоких вен нижних конечностей, при полицитемии, в последние месяцы беременности. Укорочение протромбинового времени вызывают следующие лекарственные препараты: ацетилсалициловая кислота (в небольших дозах), меркаптопурин, пероральные контрацептивы.
Определению протромбинового времени отводится ведущая роль в контроле за пероральной антикоагулянтной терапией. Однако при таком контроле протромбиновое время зависит от чувствительности используемого для этих целей тромбопластина. Поэтому сравнение результатов исследований с использованием различных тромбопластинов является важной задачей практической медицины. Разные тромбопластины различают по ISI (International Sensitivity Index — Международный индекс чувствительности), который прилагается к описанию каждого набора. В 1983 г. ВОЗ совместно с Международным обществом тромбоза и гемостаза приняли тромбопластин из мозга человека за референтный и установили, что ISI этого тромбопластина равен 1,0 (Международный референтный препарат Всемирной организации здравоохранения). Все другие коммерческие тромбопластины калибруются по нему, и для каждого определяется своя чувствительность (ISI). Для сравнения результатов исследования протромбинового времени у больных, получающих пероральную антикоагулянтную терапию, необходимо рассчитать 1NR (International Normalized Ratio), или международное нормализованное отношение (МНО).
INR (МНО) = (протромбиновый коэффициент)151
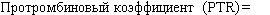 протромбиновое время больного (с) протромбиновое время контроля (с)'
протромбиновое время больного (с) протромбиновое время контроля (с)'
INR — это попытка математически скорректировать разницу, даваемую тромбопласти- нами с различной чувствительностью, т.е. привести результат к данным, полученным с референтным тромбопластином (табл. 5.8).
Таблица 5.8. Нормализация протромбинового времени при использовании 4 различных тромбопластинов по расчету INR
Лабораториям рекомендуется работать с тромбопластином, имеющим ISI меньше 1,5. Кроличьи тромбопластины имеют ISI = 2,0—3,0. В США все лаборатории перешли на плацентарный человеческий тромбопластин с ISI *= 1,0 [Mammen E.F., 1996].
Основная задача мониторинга приема пероральных антикоагулянтов — это предупреждение кровотечения. До последнего времени рекомендовали поддерживать протромбиновое время при лечении непрямыми антикоагулянтами в 2—2,5 раза длиннее нормы (кроличий тромбопластин). Однако это время оказалось слишком большим, что часто приводило к кровотечениям. В настоящее время имеется тенденция к переходу на более короткое время. ВОЗ разработаны рекомендации для контроля уровня антикоагулянтов, выраженные в INR (табл. 5.9).
Для удобства расчетов 1NR приводим шкалу, на которой представлена зависимость INR от IS] и PTR (табл, 5,10), На вертикальной шкале слева приведены величины PTR (отношение протромбинового времени пациента к протромбиновому времени контрольной плазмы), а на горизонтальной шкале вверху — значения ISI (для различных тромбопластинов). На пересечении линий этих двух параметров находится INR для данного пациента.
Фактор VII (проконвертин)
Активность фактора VII в плазме в норме — 65—135 %.
Фактор VII (проконвертин, или конвертин) относится к альфа-2-глобулинам и синтезируется в печени при участии витамина К. В основном участвует в образовании тканевой про- тромбиназы и превращении протромбина в тромбин. Период его полураспада составляет 4— 6 ч (самый короткий период полураспада у факторов свертывания).
Врожденный недостаток фактора VII обуславливает развитие геморрагического диатеза (болезнь Александера).
Приобретенные формы гипопроконвертинемии встречаются у младенцев в первые дни жизни, у больных с поражением печени, а также в результате действия непрямых антикоагулянтов. Отмечается снижение активности проконвертина в плазме крови у больных вирусным гепатитом, циррозом печени, при остром алкогольном гепатите, хроническом персисти- рующем гепатите. У больных с циррозом печени просматривается отчетливая связь между снижением уровня проконвертина и тяжестью процесса. Из-за короткого периода полураспада снижение активности проконвертина является лучшим маркером развития печеночной недостаточности.
Минимальный гемостатический уровень активности фактора VII в крови для выполнения операций составляет 10—20 %, при более низком содержании риск развития послеоперационных кровотечений чрезвычайно велик. Минимальный гемостатический уровень активности фактора VII в крови для остановки кровотечения — 5—10 %, при более низком содержании остановка кровотечения без введения больному фактора VII невозможна [Ogston
При ДВС-синдроме, начиная со II стадии, отчетливо снижается активность фактора VII вследствие коагулопатии потребления.
Фактор V (проакцелерин)
Активность фактора V в плазме в норме — 0,5—2,0 кЕД/л, или 60—150 %.
Фактор V (проакцелерин) — белок, полностью синтезируемый в печени. В отличие от других факторов протромбинового комплекса (II, VII и X) его активность не зависит от витамина К. Он необходим для образования внутренней (кровяной) протромбиназы, активируя фактор X для превращения протромбина в тромбин. В случаях дефицита фактора V в различной степени нарушаются внешний и внутренний пути образования протромбиназы. В коагу- лограмме это проявляется увеличением протромбинового времени; АЧТВ и тромбиновое время остаются в пределах нормы.
Непрямые антикоагулянты не оказывают заметного влияния на содержание фактора V в крови.
Активность проакцелерина определяют для выявления как врожденного, так и приобретенного дефицита фактора V.
Таблица 5.10. Шкала для определения INR

Наследственный дефицит фактора V проявляется парагемофилией (болезнь Оурена). Активность фактора V заметно снижается при тяжелых формах острого вирусного гепатита и при переходе острого гепатита в хронический. При циррозе печени наблюдается отчетливое снижение содержания в плазме крови проакцелерина. При неосложненной механической желтухе активность фактора V снижается, но незначительно; при вторичном вовлечении в процесс печени отмечается отчетливое снижение фактора V.
Минимальный гемостатический уровень активности фактора V в крови для выполнения операций составляет 25 %, при более низком содержании риск развития послеоперационных кровотечений чрезвычайно велик. Минимальный уровень активности фактора V в крови для остановки кровотечения — 5—15 %, при более низком содержании остановка кровотечения без введения больному фактора V невозможна [Ogston D., Bennett В., 1977}. При ДВС-синдроме, начиная со И стадии, отмечается отчетливое снижение фактора V за счет его потребления.
Фактор II (протромбин)
Активность фактора II в плазме в норме — 0,5—1,5 кЕД/л, или 60—150 %.
Фактор II относится к эуглобулинам, являясь гликопротеидом. Под действием факторов Ха и V, фосфолипидов и кальция протромбин расщепляется, образуя тромбин. Фактор II синтезируется в печени при участии витамина К.
Уровень содержания протромбина или его функциональная полноценность снижается при эндо- и экзогенной недостаточности витамина К, когда синтезируется неполноценный протромбин, что наблюдается при тяжелых поражениях печени и желудочно-кишечного тракта. Отмечаются и врожденные дефекты фактора II. Непрямые антикоагулянты снижают содержание фактора 11 в крови за счет угнетения его синтеза.
На основании содержания протромбина можно судить о функциональном состоянии печени. Снижение содержания протромбина при заболеваниях печени наблюдается значительно чаще, чем удлинение протромбинового времени.
Время свертывания крови нарушается лишь при концентрации протромбина ниже 40 %, Минимальный уровень активности протромбина в крови для выполнения операций — 20— 40 %, при более низком содержании риск развития послеоперационных кровотечений чрезвычайно велик.
Минимальный уровень активности протромбина в крови для остановки кровотечения — 10—15 %, при более низком содержании остановка кровотечения без введения больному протромбина невозможна [Ogston D., Bennett В., 1977]. При ДВС-синдроме, начиная со II стадии, отмечается отчетливое снижение протромбина за счет его потребления.
Повышенный уровень фактора II способствует развитию тромбозов.
Оценка третьей фазы плазменного гемостаза —
образования фибрина
Показатели, характеризующие третью фазу:
Фибриноген
Фибриноген (фактор I) — белок, синтезирующийся в основном в печени. В крови он находится в растворенном состоянии, но в результате ферментативного процесса под воздействием тромбина и фактора ХШа может превращаться в нерастворимый фибрин. Нормальные величины концентрации фибриногена в плазме приведены в табл. 5.11.
Таблица 5.11. Содержание фибриногена в плазме я норме
Повышение концентрации фибриногена или ее снижение отмечено при следующих состояниях и заболеваниях:
- Протромбиновое временя.
- Активность V фактора.
- Активность VII фактора.
- Активность II фактора.
Протромбиновое время
Протромбинове время для взрослых в норме 11—15 с, для новорожденных — 13—18 с.
Протромбиновое время (ПВ) характеризует первую {протромбинообразование) и вторую (тромбинообразование) фазы плазменного гемостаза и отражает активность протромбиново- го комплекса (факторов VII, V, X и собственно протромбина — фактора II).
Увеличение протромбинового времени говорит о наклонности к гипокоагуляции и может зависеть от различных причин:
- недостаточность одного или нескольких факторов протромбинового комплекса при таких редких наследственных коагулопатиях, как гипопроконвертинемия (дефицит фактора VII) и гипопротромбинемия (дефицит фактора II);
- отмечаемое иногда при амилоидозе увеличение протромбинового времени, связанное с дефицитом фактора X, который поглощается амилоидом, а при нефротическом синдроме — с дефицитом факторов VII и V, которые выделяются с мочой;
- синтез факторов протромбинового комплекса в клетках печени, при заболеваниях которой количество их снижается, и протромбиновое время в определенной степени может служить показателем функционального состояния печени. Увеличение протромбинового времени отмечается при острых гепатитах, хронических гепатитах, циррозах печени, при подострой дистрофии печени и других поражениях паренхимы печени и является плохим прогностическим признаком. При этом причиной увеличения протромбинового времени может стать и развивающееся в результате уменьшения поступления желчи в кишечник нарушение всасывания витамина К, который необходим для синтеза факторов протромбинового комплекса. Такова же причина увеличения протромбинового времени и при механической желтухе;
- энтеропатия и кишечные дисбактериозы, ведущие к недостаточности витамина К, также могут сопровождаться увеличением протромбинового времени;
- при лечении антагонистами витамина К — антикоагулянтами непрямого действия — нарушается конечный этап синтеза факторов протромбинового комплекса, и протромбиновое время удлиняется. Терапия непрямыми антикоагулянтами считается адекватной, если протромбиновое время увеличивается примерно в 2 раза;
- потребление факторов протромбинового комплекса при остром ДВС-синдроме ведет к довольно раннему увеличению протромбинового времени (в 2 раза и более);
- при хроническом панкреатите, раке поджелудочной железы и желчного пузыря увеличение протромбинового времени может быть результатом поражения печени и(или) развития ДВС-синдрома;
- афибриногенемия, гипофибриногенемия (снижение содержания в крови фибриногена до 1 г/л и ниже), а также избыточное содержание гепарина в крови ведут к увеличению протромбинового времени;
- удлинение протромби нового времени выявляется при острых и хронических лейкозах вследствие развития ДВС-синдрома;
- повышение уровня антитромбина или антитромбопластина в крови также ведет к удлинению протромбинового времени;
- целая группа лекарственных препаратов способна удлинять протромбиновое время: ацетогексамид, анаболические стероиды, антибиотики, ацетилсалициловая кислота (в больших дозах), слабительные средства, метотрексат, никотиновая кислота, хинидин, хинин, тиазидные диуретики, толбутамид.
Укорочение протромбинового времени говорит о наклонности к гиперкоагуляции и может быть отмечено в начальных стадиях тромбоза глубоких вен нижних конечностей, при полицитемии, в последние месяцы беременности. Укорочение протромбинового времени вызывают следующие лекарственные препараты: ацетилсалициловая кислота (в небольших дозах), меркаптопурин, пероральные контрацептивы.
Определению протромбинового времени отводится ведущая роль в контроле за пероральной антикоагулянтной терапией. Однако при таком контроле протромбиновое время зависит от чувствительности используемого для этих целей тромбопластина. Поэтому сравнение результатов исследований с использованием различных тромбопластинов является важной задачей практической медицины. Разные тромбопластины различают по ISI (International Sensitivity Index — Международный индекс чувствительности), который прилагается к описанию каждого набора. В 1983 г. ВОЗ совместно с Международным обществом тромбоза и гемостаза приняли тромбопластин из мозга человека за референтный и установили, что ISI этого тромбопластина равен 1,0 (Международный референтный препарат Всемирной организации здравоохранения). Все другие коммерческие тромбопластины калибруются по нему, и для каждого определяется своя чувствительность (ISI). Для сравнения результатов исследования протромбинового времени у больных, получающих пероральную антикоагулянтную терапию, необходимо рассчитать 1NR (International Normalized Ratio), или международное нормализованное отношение (МНО).
INR (МНО) = (протромбиновый коэффициент)151
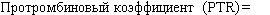 протромбиновое время больного (с) протромбиновое время контроля (с)'
протромбиновое время больного (с) протромбиновое время контроля (с)'
INR — это попытка математически скорректировать разницу, даваемую тромбопласти- нами с различной чувствительностью, т.е. привести результат к данным, полученным с референтным тромбопластином (табл. 5.8).
Таблица 5.8. Нормализация протромбинового времени при использовании 4 различных тромбопластинов по расчету INR
|
Тромбогшасти н ISI |
Протромбиновое время, с |
Рассчитанные величины |
||
|
пациент |
контроль |
PTR |
INR |
|
|
1,2 |
24 |
11 |
2,2 |
2,6 |
|
3,2 |
16 |
12 |
1,3 |
2,6 |
|
2,0 |
21 |
13 |
1,6 |
2,6 |
|
1,0 \ 1 |
38 |
14,5 |
2,6 |
2,6 |
Лабораториям рекомендуется работать с тромбопластином, имеющим ISI меньше 1,5. Кроличьи тромбопластины имеют ISI = 2,0—3,0. В США все лаборатории перешли на плацентарный человеческий тромбопластин с ISI *= 1,0 [Mammen E.F., 1996].
Основная задача мониторинга приема пероральных антикоагулянтов — это предупреждение кровотечения. До последнего времени рекомендовали поддерживать протромбиновое время при лечении непрямыми антикоагулянтами в 2—2,5 раза длиннее нормы (кроличий тромбопластин). Однако это время оказалось слишком большим, что часто приводило к кровотечениям. В настоящее время имеется тенденция к переходу на более короткое время. ВОЗ разработаны рекомендации для контроля уровня антикоагулянтов, выраженные в INR (табл. 5.9).
|
Клиническое состояние |
Рекомендуемое INR |
|
Профилактика тромбоза глубоких вен |
2,0-3,0 |
|
Лечение тромбоза глубоких вен и легочной тромбоэмболии |
2,0-3,0 |
|
Возвратный тромбоз глубоких вен, легочной тромбоэмболии |
2,0-3,0 |
|
Протезы клапанов из собственной ткани |
2,0-3,0 |
|
Механические протезы клапанов |
2,5-3,5 |
Для удобства расчетов 1NR приводим шкалу, на которой представлена зависимость INR от IS] и PTR (табл, 5,10), На вертикальной шкале слева приведены величины PTR (отношение протромбинового времени пациента к протромбиновому времени контрольной плазмы), а на горизонтальной шкале вверху — значения ISI (для различных тромбопластинов). На пересечении линий этих двух параметров находится INR для данного пациента.
Фактор VII (проконвертин)
Активность фактора VII в плазме в норме — 65—135 %.
Фактор VII (проконвертин, или конвертин) относится к альфа-2-глобулинам и синтезируется в печени при участии витамина К. В основном участвует в образовании тканевой про- тромбиназы и превращении протромбина в тромбин. Период его полураспада составляет 4— 6 ч (самый короткий период полураспада у факторов свертывания).
Врожденный недостаток фактора VII обуславливает развитие геморрагического диатеза (болезнь Александера).
Приобретенные формы гипопроконвертинемии встречаются у младенцев в первые дни жизни, у больных с поражением печени, а также в результате действия непрямых антикоагулянтов. Отмечается снижение активности проконвертина в плазме крови у больных вирусным гепатитом, циррозом печени, при остром алкогольном гепатите, хроническом персисти- рующем гепатите. У больных с циррозом печени просматривается отчетливая связь между снижением уровня проконвертина и тяжестью процесса. Из-за короткого периода полураспада снижение активности проконвертина является лучшим маркером развития печеночной недостаточности.
Минимальный гемостатический уровень активности фактора VII в крови для выполнения операций составляет 10—20 %, при более низком содержании риск развития послеоперационных кровотечений чрезвычайно велик. Минимальный гемостатический уровень активности фактора VII в крови для остановки кровотечения — 5—10 %, при более низком содержании остановка кровотечения без введения больному фактора VII невозможна [Ogston
- , Bennett В., 1977].
При ДВС-синдроме, начиная со II стадии, отчетливо снижается активность фактора VII вследствие коагулопатии потребления.
Фактор V (проакцелерин)
Активность фактора V в плазме в норме — 0,5—2,0 кЕД/л, или 60—150 %.
Фактор V (проакцелерин) — белок, полностью синтезируемый в печени. В отличие от других факторов протромбинового комплекса (II, VII и X) его активность не зависит от витамина К. Он необходим для образования внутренней (кровяной) протромбиназы, активируя фактор X для превращения протромбина в тромбин. В случаях дефицита фактора V в различной степени нарушаются внешний и внутренний пути образования протромбиназы. В коагу- лограмме это проявляется увеличением протромбинового времени; АЧТВ и тромбиновое время остаются в пределах нормы.
Непрямые антикоагулянты не оказывают заметного влияния на содержание фактора V в крови.
Активность проакцелерина определяют для выявления как врожденного, так и приобретенного дефицита фактора V.
Таблица 5.10. Шкала для определения INR

Наследственный дефицит фактора V проявляется парагемофилией (болезнь Оурена). Активность фактора V заметно снижается при тяжелых формах острого вирусного гепатита и при переходе острого гепатита в хронический. При циррозе печени наблюдается отчетливое снижение содержания в плазме крови проакцелерина. При неосложненной механической желтухе активность фактора V снижается, но незначительно; при вторичном вовлечении в процесс печени отмечается отчетливое снижение фактора V.
Минимальный гемостатический уровень активности фактора V в крови для выполнения операций составляет 25 %, при более низком содержании риск развития послеоперационных кровотечений чрезвычайно велик. Минимальный уровень активности фактора V в крови для остановки кровотечения — 5—15 %, при более низком содержании остановка кровотечения без введения больному фактора V невозможна [Ogston D., Bennett В., 1977}. При ДВС-синдроме, начиная со И стадии, отмечается отчетливое снижение фактора V за счет его потребления.
Фактор II (протромбин)
Активность фактора II в плазме в норме — 0,5—1,5 кЕД/л, или 60—150 %.
Фактор II относится к эуглобулинам, являясь гликопротеидом. Под действием факторов Ха и V, фосфолипидов и кальция протромбин расщепляется, образуя тромбин. Фактор II синтезируется в печени при участии витамина К.
Уровень содержания протромбина или его функциональная полноценность снижается при эндо- и экзогенной недостаточности витамина К, когда синтезируется неполноценный протромбин, что наблюдается при тяжелых поражениях печени и желудочно-кишечного тракта. Отмечаются и врожденные дефекты фактора II. Непрямые антикоагулянты снижают содержание фактора 11 в крови за счет угнетения его синтеза.
На основании содержания протромбина можно судить о функциональном состоянии печени. Снижение содержания протромбина при заболеваниях печени наблюдается значительно чаще, чем удлинение протромбинового времени.
Время свертывания крови нарушается лишь при концентрации протромбина ниже 40 %, Минимальный уровень активности протромбина в крови для выполнения операций — 20— 40 %, при более низком содержании риск развития послеоперационных кровотечений чрезвычайно велик.
Минимальный уровень активности протромбина в крови для остановки кровотечения — 10—15 %, при более низком содержании остановка кровотечения без введения больному протромбина невозможна [Ogston D., Bennett В., 1977]. При ДВС-синдроме, начиная со II стадии, отмечается отчетливое снижение протромбина за счет его потребления.
Повышенный уровень фактора II способствует развитию тромбозов.
Оценка третьей фазы плазменного гемостаза —
образования фибрина
Показатели, характеризующие третью фазу:
- Концентрация фибриногена в плазме.
- Активность XIII фактора в плазме.
- Тромбиновое время.
Фибриноген
Фибриноген (фактор I) — белок, синтезирующийся в основном в печени. В крови он находится в растворенном состоянии, но в результате ферментативного процесса под воздействием тромбина и фактора ХШа может превращаться в нерастворимый фибрин. Нормальные величины концентрации фибриногена в плазме приведены в табл. 5.11.
Таблица 5.11. Содержание фибриногена в плазме я норме
|
Возраст |
Концентрация фибриногена |
|
|
мг/дл |
г/л |
|
|
Новорожденные Взрослые |
125-300 200-400 |
1,25-3,00 2,00-4,00 |
Повышение концентрации фибриногена или ее снижение отмечено при следующих состояниях и заболеваниях:
- гиперкоагулемия при различных стадиях тромбоза, инфаркте миокарда, а также в последние месяцы беременности, после родов, после хирургических операций;
- воспалительные процессы, в частности при пневмониях. В связи с этим используют определение концентрации фибриногена в плазме параллельно с определением СОЭ для контроля за течением воспалительного процесса;
- неопластические процессы, особенно при раке легкого;
- легкие формы гепатита (концентрация фибриногена может быть повышена). Тяжелые поражения печени (острый гепатит, цирроз) сопровождаются снижением концентрации фибриногена;
- наследственные афибриногенемии и гипофибриногенемии, первичный фибринолиз (концентрация фибриногена снижена);
- ДВС-синдром, при котором изменения концентрации фибриногена зависят от формы и стадии процесса. В случаях хронической формы ДВС-синдрома, а также в I стадии острого ДВС-синдрома концентрация фибриногена повышена. Выявляющееся позднее снижение концентрации фибриногена говорит о переходе процесса в следующие (II и III) стадии и объясняется повышенным его потреблением. Во II стадии ДВС-синдрома концентрация фибриногена снижается до 0,9—1,1 г/л, а в III становится менее 0,5 г/л или он не определяется. Оценивая результаты исследований, необходимо принимать во внимание не только абсолютное, но и относительное снижение концентрации фибриногена по сравнению с первоначальными, повышенными цифрами. Выраженное прогрессивное снижение концентрации фибриногена во II— Ш стадиях острого ДВС-синдрома расценивается как неблагоприятный признак, улучшение же состояния сопровождается ее повышением.
