Ферментная система, обеспечивающая растворение фибрина в кровяном русле, получила название фибринолитической, или плазминовой, системы. Это растворение осуществляется основным компонентом указанной системы — фибринолизином (или плазмином), который в плазме содержится в виде профермента (плазминогена) в концентрации около 20,6 + 3,6 мг%. Как в плазме, так и в тканях плазминоген содержится в виде двух или более молекулярных форм, отличающихся друг от друга способами выделения, особенностями активации и инактивации. Каждая из двух основных форм состоит из нескольких молекулярных подформ:
После активации плазминоген быстро исчезает из кровотока — блокируется антиплазминами и удаляется. Вслед за введением больших доз стрептокиназы или урокиназы уровень плазминогена в крови снижается до нуля, но затем в течение 12—28 ч восстанавливается, если прекращена его дальнейшая активация.
Эта способность активаторов фибринолиза быстро истощать запасы плазминогена в крови и на время оставлять больного без ферментативного фибринолиза важна для клиники и должна учитываться при лечении тромбозов и синдрома диссеминированного внутрисосудистого свертывания крови.
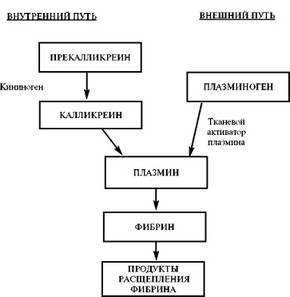
Существующие в организме механизмы активации плазминогена весьма разнообразны, но, подобно механизмам свертывания крови, они также могут быть подразделены на две основные группы — с внутренней и внешней активацией.
Ведущий внутренний механизм запускается теми же факторами, какие инициируют свертывание крови, а именно фактором ХПа, который, взаимодействуя с прекалликреином и высокомолекулярным кининогеном плазмы (ВМК), активирует плазминоген. Такой путь фибринолиза — базисный, обеспечивающий активацию плазминовой системы не вслед за свертыванием крови, а одновременно с ним. Он функционирует по «замкнутому циклу», поскольку образующиеся первые порции калликреина и плазмина вызывают протеолиз фактора XII, отцепляя фрагменты, под действием которых нарастает изменение прекалликреина в калликреин. Такая интенсивная самоактивация приводит к тому, что ХПа-калликреин-зависимый фибринолиз при интенсивном внутрисосудистом свертывании крови истощается быстро, раньше других механизмов фибринолиза.
Лимитирующими факторами являются в первую очередь ВМК и прекалликреин. Их плазменный резерв быстро истощается, тогда как уровень плазминогена остается в крови еще достаточно высоким. В таких условиях ХПа-зависимый фибринолиз уже не функционирует, но поддается другим (не кал- ликреиновым) способам активации — стрептокиназой и урокиназой. Лишь вслед за этим возможно истощение запасов плазминогена, что делает неэффективным любые способы активации плазминовой системы. Определенное участие в активации внутреннего механизма фибринолиза принимает, по- видимому, и фактор Виллебранда. В частности, на образцах плазмы с дефицитом ВМК показано, что фактор Виллебранда в 2—3 раза усиливает превращение прекалликреина в каллик- реин под влиянием фрагментов фактора XII. В присутствии ВМК, обладающего значительно более мощным влиянием на активацию прекалликреина, это действие фактора Виллебран- да становится малоощутимым.
Заслуживает внимания то обстоятельство, что если в свертывании крови компонентам калликреин-кининовой системы отводится в определенной мере вспомогательная функция, то в гуморальном механизме фибринолиза это один из ведущих механизмов. Возможно, именно поэтому при генетически обусловленном дефиците плазменного прекалликреина (дефект Флетчера) или ВМК (дефект Фитцжеральда—Вильсона) у больных нет кровоточивости и вместе с тем прослеживается наклонность к тромбозам.
Важнейшими стимуляторами внешнего механизма фибринолиза являются белковые активаторы плазминогена, синтезируемые в сосудистой стенке. Эти активаторы подразделяются на высокомолекулярные и низкомолекулярные фракции, обнаруживают высокое сродство к фибрину. Физиологическая регуляция синтеза и выделения в кровь сосудистых активаторов изучена недостаточно. Тем не менее известно, что их интенсивный выброс происходит при нарушении проходимости сосудов, в том числе и при пережатии сосуда манжетой, а также при физических нагрузках, под влиянием вазоактивных веществ. Определение эуглобулинового лизиса до и после пережатия сосуда (манжеточная проба) используется для оценки резерва сосудистых активаторов плазминогена и функциональной полноценности механизмов их либерации. Депрессия данных механизмов характерна для ряда тромбофилических состояний. Стероидные гормоны анаболического действия повышают синтез в эндотелии активаторов фибринолиза, с чем отчасти связывается их благоприятное влияние на течение флеботромботической болезни.
Мощные активаторы плазминогена содержатся также в клетках крови — эритроцитах, тромбоцитах и особенно лейкоцитах. При внутрисосудистом свертывании крови, тромбообразовании, воздействии эндотоксином, активации системы комплемента, гемолизе эти активаторы освобождаются из клеток в «плазматическую атмосферу» и активируют плазминоген.
Более того, установлено, что гранулоциты секретируют не только активатор плазминогена, но и внутриклеточные протеазы (цитокиназы), которые самостоятельно, без участия плазми- на, переваривают фибрин. При этом образуются иные продукты расщепления фибрина, чем при его плазминовом расщеплении.
Следовательно, лейкоциты обеспечивают функционирование самостоятельного (неплазминового) механизма растворения фибрина. Этот альтернативный механизм играет важную роль в ограничении размеров тромбов и в деблокировании микроциркуляторного русла при диссеминированном внутрисосудистом свертывании крови.
Разнообразные активаторы плазминогена (цитокиназы) содержатся и в других тканях и клетках, особенно в эпителиальной, мышечной и мезенхимальной, а также в секретах и экскретах — моче, молоке, желчи, слюне. Некоторые из них поступают в определенных количествах в кровь, участвуя в активации плазминогена. В частности, таким свойством обладает урокиназа — активатор фибринолиза, синтезируемый в почечном эпителии и выделяющийся с мочой. В кровь поступает небольшое количество урокиназы, ответственное приблизительно за 10—15% общей плазминоген-активаторной функции. В настоящее время установлено, что большинство тканевых активаторов плазминоген идентично сосудистому, эндотелиальному.
Фибринолиз ингибируется рядом антиактиваторов и анти- плазминов, из которых наиболее важен недавно открытый быстродействующий антиплазмин, относящийся к а2-глобулинам (молекулярная масса 65 000—70 000) и содержащийся в плазме в количестве 70 мг/л. Этого количества достаточно, чтобы нейтрализовать более 2/3 всего плазмина, образующегося при максимальной активации плазминогена. Однако плазмин, связанный с фибрином, хуже комплексируется с антиплазмином, чем при циркуляции в свободном состоянии. Антиплазмин ослабляет процесс связывания плазминогена с фибрином. Присутствие в плазме циркулирующих комплексов плазмин — антиплазмин, как и комплексов тромбин-ATIII, служит признаком интенсивного внутрисосудистого свертывания крови и активации фибринолиза. Выявление этих комплексов облегчается тем, что в них появляются новые антигенные свойства (так называемые неоантигены).
Быстродействующий а2-антиплазмин обладает также ан- тиактиваторным действием, но он не идентичен другому антиактиватору, описанному Hedner (1973, 1977 гг.).
Из других ингибиторов фибринолиза, обладающих значительно более слабым действием, заслуживают упоминания а2-макроглобулин и ингибитор С1-эстеразы. Последний ингибирует фактор ХПа, калликреин и отчасти плазмин, специфически блокирует внутренний (ХПа-зависимый) фибринолиз. Вместе с тем имеются данные о том, что а2-макроглобулин не столько препятствует фибринолизу, сколько защищает плазмин от других, более мощных, ингибиторов. В частности, комплекс макро- глобулин-плазмин защищен от быстродействующего а2-анти- плазмина, благодаря чему при активации плазминовой системы идет лизис не только фибрина и РФМК, но в небольшой степени и фибриногена, хотя в плазме имеется избыток а2-антиплаз- мина.
Плазминовая система специфически адаптирована к лизису фибрина и растворимых фибрин-мономерных комплексов (РФМК), хотя при ее значительной активации расщеплению
подвергаются и другие белки (в том числе факторы свертывания V и VIII).
Механизм преимущественной активации фибринолиза в тромбах и сгустках, резко выраженного преобладания фибринолиза над фибриногенолизом пока не может считаться окончательно выясненным. Твердо доказана лишь способность частично активированного плазминогена (лиз-плазминогена) связываться с фибрином. Установлено также, что растворение идет тем быстрее, чем выше локальная концентрация в сгустках плазминогена. Особенно важно, что сосудистый активатор плазминогена также концентрируется на фибрине. Наконец, установлено, что а2-антиплазмин намного слабее инактивирует связанный с фибрином плазмин, тогда как циркулирующий «свободный» плазмин образует с этим мощным ингибитором плохо диссоциирующие комплексы.
Схема 3
Фибринолитическая система
- нативный плазминоген с NH2-терминальной глютаминовой кислотой — «глю-плазминоген»;
- подвергшийся ограниченному протеолизу плазминоген с NH2-терминальным лизином, валином или метионином — «лиз-плазминоген». Лиз-плазминоген в 10—20 раз быстрее трансформируется активаторами в плазмин, имеет значительно более выраженное, чем глю-плазминоген, сродство к фибрину и значительно быстрее последнего метаболизи- руется — его Т^2 в циркуляции около 0,8 суток, а глю-плаз- миногена — 1,24 ± 0,29 суток. По механизму протеолитического действия плазмин наиболее близок к трипсину.
После активации плазминоген быстро исчезает из кровотока — блокируется антиплазминами и удаляется. Вслед за введением больших доз стрептокиназы или урокиназы уровень плазминогена в крови снижается до нуля, но затем в течение 12—28 ч восстанавливается, если прекращена его дальнейшая активация.
Эта способность активаторов фибринолиза быстро истощать запасы плазминогена в крови и на время оставлять больного без ферментативного фибринолиза важна для клиники и должна учитываться при лечении тромбозов и синдрома диссеминированного внутрисосудистого свертывания крови.
Существующие в организме механизмы активации плазминогена весьма разнообразны, но, подобно механизмам свертывания крови, они также могут быть подразделены на две основные группы — с внутренней и внешней активацией.
Ведущий внутренний механизм запускается теми же факторами, какие инициируют свертывание крови, а именно фактором ХПа, который, взаимодействуя с прекалликреином и высокомолекулярным кининогеном плазмы (ВМК), активирует плазминоген. Такой путь фибринолиза — базисный, обеспечивающий активацию плазминовой системы не вслед за свертыванием крови, а одновременно с ним. Он функционирует по «замкнутому циклу», поскольку образующиеся первые порции калликреина и плазмина вызывают протеолиз фактора XII, отцепляя фрагменты, под действием которых нарастает изменение прекалликреина в калликреин. Такая интенсивная самоактивация приводит к тому, что ХПа-калликреин-зависимый фибринолиз при интенсивном внутрисосудистом свертывании крови истощается быстро, раньше других механизмов фибринолиза.
Лимитирующими факторами являются в первую очередь ВМК и прекалликреин. Их плазменный резерв быстро истощается, тогда как уровень плазминогена остается в крови еще достаточно высоким. В таких условиях ХПа-зависимый фибринолиз уже не функционирует, но поддается другим (не кал- ликреиновым) способам активации — стрептокиназой и урокиназой. Лишь вслед за этим возможно истощение запасов плазминогена, что делает неэффективным любые способы активации плазминовой системы. Определенное участие в активации внутреннего механизма фибринолиза принимает, по- видимому, и фактор Виллебранда. В частности, на образцах плазмы с дефицитом ВМК показано, что фактор Виллебранда в 2—3 раза усиливает превращение прекалликреина в каллик- реин под влиянием фрагментов фактора XII. В присутствии ВМК, обладающего значительно более мощным влиянием на активацию прекалликреина, это действие фактора Виллебран- да становится малоощутимым.
Заслуживает внимания то обстоятельство, что если в свертывании крови компонентам калликреин-кининовой системы отводится в определенной мере вспомогательная функция, то в гуморальном механизме фибринолиза это один из ведущих механизмов. Возможно, именно поэтому при генетически обусловленном дефиците плазменного прекалликреина (дефект Флетчера) или ВМК (дефект Фитцжеральда—Вильсона) у больных нет кровоточивости и вместе с тем прослеживается наклонность к тромбозам.
Важнейшими стимуляторами внешнего механизма фибринолиза являются белковые активаторы плазминогена, синтезируемые в сосудистой стенке. Эти активаторы подразделяются на высокомолекулярные и низкомолекулярные фракции, обнаруживают высокое сродство к фибрину. Физиологическая регуляция синтеза и выделения в кровь сосудистых активаторов изучена недостаточно. Тем не менее известно, что их интенсивный выброс происходит при нарушении проходимости сосудов, в том числе и при пережатии сосуда манжетой, а также при физических нагрузках, под влиянием вазоактивных веществ. Определение эуглобулинового лизиса до и после пережатия сосуда (манжеточная проба) используется для оценки резерва сосудистых активаторов плазминогена и функциональной полноценности механизмов их либерации. Депрессия данных механизмов характерна для ряда тромбофилических состояний. Стероидные гормоны анаболического действия повышают синтез в эндотелии активаторов фибринолиза, с чем отчасти связывается их благоприятное влияние на течение флеботромботической болезни.
Мощные активаторы плазминогена содержатся также в клетках крови — эритроцитах, тромбоцитах и особенно лейкоцитах. При внутрисосудистом свертывании крови, тромбообразовании, воздействии эндотоксином, активации системы комплемента, гемолизе эти активаторы освобождаются из клеток в «плазматическую атмосферу» и активируют плазминоген.
Более того, установлено, что гранулоциты секретируют не только активатор плазминогена, но и внутриклеточные протеазы (цитокиназы), которые самостоятельно, без участия плазми- на, переваривают фибрин. При этом образуются иные продукты расщепления фибрина, чем при его плазминовом расщеплении.
Следовательно, лейкоциты обеспечивают функционирование самостоятельного (неплазминового) механизма растворения фибрина. Этот альтернативный механизм играет важную роль в ограничении размеров тромбов и в деблокировании микроциркуляторного русла при диссеминированном внутрисосудистом свертывании крови.
Разнообразные активаторы плазминогена (цитокиназы) содержатся и в других тканях и клетках, особенно в эпителиальной, мышечной и мезенхимальной, а также в секретах и экскретах — моче, молоке, желчи, слюне. Некоторые из них поступают в определенных количествах в кровь, участвуя в активации плазминогена. В частности, таким свойством обладает урокиназа — активатор фибринолиза, синтезируемый в почечном эпителии и выделяющийся с мочой. В кровь поступает небольшое количество урокиназы, ответственное приблизительно за 10—15% общей плазминоген-активаторной функции. В настоящее время установлено, что большинство тканевых активаторов плазминоген идентично сосудистому, эндотелиальному.
Фибринолиз ингибируется рядом антиактиваторов и анти- плазминов, из которых наиболее важен недавно открытый быстродействующий антиплазмин, относящийся к а2-глобулинам (молекулярная масса 65 000—70 000) и содержащийся в плазме в количестве 70 мг/л. Этого количества достаточно, чтобы нейтрализовать более 2/3 всего плазмина, образующегося при максимальной активации плазминогена. Однако плазмин, связанный с фибрином, хуже комплексируется с антиплазмином, чем при циркуляции в свободном состоянии. Антиплазмин ослабляет процесс связывания плазминогена с фибрином. Присутствие в плазме циркулирующих комплексов плазмин — антиплазмин, как и комплексов тромбин-ATIII, служит признаком интенсивного внутрисосудистого свертывания крови и активации фибринолиза. Выявление этих комплексов облегчается тем, что в них появляются новые антигенные свойства (так называемые неоантигены).
Быстродействующий а2-антиплазмин обладает также ан- тиактиваторным действием, но он не идентичен другому антиактиватору, описанному Hedner (1973, 1977 гг.).
Из других ингибиторов фибринолиза, обладающих значительно более слабым действием, заслуживают упоминания а2-макроглобулин и ингибитор С1-эстеразы. Последний ингибирует фактор ХПа, калликреин и отчасти плазмин, специфически блокирует внутренний (ХПа-зависимый) фибринолиз. Вместе с тем имеются данные о том, что а2-макроглобулин не столько препятствует фибринолизу, сколько защищает плазмин от других, более мощных, ингибиторов. В частности, комплекс макро- глобулин-плазмин защищен от быстродействующего а2-анти- плазмина, благодаря чему при активации плазминовой системы идет лизис не только фибрина и РФМК, но в небольшой степени и фибриногена, хотя в плазме имеется избыток а2-антиплаз- мина.
Плазминовая система специфически адаптирована к лизису фибрина и растворимых фибрин-мономерных комплексов (РФМК), хотя при ее значительной активации расщеплению
подвергаются и другие белки (в том числе факторы свертывания V и VIII).
Механизм преимущественной активации фибринолиза в тромбах и сгустках, резко выраженного преобладания фибринолиза над фибриногенолизом пока не может считаться окончательно выясненным. Твердо доказана лишь способность частично активированного плазминогена (лиз-плазминогена) связываться с фибрином. Установлено также, что растворение идет тем быстрее, чем выше локальная концентрация в сгустках плазминогена. Особенно важно, что сосудистый активатор плазминогена также концентрируется на фибрине. Наконец, установлено, что а2-антиплазмин намного слабее инактивирует связанный с фибрином плазмин, тогда как циркулирующий «свободный» плазмин образует с этим мощным ингибитором плохо диссоциирующие комплексы.
Схема 3
Фибринолитическая система

