Лабораторные методы обследования
Постановка диагноза имеет несколько этапов. Во время опроса больного у врача складывается определенное представление о характере заболевания. При осмотре врач конкретизирует свои предположения. Роль вспомогательных методов обследования — подтвердить или опровергнуть имеющиеся предположения врача о диагнозе больного. Однако, иногда для постановки диагноза их бывает недостаточно. В таких случаях врач прибегает к вспомогательным лабораторно-инструментальным методам исследования, которые нередко могут приобретать решающее значение в постановке окончательного диагноза.
В зависимости от характера поражения СОПР и нарушений общего статуса больного применяют общеклинические (клинический анализ крови и мочи) и специальные (морфологические, микробиологические, гистоцитохимические, иммунологические, серологические, функциональные и др.) методы обследования.
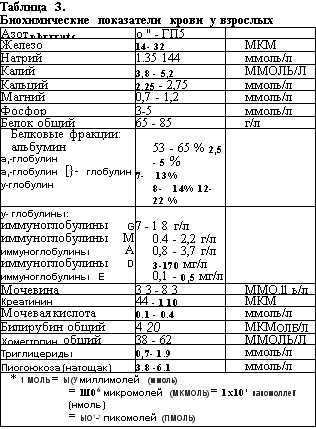
Общий клинический анализ крови является важным вспомогательным методом обследования и проводиться каждому больному с патологией СОПР (табл. 2).
Абсолютно необходимо делать исследование крови больным при наличии в полости рта язвенно-некротических поражений, при проявлениях геморрагического синдрома, а также при подозрении на заболевания крови. Анализ крови позволяет уточнить характер заболевания СОПР и выявить его возможную взаимосвязь с патологией органов кроветворения. Кроме того, гемограмма служит неспецифическим тестом аллергизации организма, а также одним из показателей неспецифической реактивности организма. Так, при некоторых заболеваниях воспалительного характера с острым течением количество лейкоцитов выше нормы; увеличивается процент нейтрофил ьных лейкоцитов, лимфоцитов, значительно уменьшается количество моноцитов и эозинофилов; ускорена СОЭ.
При некоторых хронических заболеваниях, интоксикациях гемограмма может мало изменяться или же наоборот, отражать значительное уменьшение количества эритроцитов, снижение содержания гемоглобина, сдвиг лейкоцитарной формулы влево, увеличение СОЭ.
Heci 1ецифическими тестами аллергизации
являются эозинофилия, тромбопения, лейкопения, лимфоцитоз. Значительное уменьшение количества эритроцитов, изменение их формы, снижение содержания гемоглобина в них - типичные признаки анемии.
Так называемый патологический лейкоцитоз как защитная реакция имеет место при воспалительных процессах СОПР, при язвеннонекротических поражениях, проявлениях аллергии, интоксикациях идр.
Лейкопения может встречаться и у здоровых людей (кратковременно после перегревания, тяжелой физической работы), однако прежде всего ее следует расценивать как признак серьезных нарушений в организме.
Лимфоциты играют значительную роль в выработке иммунитета. Они фиксируют токсины и участвуют в образовании антител. Лимфоциты могут превращаться в так называемые плазматические клетки, которые вырабатывают у-глобулин. Изменения лимфоцитов в ту или иную сторону позволяют врачу правильно оценить не только развитие заболевания, но и тактику его лечения.
Эозинофилия развивается при повышении уровня гистамина в крови и имеет место при аллергизации организма, при иммунных и
 аутоиммунных заболеваниях, при глистной инвазии, гисцноцитозе X и др.
аутоиммунных заболеваниях, при глистной инвазии, гисцноцитозе X и др.
Тромбоциты играют важную роль в остановке кровотечения. При разрушении их в результате повышенной чувствительности к некоторым лекарственным препаратам, при отравлениях химическими соединениями ив ряде других случаев может развиваться тромбоцитопения. Вместе с тем, возможна и физиологическая тромбопнтопения (во время сна, в период менструации). Определение состояния тромбоцитов при некоторых заболеваниях имеет решающее значение в постановке диагноза, особенно в случае геморрагических синдромов.
Биохимический анализ крови проводят с целью определен ия концентрации протеинов и составления протеинограммы, установления концентрации электролитов в сыворотке крови, содержания витаминов и др.
Белки крови. Концентрация протеинов в плазме крови имеет важное диагностическое значение, указывая на тяжесть заболевания. Так, если в норме количество белка в сыворотке крови человека составляет 65 — 85 г/л, то, например, при пузырчатке оно снижаетсяДО 49 и даже до 36 г/л.
Протеинограмма позволяет оценить состояние реактивности организма и сделать прогностические выводы. Протеинограмму периферической крови получают с помощью электрофореза в геле или на бумаге.
Повышенный уровень (3 - и у -глобулинов является неспецифическим тестом диагностики аллергических состояний.
При обострении воспалительного процесса в СОПР количество, с^-, о^-н у-глобулинов возрастает, а процент альбуминов значительно снижается. При хронических воспалительных заболеваниях количество глобулинов повышается за счет фракций а, - и у-глобулинов; фракции а2 и р изменяются мало.
В клинике иногда требуется определить содержание фибриногена. При воспалительных заболеваниях количество фибриногена в плазме крови увеличивается и может достигнуть 58 мг/ 100 мл плазмы (против 29 мг/ЮО мл у здоровых).
При заболеваниях, которые развиваются в результате нарушения витаминного баланса, используют методы определения содержания витаминов в крови больного с целью окончательного решени я вопроса о характере гиповитаминоза, а также для кон
троля эффективности витаминотерапии. В норме в крови витамин С содержится в количестве 0,9—1 мг%, витамин А — 60—70 мг%; витамин Е —0,6—0,9мг%; витамин К —0,5 МГ%. Для выявления насыщенности организма витами ном С применяют пробу Ротгера и языковую пробу.
При постановке пробы Роттера 0,1 мл 0,0025 N свежего раствора краски Тильманса вводят внутрикожно на внутренней стороне предплечья. Время обесцвечивания раствора при нормальной насыщенности организма витамином С — не более 10 мин Методика языковой пробы довольно проста. На высушенную поверхность спинки языка инъекционной иглой диаметром 0,2 мм со шприца наносят 1 каплю индикатора - 0,06 % раствор натриевой соли 2,6-дихлорфенолиндофенола (краска Тильманса), который восстанавливается аскорбиновой кислотой при комнатной температуре, обесцвечивая при этом индикатор. Время обесцвечивания раствора - более 16—20 с — свидетельствует о дефиците аскорбиновой кислоты.
Определение электролитов кр о в и . У здоровых людей концентрация натрия в сыворотке крови составляет 140 ммоль/ л, хлоридов — 120 ммоль/л, кальция 2,25-2,75
ммоль/л, калия 3,8-5,2 ммоль/л. Степень изменения концентрации электролитов нередко коррелирует с тяжестью заболевания. Особое диагностическое и прогностическое значение эти показатели имеют при пузырчатке, когда количество натрия, хлоридов, кальция уменьшается, а количество калияможетувеличивать- ся до 10,0—12,7 ммоль/л.
Моноцитограмма — тест определения функционального состояния активности мезенхимы (метод дифференцированного выявления и подсчета процентного соотношения разных форм моноцитов периферической крови). В норме процентное соотношение разных группдиф- ференцированных моноцитов таково: промоноциты - 20-28 %, собственно моноциты —26-32 %, полиморфноядерные моноциты - 42-52 %. Изменение соотношения этих форм в сторону поли морфноядерных клеток свидетельствует о снижении защитной реакции организма.
Исследования мочи проводят при воспалительных заболеваниях СОЛР и патологии пародонта с целью выявления заб ол еваний почек, а также для определения уровня глюкозы в моче и своевременной диагностики сахарного диабета (в случае сухости в полости рта).
Цитологические исследования представляют собой разновидность морфологического метода. С их помощью изучают клеточный состав элементов поражения СОПР при различных патологических состояниях. Простота и доступность получения материала, возможность без ограничений многократно повторять исследования дают основание применять цитологические исследования как диагностические, а также для объективной оценки реактивности организма больного, течения заболевания в динамике и оценки эффективности проводимого лечения. Методы клинической цитологии хорошо зарекомендовали себя в стоматологии при диагностике некоторых онкологических заболеваний, язвенно-некротического стоматита, пузырчатки, простого герпеса и др.
Цитологические препараты готовят методом соскоба, отпечатка или перепечатка (если элементы поражения СОПР расположены в местах, недоступных для получения прямого отпечатка). Если невозможно получить соскоб или отпечаток, цитологический препарат готовят из осадка ротовой жидкости. На этих препаратах выявляют клетки гематогенного (нейтрофилы, эозинофилы, лимфоциты и др.) и гистогенного (фибробласты, оседлые макрофагоциты, тканевые базофилы, ллазмоциты и др.) происхождения; клетки эпителия (ороговева- ющие, ороговевшие, атипические, клетки Ту- анка); специфические клетки - типа Лангган- са, эпителеоидные, клетки-монстры (клетки балл они рующсй дистрофии), а также определяют микроорганизмы (кокки, веретенообразные бактерии, спирохеты, простейшие, грибы).
Оценка клеточного состава экссудата позволяет получить представление о защитных реакциях СО. При этом определяют качественное и количественное соотношение нейтрофилов, активность фагоцитоза. Важное диагностическое значение имеет количество в поле зрения препарата лимфоцитов, полибластов, эпителиальных клеток и плазмоцитов.
Как дополнительный тест, возможно использование флуоресцентной цитодиагностики (когда цитологический препарат обрабатывают флуоресцентными красителями). Под флуоресцентным микроскопом в клетках здоровых участков СО цитоплазма флуоресцирует зелеными (темно-зелеными) оттенками, а ядро - от светло-зеленых до желтоватых оттенков.
Индекс кератннизации (ИК) определяет степень кератинизации и характеризует барьерную функцию СО. Для определения индекса кератинизации подсчитывают общее количество эпителиальных клеток в поле зрения микроскопа. Затем количество ороговелых клеток умножают на 100 и делят на общее количество клеток. Снижение показателей индекса кера- тинизации в динамике обследования пораженного участка СО свидетельствует о снижении ее барьерной функции.
Микробиологические исследования позволяют уточнить причину заболевания, выявить вид инфекции, определить ее вирулентность и чувствительность к антибиотикам и другим нротивомикробным препаратам. При микробиологических исследованиях необходимо придерживаться определенных правил: до взятия материала больному нельзя принимать никаких лекарственных препаратов, полоскать рот, чистить зубы. Непосредственно перед взятием материала следует промыть рот теплой водой, очистить пораженный участок СО стерильным ватным тампоном. Материал берут стерильными, плотно свернутыми из ваты шариками диаметром 2—5 мм или микробиологической петлей. Высевают материал на специальные питательные среды в пробирках или на чашках Петри.
Бактериоскопическое исследование (определение микроорганизмов, находящихся на поверхности язв, эрозий и других элементов поражения СОПР) проводят с целью выявления возбудителей некоторых заболеваний, в том числе и специфических инфекций (сифилис, туберкулез, гонорея, лепра, кандидоз, актиномикоз). В лабораторной практике проводят микроскопию как нативных (свежих, необработанных), так и фиксированных препаратов. Микроскопию фиксированных препаратов часто используют для диагностики грибковой патологии, обусловленной дрожжеподобными грибами рода Candida.
Материал для исследования (творожистый налет, белые бляшки) берут прокаленной и остывшей платиновой петлей или стерильным зубоврачебным шпателем. Забор материала проводят утром, обязательно натощак, при нечищеных зубах. Обнаружение единичных дрожжевых клеток в препарате, даже на стадии почкования, не имеет диагностического значения, поскольку как сапрофит гриб Candida встречается у 60 % здоровых людей. О патологии свидетельствует выявление значительного количества элементов гриба, его значительное почкование или наличие псевдомицелия.
Выявление бледной трепонемы проводится путем микроскопии материала первичной сифиломы или пунктата регионарного лимфоузла (бубона), а также содержимого соскоба с папул или эрозий при вторичном сифилисе. Это исследование проводят при затемненном конденсоре в темном поле микроскопа. Обнаружение бледной трепонемы служит абсолютным подтверджением диагноза сифилиса.
При язвенно-некротическом стоматите и ангине Венсана в 100 % случаев выявляется еим- биоз веретенообразной палочки и спирохеты Венсана. Намного сложнее при бактериоскопи- ческом исследовании выявить бациллу Коха.
Аллергологичеекие методы обследования проводят при подозрении на аллергическое поражение СОПР. Важнейшим элементом аллергологического обследования больного является аллергологический анамнез. При сборе этого анамнеза обращают внимание на отягощенную аллергическими заболеваниями наследственность, склонность больного к аллергическим реакциям в прошлом и в настоящее время; уточняют возможную причину и реальный аллерген. С этой целью выявляют наличие сопутствующих заболеваний, реакцию организма больного на продукты питания, некоторые растения и цветы, запахи, медикаменты, бытовые и промышленные химические соединения.
Аллергологическое обследование проводят с помощью специфических и неспецифических аллергологических тестов.
Неспецифимескими аллергологическими тест а ми являются эозинофилия и лейкопения секрета в очаге поражения СОПР и периферической крови; тромбоцитопения и лейкопения вплоть до агранулоцитоза; повышение содержания глобулинов в сыворотке крови (особенно фракции у-глобулинов). Достоверность этих тестов достигает 30—40 %.
Специфические аллергологические тесты позволяют выявить сенсибилизацию организма к определенному аллергену. К ним относят кожную и мукозную пробы; клеточные тесты [реакция л ейкоцитолиза, показатель повреждения нейтрофилов (ППН); реакция агломерации лейкоцитов (РАЛ), индекс агглютинации тромбоцитов; реакция дег- раиуляции базофильных лейкоцитов (тест Шелли) и др.].
Среди кожных проб различают аппликационную, капельную, скарификаци- онную и внутрикожную. Их применяют с целью предупреждения тяжелых общих реакций анафилактического характера.
Аппликационная проба. На обработанную спиртом или спирто-эфиром внутреннюю поверхность кожи предплечья накладывают марлю, сложенную в несколько слоев и имеющую форму квадрата (1x1 см или 1,5x1,5 см), смоченную раствором или экстр актом одного или нескольких исследуемых веществ. Мало закрывают целлофаном или компрессной бумагой и фиксируют лейкопластырем. Результаты пробы оценивают через 10—20 мин (реакция немедленного типа) и через 24— 48 ч (реакция замедленного типа). Проба оценивается как положительная при наличии гиперемии, гиперемии с инфильтрацией, гиперемии с отеком, образовании пузырей. Чрезмерно положительная реакция может сопровождаться отеком, гиперемией, образованием большого пузыря ИЛИ некрозом на всей поверхности контакта аллергена с кожей.
Капельная проба. На здоровую поверхность кожи внутренней поверхности предплечья наносят 1—2 капли раствора исследуемого вещества в спирте или изотоническом растворе NaCl и дают ему высохнуть. Результаты капельной пробы оценивают через 2, 4, 12, 24 часа. В случае ССнеибилизации больного к данному препарату уже через 1—20 мин на месте нанесения капли возникает зуд, отечность, гиперемия.
Скарификационная проба. Раствор тест-препарата наносят на скарифицированную кожуил и скарификацию делают через каи- лю нанесенного на поверхность кожи предплечья раствора тест-препарата. Реакция немедленного типа проявляется через 1—20 мин и сопровождается зудом, покраснением, отеком; иногда возникает пузырь, а при гиперчувствительности элементы крапивницы могут образоваться и в ОТЛ^енныхучастках кожи. Поэтому у очень чувствительных пациентов эту пробу рекомендуют проводить при отрицательной капельной или аппликационной пробах.
Объективным тестом определения аллергии к металлам есть скарификационно- пленочный тест (Бородин Ю.П., 1976). На внутреннюю поверхность предплечья наносят по 1 капле спиртового раствора солей: 0,5% KjCr.,0^ 5% NiCl2, 5% Co(N03)r Затем на глубину эпидермиса делают по ДВС параллельные царапины длиной 10 ММ на расстоянии 3—4 ММ одна от другой. Когда капли высохнут, их покрывают клеем БФ-6. Оценку реакции проводят через 24-48 часов за 4-бальноЙ системой.
Аллергию к металлам можно выявить и с помощью аппликационной пробы на СОПР, а также с помощью специального устройства для определения чувствительности тканей к испытываемым матер налам (А.С. № 1526652). Экспресс-диагностику аллергии к металлам можно провести методом с использованием явления магнитоядерного резонанса веществ.
Внутрикожная проба. Внутрикожно вводят 0,02—0,05 мл стерильного исследуемого вещества в разведении 1:1000 и на некотором расстоянии (35—40 мм) такое же количество изотонического раствора хлорида натрия. Через 24—48 часов определяют реакцию кожи, сравнивая ее в месте введения исследуемого раствора с контролем. При положительной внутрикожной пробе в месте инъекции лекарственного раствора образуются гиперемия, отек ткани, волдырь диаметром до 5 см; местная реакция сопровождается кожным зудом, общей слабостью. Естественно, что в таком случае применение этого вещества больному противопоказано.
ВнутрИКОЖНЫе пробы весьма чувствительные, однако их нельзя применять для диагностики аллергии к мономеру пластмасс, компонентов зубных паст, губной помады и других материалов, которые используют в ортопедической стоматологии и косметике.
Мукозные пробь I ставят при высокой чувствительности СОПР. Для постановки пробы используют специмырто Присоску, в глубине которой коллодием приклеивают кусочек ткани, пропитанный исследуемым веществом. Присоску фиксируют к СО губы так, чтобы исследуемое вещество соприкасалось со слизистой. Результаты оценивают через 30 мин. Недостатком метода есть то, что в месте фиксации присоски нарушается кровообращение СО.
У субъектов, имеющих зубы, более точный ответ получают, используя вариант мукозной пробы, когда аллерген помещают под пластинку. Для этого сначала из каучука или шеллака делают пластинку с Хаммерами, которыми она фиксируется на зубах. После припасовки в полости рта на поверхности пластинки, обращенной к СО неба, делают две лунки диаметром 25мм, глубиной 2 мм. В одну из них вносят предполагаемый аллерген, в другую — изотонический раствор натрия хлорида. Пластинку накладывают на небо на 12-48 часов. В течение этого времени больной не должен принимать жидкую пищу. Оценку результатов пробы проводят по ПЯТИбальнОЙ системе: 1 — гиперемия ( + ), ТТ — гиперемия с отеком ( + + ), III — гиперемия с пузырьками ( + + + ), IV — сливная сыпь (++++)уV — некроз ( + + + + + ).
Клеточные тесты. Реакциялейкоци- толиза основана на выявлении деформирующего действия бактериальных аллергенов на лейкоциты периферической крови. В лейкоцитах крови больных, страдающих бактериальной аллергией, есть фактор "переноса" или “аллер- гезирующий фактор", который обусловливает деформацию лейкоцитов, если на них воздействовать специфическим аллергеном.
Методика: в опытную пробирку берут 1 каплю 3 % раствора цитрата натрия, добавляют 3 капли крови пациента, перемешивают и добавляют 1 каплю аллергена, дозированного на 10 кожных доз в 0,1 мл, осторожно перемешивают и ставят на 1 ч в термостат при температуре 37°С.
В контрольную пробирку вносят те же ингредиенты, только вместо аллергена вносят в том же количестве буферный раствор, на котором изготовлен аллерген. Затем из каждой пробирки готовят по три тонких мазка крови, которые окрашивают по Папейгсйму-Крюкову. Подсчитывают по 100 нейтрофилов в трех мазках, выделив деформ ированные и разрушенные лейкоциты. Специфический аллерген деформирует и разрушает более 14 % нейтрофилов; неспецифическая деформация не превышает 10 %.
Реакция агломерациизаоючается в отдел fa- ном подсчете лейкоцитов, которые образуют группы не менее, чем из трех лейкоцитов. Процент склеивания лейкоцитов является показателем степени агломерации. Реакция считается положительной, если разница между опытом и контролем составляет не менее 30 %,
Реакция базофиловпо Шелли основывается на свойстве базофилов в ответ на действие аллергена выделять гистамин. Лейкоциты в этой реакции используются как клетки-индикаторы. Реакцию применяют для диагностики медикаментозной аллергии и полинозов (аллергии на пыльцу растений).
Реакциядегрйнуляции тканевыхбазофилов (тучных клеток) соединительной ткани основана на свойстве тучных клеток выделять и фиксировать из внешней среды гистамин и концентрировать его в гранулах. При постановке реакции используют сыворотку крови обследуемого больного, перитонеальные тучные клетки крысы, специфический аллерген, который подозревается как фактор сенсибилизации, а также неспецифический (контрольный) аллерген.
Тест оценивают по данным микроскопии препарата (х 280), в котором просматривают 100 тучных клеток, не контактирующих друг с другом, Среди них выделяют нормальные и дегранулированные. Дегрануляция тучных клеток проявляется ослаблением окраски гранул, нахождением в цитоплазме вакуоли с неокрашенной "короной", разрывом и "выходом" гранул. Клетки, абсолютно лишенные окраски, имеют вид медовых сот. Процент дсгранулиро ванных тучных клеток определяют, отняв от количества этих клеток в исследуемом препарате наибольшее число их в одном из контрольных препаратов. Тест считается положительным, если дегранулированных клеток больше 10%.
Методы оценки иммунологического состояния больных с поражением СОПР. При некоторых заболеваниях СОПР возникает необходимость провести иммунологическое обследование больного. Существующие серологические реакции проводят при подозрении на специфическую инфекцию (реакция Вассермана, Кана и цитохолевая (осадочные) реакции — для диагностики сифилиса; реакция Райта — при бруцеллезе, лепроминовая проба — при лепре). Следует учитывать, что при первичном сифилисе серологические реакции дают положительную реакцию только через 2—3 нед после возникновения твердого шанкра. В третичном периоде ДОСТОВСрнОСТЬ серологических реакций — 50-75 %. При вторичном сифилисе они, как правило, положительные, однако возможно и отрицательное значение реакции. Вот почему, заподозрив сифилис, стоматолог должен заручиться консультацией дерматовенеролога. Вместе с тем, реакция Вассермана может быть положительной При хрониосепсисе, острых инфекционных заболеваниях, малярии, инфаркте миокарда, раке и т.д.; слабоположительной — при беременности и даже при запорах.
При заболеваниях СО неспецифическая рсзистентность снижена соответственно тяжести состояния больного: угнетена функциональная активность соединительной ткани, снижены титр лизоцима, фагоцитарная активность лейкоцитов, комплементарная активность сыворотки крови, угнетена активность макрофагов, повышена повреждаемость нейтрофилов, высоки показатели реакции агломерации лейкоцитов (РАЛ). Неспецифическими тестами аллсргизации организма являются ЭОЗИНОфилия периферической крови и тканей патологическом зоны, тромбопения, лейкопения, агранулоцитоз, изменение Протеинограммы и реакции адсорбции микроорганизмов.
Внутрикожная проба Р.Э. Ка- вецкого в модификации С.М.БазарновоЙ выявляет функциональное состояние соединительной ткани и основана на свойстве ткани удерживать ивдиферентные красители.
В СО НИЖНСЙ губы вводят 0,1 мл 0,25% стерильного раствора трипанового или метиленового синего. О распространении красителя судят по размеру пятна. Его диаметр измеряют в момент введения и через 3 ч. Соотношение квадрата радиуса пятна в момент введения красителя и квадрата радиуса через 3 ч является коэффициентом пробы Кавецкого. В норме он равен 5—7. Значения ниже 5 свидетельствуют
об угнетении, а выше 7 — об усилении реактивности. Величины 1—2 свидетельствуют о полной ареактивности организма.
Л и з о ц и м в слюне определяют методом Лоури, который основан на свойстве слюны расщеплять полисахариды клеточной оболочки бактерий. Активность лизоцима определяют нефелометрическим методом по изменению мутности суспензии Micrococcus lisoideis и выражают в микрограммах кристаллического лизоцима на 1 мг белка за 30 мин инкубации при температуре 37 °С, а также определяют его уровень в 1 мл слюны (в норме — 18,1 мг/100 мл).
Фагоцитарная активность
лейкоцитов характеризует уровень защиты СО при разных ее состояниях. Для определения фагоцитарной активности используют двумиллиардную суспензию убитой нагреванием суточной культуры стафилококка (штам 209). Ее смешивают с 0,1 мл нитратной крови больного. Смесь инкубируют в термостате при температуре 37 °С в течение 30 мин и 2 часа, готовят мазки, подсчитывают для обеих экспозиций число клеток, захваченных микроорганизмами, - фагоцитарный индекс (ФИ), а затем определяют индекс завершения фагоцитоза (ИЗФ) по формуле:
(30мин.) ФИ (30 мин)
lt;И1(2.1)ФИ(2.1)
Реакция адсорбции микроорганизмов (РАМ). Метод разработан и рекомендованный нами для оценки сопротивляемости организма при различных заболеваниях как прогнозирующий фактор и как метод оценки эффективности лечения. Он базируется на оценке количественной адсорбции микроорганизмов на поверхности эпителиальных клеток. Методом соскоба берут мазок с видимо здоровой поверхности СО, окрашивают по Романовскому, Паппенгейму или Лейшману и изучают соотношение микрофлоры и клеток эпителия сопр. в мазках подсчитывают количество коков, адсорбированных на поверхности эпителиальных клеток.
В зависимости от количества микроорганизмов, адсорбированных на поверхности клеток эпителия, их делят на 4 группы: I — эпителиальные клетки, не имеющие на своей поверхности адсорбированных микроорганизмов или имеющие лишь единичные кокки; II — поверхностью эпителиальных клеток адсорбировано 5—25 кокков; III — адсорбировано 26— 50 кокков; IV — адсорбировано 51 и больше кокков (тип “муравейника”).
Расчет производят на 100 эпителиальных клетках. I и II группы — отрицательная РАМ, III и IV группы — РАМ положительная. При микроскопии в каждом мазке определяют процент клеток с положительной и отрицательной РАМ. По процентам положительной РАМ определяют сопротивляемость организма: 70 % положительной РАМ и выше — функциональное состояние организма хорошее, 31—69 % — удовлетворительное; 30 % и ниже — неудовлетворительное.
Распространенным методом диагностики заболеваний СОПР при разных дисплазиях эпителия является гистологическое исследование.
Биопсия — прижизненное взятие тканей для микроскопического (гистологического) исследования. Биопсию проводят главным образом в сложных случаях дифференциальной диагностики заболеваний СОПР (новообразования, предраковые заболевания СОПР, долго незаживающие язвы). При этом, соблюдая правила асептики и антисептики, под инфильтра- ционной или проводниковой анестезией ножницами, скальпелем или другим специальным инструментом (иголки разных конструкций при пункционной биопсии или трепанодиссекторы при обследовании костной, хрящевой и фиброзной тканей) удаляют наиболее характерный участок поражения СОПР (кусочек ткани размером 3—5 мм5 с подслизистой основой и прилежащими тканями) с частью здоровой СО. Рану зашивают. Биопсийный материал помещают в пробирку с фиксирующим раствором (чаще всего это 10% нейтральный формалин) и направляют в патогистологическую лабораторию для исследования. При этом обязательно указывают дату проведения биопсии, паспортные и анамнестические данные больного, результаты объективного обследования и предварительный диагноз.
Флюоресцентную биомикроскопию используют для диагностики предопухолевых заболеваний и рака СОПР и губ.
Поскольку признаки начальной малигни- зации практически неуловимы, то необходимы дополнительные методы исследования, которые предшествуют биопсии. Особенно ценны методы прижизненного исследования на уровне микроскопии. Так, метод биомикроскопии
с ТОЛуидиновым синим используют для диагностики онкологических заболеваниях СОПР и красной каймы губ.
Большими возможностями для клинической диагностики обладает люминесцентная методика прижизненного исследования органов и тканей - контактная флуоресцентная б и о м и кр о с к о п и я (КФБ) (Брумерг Е.М., Барский И.Я., 1978).
Для КФБ используют устройство, собранное из переоснащенной системы микроскопа МБИ-1, люминесцентного светильника 01-28, комплекта для контактной биомикроскопии ОЛК-2 и подставки для подбородка. Используя контактный объектив ЛК 25 х 0,75 с разными окулярами, получают увеличенне объекта в 120—240 раз. Для этого исследуемый участок обрабатывают раствором акридинового оранжевого 1:1000 (этот флюорохром дает желтозеленое свечение с ДНК и оранжевое с РНК) и рассматривают его в поле зрения микроскопа. Глубина просматривания тканей — 32—40 мкм. Для исследования поверхности с ороговением ее дополнительно обрабатывают нефлуоресцирующим маслом, что повышает прозрачность рогового слоя и дает возможность судить об изменениях в глубине тканей.
В норме на красной кайме губ при КФБ обнаруживается неоднородное зеленоватое свечение поверхностного слоя безъядерных ороговевших клеток без четких границ между ними. На СО хорошо видны круглые клеточные ядра, светящиеся желто-зеленым светом на фоне зеленоватой цитоплазмы. В ядрах виден хроматин. Размещение ядер в одном слое однородное. Они круглые по форме, расположены на расстоянии одно от другого, границы клеток видны нечетко.
Функцию слюнных желез исследуют в норме, а также при их гипо- или гиперплазии и при ксеростомии. Состав слюны очень разный и лабильный. Он меняется с возрастом и при различных заболеваниях, поэтому определение физических, химических и биохимических показателей слюны имеет большое диагностическое и прогностическое значение (табл. 4),
При исследовании определяют скорость выделения слюны и ее количество. Это проводится чаще натощак или после пробного завтрака. Слюну собирают в мерную пробирку. Если количество слюны меньше 30 мл/ч натощак (0,5 мл/мин) или 50 мл/ч после пробного завтрака
(0,6 мл/мин), то скорость секреции считается пониженной. Для стимуляции слюноотделения используют 1 % раствор пилокарпина (8 капель внутрь), лимонную кислоту (кристаллик под язык), 1 см’ парафина (для жевания). О функции малых слюнных желез судят по количеству функционирующих этих желез на поверхности СО, ограниченной рамкой 2x2 см (в норме их
Таблица 4.
Количественный и качественный состав смешанной слюны
около 20). О секреторной активности этих желез судят по количеству секрета, который выделяется на 4 см2 поверхности СО и всасывается с этой поверхности промокательной бумагой. Среднее количество секрета, выделяемое одной железой, (Кср) вычисляется по формуле:
К —
а — масса бумажки, насыщенной секретом; в — масса бумажки до насыщения; п — количество функционирующих желез. В среднем, этот показатель равен (1,85±0,7)х10 4/мин.
В зависимости от характера поражения СОПР и нарушений общего статуса больного применяют общеклинические (клинический анализ крови и мочи) и специальные (морфологические, микробиологические, гистоцитохимические, иммунологические, серологические, функциональные и др.) методы обследования.
Общий клинический анализ крови является важным вспомогательным методом обследования и проводиться каждому больному с патологией СОПР (табл. 2).
Абсолютно необходимо делать исследование крови больным при наличии в полости рта язвенно-некротических поражений, при проявлениях геморрагического синдрома, а также при подозрении на заболевания крови. Анализ крови позволяет уточнить характер заболевания СОПР и выявить его возможную взаимосвязь с патологией органов кроветворения. Кроме того, гемограмма служит неспецифическим тестом аллергизации организма, а также одним из показателей неспецифической реактивности организма. Так, при некоторых заболеваниях воспалительного характера с острым течением количество лейкоцитов выше нормы; увеличивается процент нейтрофил ьных лейкоцитов, лимфоцитов, значительно уменьшается количество моноцитов и эозинофилов; ускорена СОЭ.
При некоторых хронических заболеваниях, интоксикациях гемограмма может мало изменяться или же наоборот, отражать значительное уменьшение количества эритроцитов, снижение содержания гемоглобина, сдвиг лейкоцитарной формулы влево, увеличение СОЭ.
Heci 1ецифическими тестами аллергизации
являются эозинофилия, тромбопения, лейкопения, лимфоцитоз. Значительное уменьшение количества эритроцитов, изменение их формы, снижение содержания гемоглобина в них - типичные признаки анемии.
Так называемый патологический лейкоцитоз как защитная реакция имеет место при воспалительных процессах СОПР, при язвеннонекротических поражениях, проявлениях аллергии, интоксикациях идр.
Лейкопения может встречаться и у здоровых людей (кратковременно после перегревания, тяжелой физической работы), однако прежде всего ее следует расценивать как признак серьезных нарушений в организме.
Лимфоциты играют значительную роль в выработке иммунитета. Они фиксируют токсины и участвуют в образовании антител. Лимфоциты могут превращаться в так называемые плазматические клетки, которые вырабатывают у-глобулин. Изменения лимфоцитов в ту или иную сторону позволяют врачу правильно оценить не только развитие заболевания, но и тактику его лечения.
Эозинофилия развивается при повышении уровня гистамина в крови и имеет место при аллергизации организма, при иммунных и
 аутоиммунных заболеваниях, при глистной инвазии, гисцноцитозе X и др.
аутоиммунных заболеваниях, при глистной инвазии, гисцноцитозе X и др.
Тромбоциты играют важную роль в остановке кровотечения. При разрушении их в результате повышенной чувствительности к некоторым лекарственным препаратам, при отравлениях химическими соединениями ив ряде других случаев может развиваться тромбоцитопения. Вместе с тем, возможна и физиологическая тромбопнтопения (во время сна, в период менструации). Определение состояния тромбоцитов при некоторых заболеваниях имеет решающее значение в постановке диагноза, особенно в случае геморрагических синдромов.
Биохимический анализ крови проводят с целью определен ия концентрации протеинов и составления протеинограммы, установления концентрации электролитов в сыворотке крови, содержания витаминов и др.
Белки крови. Концентрация протеинов в плазме крови имеет важное диагностическое значение, указывая на тяжесть заболевания. Так, если в норме количество белка в сыворотке крови человека составляет 65 — 85 г/л, то, например, при пузырчатке оно снижаетсяДО 49 и даже до 36 г/л.
Протеинограмма позволяет оценить состояние реактивности организма и сделать прогностические выводы. Протеинограмму периферической крови получают с помощью электрофореза в геле или на бумаге.
Повышенный уровень (3 - и у -глобулинов является неспецифическим тестом диагностики аллергических состояний.
При обострении воспалительного процесса в СОПР количество, с^-, о^-н у-глобулинов возрастает, а процент альбуминов значительно снижается. При хронических воспалительных заболеваниях количество глобулинов повышается за счет фракций а, - и у-глобулинов; фракции а2 и р изменяются мало.
В клинике иногда требуется определить содержание фибриногена. При воспалительных заболеваниях количество фибриногена в плазме крови увеличивается и может достигнуть 58 мг/ 100 мл плазмы (против 29 мг/ЮО мл у здоровых).
При заболеваниях, которые развиваются в результате нарушения витаминного баланса, используют методы определения содержания витаминов в крови больного с целью окончательного решени я вопроса о характере гиповитаминоза, а также для кон
троля эффективности витаминотерапии. В норме в крови витамин С содержится в количестве 0,9—1 мг%, витамин А — 60—70 мг%; витамин Е —0,6—0,9мг%; витамин К —0,5 МГ%. Для выявления насыщенности организма витами ном С применяют пробу Ротгера и языковую пробу.
При постановке пробы Роттера 0,1 мл 0,0025 N свежего раствора краски Тильманса вводят внутрикожно на внутренней стороне предплечья. Время обесцвечивания раствора при нормальной насыщенности организма витамином С — не более 10 мин Методика языковой пробы довольно проста. На высушенную поверхность спинки языка инъекционной иглой диаметром 0,2 мм со шприца наносят 1 каплю индикатора - 0,06 % раствор натриевой соли 2,6-дихлорфенолиндофенола (краска Тильманса), который восстанавливается аскорбиновой кислотой при комнатной температуре, обесцвечивая при этом индикатор. Время обесцвечивания раствора - более 16—20 с — свидетельствует о дефиците аскорбиновой кислоты.
Определение электролитов кр о в и . У здоровых людей концентрация натрия в сыворотке крови составляет 140 ммоль/ л, хлоридов — 120 ммоль/л, кальция 2,25-2,75
ммоль/л, калия 3,8-5,2 ммоль/л. Степень изменения концентрации электролитов нередко коррелирует с тяжестью заболевания. Особое диагностическое и прогностическое значение эти показатели имеют при пузырчатке, когда количество натрия, хлоридов, кальция уменьшается, а количество калияможетувеличивать- ся до 10,0—12,7 ммоль/л.
Моноцитограмма — тест определения функционального состояния активности мезенхимы (метод дифференцированного выявления и подсчета процентного соотношения разных форм моноцитов периферической крови). В норме процентное соотношение разных группдиф- ференцированных моноцитов таково: промоноциты - 20-28 %, собственно моноциты —26-32 %, полиморфноядерные моноциты - 42-52 %. Изменение соотношения этих форм в сторону поли морфноядерных клеток свидетельствует о снижении защитной реакции организма.
Исследования мочи проводят при воспалительных заболеваниях СОЛР и патологии пародонта с целью выявления заб ол еваний почек, а также для определения уровня глюкозы в моче и своевременной диагностики сахарного диабета (в случае сухости в полости рта).
Цитологические исследования представляют собой разновидность морфологического метода. С их помощью изучают клеточный состав элементов поражения СОПР при различных патологических состояниях. Простота и доступность получения материала, возможность без ограничений многократно повторять исследования дают основание применять цитологические исследования как диагностические, а также для объективной оценки реактивности организма больного, течения заболевания в динамике и оценки эффективности проводимого лечения. Методы клинической цитологии хорошо зарекомендовали себя в стоматологии при диагностике некоторых онкологических заболеваний, язвенно-некротического стоматита, пузырчатки, простого герпеса и др.
Цитологические препараты готовят методом соскоба, отпечатка или перепечатка (если элементы поражения СОПР расположены в местах, недоступных для получения прямого отпечатка). Если невозможно получить соскоб или отпечаток, цитологический препарат готовят из осадка ротовой жидкости. На этих препаратах выявляют клетки гематогенного (нейтрофилы, эозинофилы, лимфоциты и др.) и гистогенного (фибробласты, оседлые макрофагоциты, тканевые базофилы, ллазмоциты и др.) происхождения; клетки эпителия (ороговева- ющие, ороговевшие, атипические, клетки Ту- анка); специфические клетки - типа Лангган- са, эпителеоидные, клетки-монстры (клетки балл они рующсй дистрофии), а также определяют микроорганизмы (кокки, веретенообразные бактерии, спирохеты, простейшие, грибы).
Оценка клеточного состава экссудата позволяет получить представление о защитных реакциях СО. При этом определяют качественное и количественное соотношение нейтрофилов, активность фагоцитоза. Важное диагностическое значение имеет количество в поле зрения препарата лимфоцитов, полибластов, эпителиальных клеток и плазмоцитов.
Как дополнительный тест, возможно использование флуоресцентной цитодиагностики (когда цитологический препарат обрабатывают флуоресцентными красителями). Под флуоресцентным микроскопом в клетках здоровых участков СО цитоплазма флуоресцирует зелеными (темно-зелеными) оттенками, а ядро - от светло-зеленых до желтоватых оттенков.
Индекс кератннизации (ИК) определяет степень кератинизации и характеризует барьерную функцию СО. Для определения индекса кератинизации подсчитывают общее количество эпителиальных клеток в поле зрения микроскопа. Затем количество ороговелых клеток умножают на 100 и делят на общее количество клеток. Снижение показателей индекса кера- тинизации в динамике обследования пораженного участка СО свидетельствует о снижении ее барьерной функции.
Микробиологические исследования позволяют уточнить причину заболевания, выявить вид инфекции, определить ее вирулентность и чувствительность к антибиотикам и другим нротивомикробным препаратам. При микробиологических исследованиях необходимо придерживаться определенных правил: до взятия материала больному нельзя принимать никаких лекарственных препаратов, полоскать рот, чистить зубы. Непосредственно перед взятием материала следует промыть рот теплой водой, очистить пораженный участок СО стерильным ватным тампоном. Материал берут стерильными, плотно свернутыми из ваты шариками диаметром 2—5 мм или микробиологической петлей. Высевают материал на специальные питательные среды в пробирках или на чашках Петри.
Бактериоскопическое исследование (определение микроорганизмов, находящихся на поверхности язв, эрозий и других элементов поражения СОПР) проводят с целью выявления возбудителей некоторых заболеваний, в том числе и специфических инфекций (сифилис, туберкулез, гонорея, лепра, кандидоз, актиномикоз). В лабораторной практике проводят микроскопию как нативных (свежих, необработанных), так и фиксированных препаратов. Микроскопию фиксированных препаратов часто используют для диагностики грибковой патологии, обусловленной дрожжеподобными грибами рода Candida.
Материал для исследования (творожистый налет, белые бляшки) берут прокаленной и остывшей платиновой петлей или стерильным зубоврачебным шпателем. Забор материала проводят утром, обязательно натощак, при нечищеных зубах. Обнаружение единичных дрожжевых клеток в препарате, даже на стадии почкования, не имеет диагностического значения, поскольку как сапрофит гриб Candida встречается у 60 % здоровых людей. О патологии свидетельствует выявление значительного количества элементов гриба, его значительное почкование или наличие псевдомицелия.
Выявление бледной трепонемы проводится путем микроскопии материала первичной сифиломы или пунктата регионарного лимфоузла (бубона), а также содержимого соскоба с папул или эрозий при вторичном сифилисе. Это исследование проводят при затемненном конденсоре в темном поле микроскопа. Обнаружение бледной трепонемы служит абсолютным подтверджением диагноза сифилиса.
При язвенно-некротическом стоматите и ангине Венсана в 100 % случаев выявляется еим- биоз веретенообразной палочки и спирохеты Венсана. Намного сложнее при бактериоскопи- ческом исследовании выявить бациллу Коха.
Аллергологичеекие методы обследования проводят при подозрении на аллергическое поражение СОПР. Важнейшим элементом аллергологического обследования больного является аллергологический анамнез. При сборе этого анамнеза обращают внимание на отягощенную аллергическими заболеваниями наследственность, склонность больного к аллергическим реакциям в прошлом и в настоящее время; уточняют возможную причину и реальный аллерген. С этой целью выявляют наличие сопутствующих заболеваний, реакцию организма больного на продукты питания, некоторые растения и цветы, запахи, медикаменты, бытовые и промышленные химические соединения.
Аллергологическое обследование проводят с помощью специфических и неспецифических аллергологических тестов.
Неспецифимескими аллергологическими тест а ми являются эозинофилия и лейкопения секрета в очаге поражения СОПР и периферической крови; тромбоцитопения и лейкопения вплоть до агранулоцитоза; повышение содержания глобулинов в сыворотке крови (особенно фракции у-глобулинов). Достоверность этих тестов достигает 30—40 %.
Специфические аллергологические тесты позволяют выявить сенсибилизацию организма к определенному аллергену. К ним относят кожную и мукозную пробы; клеточные тесты [реакция л ейкоцитолиза, показатель повреждения нейтрофилов (ППН); реакция агломерации лейкоцитов (РАЛ), индекс агглютинации тромбоцитов; реакция дег- раиуляции базофильных лейкоцитов (тест Шелли) и др.].
Среди кожных проб различают аппликационную, капельную, скарификаци- онную и внутрикожную. Их применяют с целью предупреждения тяжелых общих реакций анафилактического характера.
Аппликационная проба. На обработанную спиртом или спирто-эфиром внутреннюю поверхность кожи предплечья накладывают марлю, сложенную в несколько слоев и имеющую форму квадрата (1x1 см или 1,5x1,5 см), смоченную раствором или экстр актом одного или нескольких исследуемых веществ. Мало закрывают целлофаном или компрессной бумагой и фиксируют лейкопластырем. Результаты пробы оценивают через 10—20 мин (реакция немедленного типа) и через 24— 48 ч (реакция замедленного типа). Проба оценивается как положительная при наличии гиперемии, гиперемии с инфильтрацией, гиперемии с отеком, образовании пузырей. Чрезмерно положительная реакция может сопровождаться отеком, гиперемией, образованием большого пузыря ИЛИ некрозом на всей поверхности контакта аллергена с кожей.
Капельная проба. На здоровую поверхность кожи внутренней поверхности предплечья наносят 1—2 капли раствора исследуемого вещества в спирте или изотоническом растворе NaCl и дают ему высохнуть. Результаты капельной пробы оценивают через 2, 4, 12, 24 часа. В случае ССнеибилизации больного к данному препарату уже через 1—20 мин на месте нанесения капли возникает зуд, отечность, гиперемия.
Скарификационная проба. Раствор тест-препарата наносят на скарифицированную кожуил и скарификацию делают через каи- лю нанесенного на поверхность кожи предплечья раствора тест-препарата. Реакция немедленного типа проявляется через 1—20 мин и сопровождается зудом, покраснением, отеком; иногда возникает пузырь, а при гиперчувствительности элементы крапивницы могут образоваться и в ОТЛ^енныхучастках кожи. Поэтому у очень чувствительных пациентов эту пробу рекомендуют проводить при отрицательной капельной или аппликационной пробах.
Объективным тестом определения аллергии к металлам есть скарификационно- пленочный тест (Бородин Ю.П., 1976). На внутреннюю поверхность предплечья наносят по 1 капле спиртового раствора солей: 0,5% KjCr.,0^ 5% NiCl2, 5% Co(N03)r Затем на глубину эпидермиса делают по ДВС параллельные царапины длиной 10 ММ на расстоянии 3—4 ММ одна от другой. Когда капли высохнут, их покрывают клеем БФ-6. Оценку реакции проводят через 24-48 часов за 4-бальноЙ системой.
Аллергию к металлам можно выявить и с помощью аппликационной пробы на СОПР, а также с помощью специального устройства для определения чувствительности тканей к испытываемым матер налам (А.С. № 1526652). Экспресс-диагностику аллергии к металлам можно провести методом с использованием явления магнитоядерного резонанса веществ.
Внутрикожная проба. Внутрикожно вводят 0,02—0,05 мл стерильного исследуемого вещества в разведении 1:1000 и на некотором расстоянии (35—40 мм) такое же количество изотонического раствора хлорида натрия. Через 24—48 часов определяют реакцию кожи, сравнивая ее в месте введения исследуемого раствора с контролем. При положительной внутрикожной пробе в месте инъекции лекарственного раствора образуются гиперемия, отек ткани, волдырь диаметром до 5 см; местная реакция сопровождается кожным зудом, общей слабостью. Естественно, что в таком случае применение этого вещества больному противопоказано.
ВнутрИКОЖНЫе пробы весьма чувствительные, однако их нельзя применять для диагностики аллергии к мономеру пластмасс, компонентов зубных паст, губной помады и других материалов, которые используют в ортопедической стоматологии и косметике.
Мукозные пробь I ставят при высокой чувствительности СОПР. Для постановки пробы используют специмырто Присоску, в глубине которой коллодием приклеивают кусочек ткани, пропитанный исследуемым веществом. Присоску фиксируют к СО губы так, чтобы исследуемое вещество соприкасалось со слизистой. Результаты оценивают через 30 мин. Недостатком метода есть то, что в месте фиксации присоски нарушается кровообращение СО.
У субъектов, имеющих зубы, более точный ответ получают, используя вариант мукозной пробы, когда аллерген помещают под пластинку. Для этого сначала из каучука или шеллака делают пластинку с Хаммерами, которыми она фиксируется на зубах. После припасовки в полости рта на поверхности пластинки, обращенной к СО неба, делают две лунки диаметром 25мм, глубиной 2 мм. В одну из них вносят предполагаемый аллерген, в другую — изотонический раствор натрия хлорида. Пластинку накладывают на небо на 12-48 часов. В течение этого времени больной не должен принимать жидкую пищу. Оценку результатов пробы проводят по ПЯТИбальнОЙ системе: 1 — гиперемия ( + ), ТТ — гиперемия с отеком ( + + ), III — гиперемия с пузырьками ( + + + ), IV — сливная сыпь (++++)уV — некроз ( + + + + + ).
Клеточные тесты. Реакциялейкоци- толиза основана на выявлении деформирующего действия бактериальных аллергенов на лейкоциты периферической крови. В лейкоцитах крови больных, страдающих бактериальной аллергией, есть фактор "переноса" или “аллер- гезирующий фактор", который обусловливает деформацию лейкоцитов, если на них воздействовать специфическим аллергеном.
Методика: в опытную пробирку берут 1 каплю 3 % раствора цитрата натрия, добавляют 3 капли крови пациента, перемешивают и добавляют 1 каплю аллергена, дозированного на 10 кожных доз в 0,1 мл, осторожно перемешивают и ставят на 1 ч в термостат при температуре 37°С.
В контрольную пробирку вносят те же ингредиенты, только вместо аллергена вносят в том же количестве буферный раствор, на котором изготовлен аллерген. Затем из каждой пробирки готовят по три тонких мазка крови, которые окрашивают по Папейгсйму-Крюкову. Подсчитывают по 100 нейтрофилов в трех мазках, выделив деформ ированные и разрушенные лейкоциты. Специфический аллерген деформирует и разрушает более 14 % нейтрофилов; неспецифическая деформация не превышает 10 %.
Реакция агломерациизаоючается в отдел fa- ном подсчете лейкоцитов, которые образуют группы не менее, чем из трех лейкоцитов. Процент склеивания лейкоцитов является показателем степени агломерации. Реакция считается положительной, если разница между опытом и контролем составляет не менее 30 %,
Реакция базофиловпо Шелли основывается на свойстве базофилов в ответ на действие аллергена выделять гистамин. Лейкоциты в этой реакции используются как клетки-индикаторы. Реакцию применяют для диагностики медикаментозной аллергии и полинозов (аллергии на пыльцу растений).
Реакциядегрйнуляции тканевыхбазофилов (тучных клеток) соединительной ткани основана на свойстве тучных клеток выделять и фиксировать из внешней среды гистамин и концентрировать его в гранулах. При постановке реакции используют сыворотку крови обследуемого больного, перитонеальные тучные клетки крысы, специфический аллерген, который подозревается как фактор сенсибилизации, а также неспецифический (контрольный) аллерген.
Тест оценивают по данным микроскопии препарата (х 280), в котором просматривают 100 тучных клеток, не контактирующих друг с другом, Среди них выделяют нормальные и дегранулированные. Дегрануляция тучных клеток проявляется ослаблением окраски гранул, нахождением в цитоплазме вакуоли с неокрашенной "короной", разрывом и "выходом" гранул. Клетки, абсолютно лишенные окраски, имеют вид медовых сот. Процент дсгранулиро ванных тучных клеток определяют, отняв от количества этих клеток в исследуемом препарате наибольшее число их в одном из контрольных препаратов. Тест считается положительным, если дегранулированных клеток больше 10%.
Методы оценки иммунологического состояния больных с поражением СОПР. При некоторых заболеваниях СОПР возникает необходимость провести иммунологическое обследование больного. Существующие серологические реакции проводят при подозрении на специфическую инфекцию (реакция Вассермана, Кана и цитохолевая (осадочные) реакции — для диагностики сифилиса; реакция Райта — при бруцеллезе, лепроминовая проба — при лепре). Следует учитывать, что при первичном сифилисе серологические реакции дают положительную реакцию только через 2—3 нед после возникновения твердого шанкра. В третичном периоде ДОСТОВСрнОСТЬ серологических реакций — 50-75 %. При вторичном сифилисе они, как правило, положительные, однако возможно и отрицательное значение реакции. Вот почему, заподозрив сифилис, стоматолог должен заручиться консультацией дерматовенеролога. Вместе с тем, реакция Вассермана может быть положительной При хрониосепсисе, острых инфекционных заболеваниях, малярии, инфаркте миокарда, раке и т.д.; слабоположительной — при беременности и даже при запорах.
При заболеваниях СО неспецифическая рсзистентность снижена соответственно тяжести состояния больного: угнетена функциональная активность соединительной ткани, снижены титр лизоцима, фагоцитарная активность лейкоцитов, комплементарная активность сыворотки крови, угнетена активность макрофагов, повышена повреждаемость нейтрофилов, высоки показатели реакции агломерации лейкоцитов (РАЛ). Неспецифическими тестами аллсргизации организма являются ЭОЗИНОфилия периферической крови и тканей патологическом зоны, тромбопения, лейкопения, агранулоцитоз, изменение Протеинограммы и реакции адсорбции микроорганизмов.
Внутрикожная проба Р.Э. Ка- вецкого в модификации С.М.БазарновоЙ выявляет функциональное состояние соединительной ткани и основана на свойстве ткани удерживать ивдиферентные красители.
В СО НИЖНСЙ губы вводят 0,1 мл 0,25% стерильного раствора трипанового или метиленового синего. О распространении красителя судят по размеру пятна. Его диаметр измеряют в момент введения и через 3 ч. Соотношение квадрата радиуса пятна в момент введения красителя и квадрата радиуса через 3 ч является коэффициентом пробы Кавецкого. В норме он равен 5—7. Значения ниже 5 свидетельствуют
об угнетении, а выше 7 — об усилении реактивности. Величины 1—2 свидетельствуют о полной ареактивности организма.
Л и з о ц и м в слюне определяют методом Лоури, который основан на свойстве слюны расщеплять полисахариды клеточной оболочки бактерий. Активность лизоцима определяют нефелометрическим методом по изменению мутности суспензии Micrococcus lisoideis и выражают в микрограммах кристаллического лизоцима на 1 мг белка за 30 мин инкубации при температуре 37 °С, а также определяют его уровень в 1 мл слюны (в норме — 18,1 мг/100 мл).
Фагоцитарная активность
лейкоцитов характеризует уровень защиты СО при разных ее состояниях. Для определения фагоцитарной активности используют двумиллиардную суспензию убитой нагреванием суточной культуры стафилококка (штам 209). Ее смешивают с 0,1 мл нитратной крови больного. Смесь инкубируют в термостате при температуре 37 °С в течение 30 мин и 2 часа, готовят мазки, подсчитывают для обеих экспозиций число клеток, захваченных микроорганизмами, - фагоцитарный индекс (ФИ), а затем определяют индекс завершения фагоцитоза (ИЗФ) по формуле:
(30мин.) ФИ (30 мин)
lt;И1(2.1)ФИ(2.1)
Реакция адсорбции микроорганизмов (РАМ). Метод разработан и рекомендованный нами для оценки сопротивляемости организма при различных заболеваниях как прогнозирующий фактор и как метод оценки эффективности лечения. Он базируется на оценке количественной адсорбции микроорганизмов на поверхности эпителиальных клеток. Методом соскоба берут мазок с видимо здоровой поверхности СО, окрашивают по Романовскому, Паппенгейму или Лейшману и изучают соотношение микрофлоры и клеток эпителия сопр. в мазках подсчитывают количество коков, адсорбированных на поверхности эпителиальных клеток.
В зависимости от количества микроорганизмов, адсорбированных на поверхности клеток эпителия, их делят на 4 группы: I — эпителиальные клетки, не имеющие на своей поверхности адсорбированных микроорганизмов или имеющие лишь единичные кокки; II — поверхностью эпителиальных клеток адсорбировано 5—25 кокков; III — адсорбировано 26— 50 кокков; IV — адсорбировано 51 и больше кокков (тип “муравейника”).
Расчет производят на 100 эпителиальных клетках. I и II группы — отрицательная РАМ, III и IV группы — РАМ положительная. При микроскопии в каждом мазке определяют процент клеток с положительной и отрицательной РАМ. По процентам положительной РАМ определяют сопротивляемость организма: 70 % положительной РАМ и выше — функциональное состояние организма хорошее, 31—69 % — удовлетворительное; 30 % и ниже — неудовлетворительное.
Распространенным методом диагностики заболеваний СОПР при разных дисплазиях эпителия является гистологическое исследование.
Биопсия — прижизненное взятие тканей для микроскопического (гистологического) исследования. Биопсию проводят главным образом в сложных случаях дифференциальной диагностики заболеваний СОПР (новообразования, предраковые заболевания СОПР, долго незаживающие язвы). При этом, соблюдая правила асептики и антисептики, под инфильтра- ционной или проводниковой анестезией ножницами, скальпелем или другим специальным инструментом (иголки разных конструкций при пункционной биопсии или трепанодиссекторы при обследовании костной, хрящевой и фиброзной тканей) удаляют наиболее характерный участок поражения СОПР (кусочек ткани размером 3—5 мм5 с подслизистой основой и прилежащими тканями) с частью здоровой СО. Рану зашивают. Биопсийный материал помещают в пробирку с фиксирующим раствором (чаще всего это 10% нейтральный формалин) и направляют в патогистологическую лабораторию для исследования. При этом обязательно указывают дату проведения биопсии, паспортные и анамнестические данные больного, результаты объективного обследования и предварительный диагноз.
Флюоресцентную биомикроскопию используют для диагностики предопухолевых заболеваний и рака СОПР и губ.
Поскольку признаки начальной малигни- зации практически неуловимы, то необходимы дополнительные методы исследования, которые предшествуют биопсии. Особенно ценны методы прижизненного исследования на уровне микроскопии. Так, метод биомикроскопии
с ТОЛуидиновым синим используют для диагностики онкологических заболеваниях СОПР и красной каймы губ.
Большими возможностями для клинической диагностики обладает люминесцентная методика прижизненного исследования органов и тканей - контактная флуоресцентная б и о м и кр о с к о п и я (КФБ) (Брумерг Е.М., Барский И.Я., 1978).
Для КФБ используют устройство, собранное из переоснащенной системы микроскопа МБИ-1, люминесцентного светильника 01-28, комплекта для контактной биомикроскопии ОЛК-2 и подставки для подбородка. Используя контактный объектив ЛК 25 х 0,75 с разными окулярами, получают увеличенне объекта в 120—240 раз. Для этого исследуемый участок обрабатывают раствором акридинового оранжевого 1:1000 (этот флюорохром дает желтозеленое свечение с ДНК и оранжевое с РНК) и рассматривают его в поле зрения микроскопа. Глубина просматривания тканей — 32—40 мкм. Для исследования поверхности с ороговением ее дополнительно обрабатывают нефлуоресцирующим маслом, что повышает прозрачность рогового слоя и дает возможность судить об изменениях в глубине тканей.
В норме на красной кайме губ при КФБ обнаруживается неоднородное зеленоватое свечение поверхностного слоя безъядерных ороговевших клеток без четких границ между ними. На СО хорошо видны круглые клеточные ядра, светящиеся желто-зеленым светом на фоне зеленоватой цитоплазмы. В ядрах виден хроматин. Размещение ядер в одном слое однородное. Они круглые по форме, расположены на расстоянии одно от другого, границы клеток видны нечетко.
Функцию слюнных желез исследуют в норме, а также при их гипо- или гиперплазии и при ксеростомии. Состав слюны очень разный и лабильный. Он меняется с возрастом и при различных заболеваниях, поэтому определение физических, химических и биохимических показателей слюны имеет большое диагностическое и прогностическое значение (табл. 4),
При исследовании определяют скорость выделения слюны и ее количество. Это проводится чаще натощак или после пробного завтрака. Слюну собирают в мерную пробирку. Если количество слюны меньше 30 мл/ч натощак (0,5 мл/мин) или 50 мл/ч после пробного завтрака
(0,6 мл/мин), то скорость секреции считается пониженной. Для стимуляции слюноотделения используют 1 % раствор пилокарпина (8 капель внутрь), лимонную кислоту (кристаллик под язык), 1 см’ парафина (для жевания). О функции малых слюнных желез судят по количеству функционирующих этих желез на поверхности СО, ограниченной рамкой 2x2 см (в норме их
Таблица 4.
Количественный и качественный состав смешанной слюны
|
Показатель |
Среднее значение |
|
Количество слюны |
1400 - 1500 мл/сут |
|
Скорость выделения |
0,1 -1,8 (0,57)мл/мин |
|
Плотность |
1,002 - 1,020 г/см3 |
|
РН |
5,6 - 7,6 (6,75) |
|
Вязкость при 38° С |
22-23 |
|
Вода |
99,14 -99,42% |
|
Плотные вещества |
0,58 -0,86 % |
|
Газы слюны: |
|
|
Кислород |
0,5 -0,8 % |
|
Углекислый газ |
8,0 - 44,0 % |
|
Общий азот |
242 мг/100 мл |
|
Альбумины |
7,6% |
|
Глобулины: |
|
|
а-глобулин |
11,1 % |
|
р-глобулин |
43,3 % |
|
у- глобулин |
18,1 % |
|
Лизоцим |
18,1 мг/ 100 мл |
|
Муцин |
270,0 мг/ 100 мл |
|
Кислая фосфатаза |
22,0 - 23,0 mi /мл |
|
Щелочная фосфатаза |
5,5 - 6,0 мг/мл |
|
|
|
около 20). О секреторной активности этих желез судят по количеству секрета, который выделяется на 4 см2 поверхности СО и всасывается с этой поверхности промокательной бумагой. Среднее количество секрета, выделяемое одной железой, (Кср) вычисляется по формуле:
К —
а — масса бумажки, насыщенной секретом; в — масса бумажки до насыщения; п — количество функционирующих желез. В среднем, этот показатель равен (1,85±0,7)х10 4/мин.
А так же в разделе « Лабораторные методы обследования »
- Глава 1. Полость рта понятие особенности структуры, функции и процессов
- Глава 2. Гистологическое строение слизистои оболочки полости рта и губ
- Общая морфологическая характеристика патологических изменений слизистой оболочки полости рта
- Обследование больных с заболеваниями ¦W' СЛИЗИСТОЙ оболочки полости рта
- Специальные МЕТОДЫ Обследования сопр
- Глава 5. Элементы поражения слизистой оболочки полости рта
- Глава 6. Общие представления о заболеваниях слизистой оболочки полости рта и их систематика (классификация)
- Механическая травма