Влияние на сердечные аритмии
Тахиаритмии опосредованы изменениями сердечного потенциала действия при любом механизме их развития — автоматизме, риентри или каналопатии. Поэтому несложно представить, что препараты, изменяющие форму потенциала действия, могут быть полезны для лечения сердечных тахиаритмий.
На практике препараты, обычно называющиеся анти- аритмическими, относительно малоэффективны для лечения автоматических аритмий или каналопатий. Наоборот, данные средства высокоэффективны почти исключительно при реци- прокных (риентри) аритмиях, которые составляют большинство нарушений сердечного ритма. Тем не менее препараты, изменяющие форму потенциала действия, в принципе способны оказывать влияние на все три механизма аритмий.
Автоматические аритмии
Аномальный автоматизм, предсердный или желудочковый, обычно наблюдается у пациентов, находящихся в экстренных медицинских ситуациях, в результате которых возникают значительные метаболические нарушения. Метаболический дисбаланс, очевидно, меняет характеристики фазы 4 сердечного потенциала действия. К вероятным изменениям, ответственным за аномально повышенный автоматизм, относится увеличение наклона фазы 4 деполяризации или уменьшение максимального диастолического потенциала (то есть снижение отрицательного значения трансмембранного потенциала в начале фазы 4). Любой вид изменения потенциала может вызвать быстрое спонтанное генерирование потенциалов действия, запуская тем самым неадекватную тахикардию (рис. 2.2).
Антиаритмическое средство, которое могло бы оказаться эффективным при автоматических тахиаритмиях, вероятно, должно редуцировать один или оба этих эффекта (увеличение наклона фазы 4 деполяризации или уменьшение максимального диастолического потенциала). К сожалению, препарат, надежно подавляющий аномальный автоматизм в сердечной ткани, пока не создан. Вот почему главная задача состоит в лечении основного заболевания и ликвидации электролитных нарушений, служащих причиной аномального автоматизма.
Триггерная активность
Триггерные аритмии, зависимые от паузы (то есть вызванные ранними следовыми [РСД]), или катехолзависимые (вызванные

Рис. 2.2. Аномальный автоматизм вызывает быстрое спонтанное генерирование потенциалов действия и тем самым — неадекватную тахикардию
поздними следовыми деполяризациями [ПСД]) возникают, как мы видели, в результате аномальной осцилляции потенциала действия. Точный механизм двух данных типов следовых деполяризаций недостаточно ясен, поэтому отсутствуют препараты, которые специфически устраняют ионные токи, ответственные за РСД и ПСД.
РСД связаны с удлинением потенциала действия у восприимчивых к этому индивидуумов. В данной ситуации логично назначение препаратов, уменьшающих длительность потенциала действия. Такие антиаритмические препараты существуют (класс IB), однако их польза для терапии триггерных аритмий, обусловленных РСД, в лучшем случае не однозначна. Как уже упоминалось в гл. 1, наиболее эффективное лечение тахиаритмий, опосредованных РСД,— устранение раздражающего агента и увеличение частоты сердечного ритма с целью предотвращения пауз, вызывающих развитие таких аритмий. Очень важно запомнить, что антиаритмические препараты сами по себе нередко служат причиной появления РСД.
Аналогичным образом, самое действенное лечение, применяемое у пациентов с ПСД, не направлено непосредственно на их специфические ионные причины. Терапия таких аритмий чаще всего включает отмену сердечных гликозидов и назначение |3-блокаторов.
Синдром Бругада
Этот синдром вызывается аномалиями быстрых натриевых каналов. Следует избегать назначения антиаритмических средств, которые блокируют натриевые каналы (препараты I класса) и, по-видимому, потенцируют развитие патологии, связанной с синдромом Бругада. Другие препараты, включая бета-блокаторы и амиодарон, показали в лучшем случае неэффективность при лечении этого синдрома.
Реципрокные аритмии
Антиаритмические средства, обладающие ограниченной эффективностью при лечении автоматических аритмий и кана- лопатий, по крайней мере, теоретически, прямо воздействуют на механизм, ответственный за реципрокные аритмии.
Функционирование петли риентри требует некоторых обязательных условий, а именно непременного наличия анатомического или функционального круга, одна часть которого
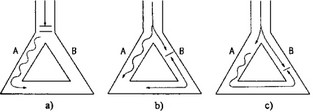
Рис. 2.3. Влияние антиаритмических средств на петлю риентри. а) Эталонная петля риентри (см. рис. 1.6 и 1.7). Ь) Изменения, которые могут наблюдаться при лечении препаратом III класса типа соталола, увеличивающего продолжительность сердечного потенциала действия и рефрактерных периодов. Под влиянием данного препарата рефрактерный период пути В способен значительно удлиняться, препятствуя развитию риентри. с) Изменения, которые могут наблюдаться при лечении препаратом типа лидокаина, укорачивающего продолжительность сердечного потенциала действия и рефрактерных периодов. Длительность рефрактерного периода пути В может уменьшаться до такой степени, что рефрактерные периоды путей А и В становятся почти эквивалентными. Преждевременный импульс может или пройти по обоим путям, или блокироваться в них, препятствуя тем самым возникновению риентри
должна проводить медленно, а вторая — иметь удлиненный рефрактерный период (для возникновения однонаправленной блокады). Сразу же можно понять возможную эффективность препаратов, которые путем изменения формы сердечного потенциала действия влияют на проводимость и рефрактерность тканей, формирующих петлю риентри.
Рис. 2.3 иллюстрирует, что может произойти при воздействии лекарственных средств на петлю риентри. Препарат, который увеличивает продолжительность сердечного потенциала действия (а значит, и рефрактерного периода), еще больше расширяет и без того длительный рефрактерный период одного из путей и таким образом может превращать однонаправленную блокаду в двунаправленную. Наоборот, препарат, имеющий противоположйый эффект на рефрактерные периоды, то есть уменьшающий длительность потенциала действия и рефрактерных периодов, способен укорачивать рефрактерный период одного из путей, так что рефрактерные периоды обоих путей становятся относительно эквивалентными. При
отсутствии разницы рефрактерных периодов двух путей невозможно инициировать риентри.
Ключевым моментом в понимании действия антиаритмических препаратов на реципрокные аритмии является тот факт, что риентри требует критических соотношений рефрактерных периодов и скоростей проведения двух частей петли. Обладая способностью изменять рефрактерные периоды и скорости проведения, антиаритмические средства уменьшают вероятность развития реципрокных аритмий.
Проаритмическое действие
Способ, которым действуют антиаритмические препараты, подавляя реципрокные аритмии, имеет очевидное отрицательное следствие. Например, у пациента с предшествующим инфарктом миокарда и асимптомной неустойчивой желудочковой тахикардией имеется скрытая петля риентри, электро- физиологические свойства которой были недостаточны для развития реципрокной аритмии (как показано на рис. 2.3В). Для подавления асимптомной аритмии пациенту можно назначить препарат класса ИВ (т. е. препарат, уменьшающий продолжительность потенциала действия). Этот препарат, возможно, устранит эктопию, но он также способен уменьшить рефрактерный период одного из путей (с более продолжительным рефрактерным периодом) и привести к появлению у петли риентри характеристик, представленных на рис. 2.3А. Другими словами, препарат обладает свойством увеличивать вероятность возникновения реципрокной аритмии.
Всякий раз, прописывая антиаритмический препарат пациенту с потенциальной петлей риентри, необходимо учитывать, что он может изменить электрофизиологические характеристики петли таким образом, что риск развития устойчивой аритмии станет больше или меньше. Возможны оба варианта — в некоторых случаях даже с одинаковой вероятностью. К сожалению, тот же самый механизм, который продуцирует антиаритмический эффект, оказывает и проаритмическое действие, так что проаритмия — это отнюдь не необычный, идиосинкразический или редкий побочный эффект антиаритмических препаратов. Проаритмия — это предсказуемое и неотъемлемое свойство антиаритмических средств. Поскольку антиаритмическое и проаритмическое действия опосредованы одним и тем же механизмом, невозможно добиться одного эффекта без возникновения другого.
Проаритмия — довольно обычное явление, однако до конца 1980-х имелись определенные трудности в ее диагностике. Недопонимание того, что лекарственная терапия способна ухудшать течение аритмии, часто приводит к назначению неадекватного лечения (в частности увеличению дозы или добавлению другого препарата) и в некоторых случаях к смертельному исходу. В этом заключена проблема отношения к анти- аритмическим препаратам как к «смягчающему бальзаму».
Улучшит ли антиаритмический препарат течение аритмии или ухудшит, трудно предсказать до начала лечения. Вот почему при назначении этих средств не следует забывать о проаритмии.
Классификация антиаритмических средств
Для любой совокупности объектов полезная классификация предоставляет относительно простую, логическую основу, облегчающую обучение и изучение, содействует их связи, практическим обобщениям и дает понимание существенной природы этих объектов. Две основные классификации антиаритмических препаратов — Vaughan-Williams, предложенная в 1971 г., и так называемый сицилианский гамбит (Sicilian Gambit), разработанный 20 лет спустя,— вкратце обсуждаются ниже. На взгляд большинства клиницистов, более старая классификация Vaughan-Williams лучше выполняет главную цель классифицирующей системы для неспециалистов.
Классификация Vaughan-Williams
До конца 1960-х гг. существовало так мало антиаритмических препаратов, что необходимость в их классификации отсутствовала. Однако, когда число новых антиаритмических средств существенно возросло, были предложены несколько классификаций. Самую широкую популярность приобрела схема Vaughan-Williams.
Классификация Vaughan-Williams (табл. 2.1) доказала свою пользу, так как она группирует препараты по их основному механизму действия, то есть в соответствии с локализацией
Таблица 2.1
Классификация антиаритмических препаратов Vaughan-Williams
Класс I. Препараты, блокирующие натриевые каналы
Класс IA. Умеренное замедление проведения, умеренное удлинение потенциала действия
- Хинидин
- Прокаинамид
- Дизопирамид**
Класс IB. Минимальное замедление проведения, укорочение потенциала действия
- Лидокаин
- Мексилетин
- Токаинид**
- Фен итои н**
Класс 1C. Выраженное замедление проведения, минимальное удлинение потенциала действия
- Флекаинид**
- Энкаинид**
- Пропафенон
- Морицизин*
Класс II. (3-Блокаторы
Класс III. Препараты, блокирующие калиевые каналы (препараты, удлиняющие потенциал действия)
- Амиодарон (кордарон)
- Соталол
- Ибутилид**
- Дофетилид**
Класс IV. Препараты, блокирующие кальциевые каналы
* Моризицин не обладает таким же сродством к натриевым каналам, как другие препараты класса 1C. Поэтому некоторые относят его к классу IB. Здесь мы определили его как препарат класса 1C, чтобы подчеркнуть его проаритмический эффект (который редко наблюдается при назначении препаратов класса IB. — Прим, автора.
** Лекарственный препарат в России не зарегестрирован и аналогов нет. — Прим. ред.
связывания и блокирования каналов в мембранах сердечных клеток. Так, препараты I класса блокируют натриевые каналы клеточной мембраны (и замедляют скорость проведения), препараты II класса блокируют адренергические рецепторы (и подавляют эффект симпатической стимуляции на электро- физиологические свойства сердца), препараты III класса блокируют калиевые каналы (и увеличивают рефрактерные периоды), а препараты IV класса блокируют кальциевые каналы (и воздействуют на те области сердца, которые деполяризуются в основном посредством кальциевых каналов: СА- и АВ-узлы).
Учитывая некоторые очевидные различия препаратов I класса, классификация Vaughan-Williams разделяет их на три подгруппы. Препараты класса LA — хинидин, прокаинамид и дизопирамид — умеренно замедляют проведение (путем замедления деполяризации) и также умеренно увеличивают рефрактерные периоды (посредством удлинения потенциала действия); препараты класса IB — лидокаин, токаинид, мекси- летин и фенитоин — не замедляют проведение и уменьшают длительность потенциала действия; препараты класса 1C — флекаинид, энкаинид, пропафенон и морицизин — вызывают выраженное замедление скорости проведения, но очень незначительно удлиняют рефрактерные периоды.
Препараты в классификации Vaughan-Williams распределены согласно их основным мембранным эффектам, что облегчает использование антиаритмических средств в соответствии с их электрофизиологическими свойствами. Типичные электрофизиологические эффекты препаратов различных классов см. на рис. 2.4.
Критики классификации Vaughan-Williams отмечают, что антиаритмические средства часто оказывают смешанное действие на сердечные клетки и что препараты одной и той же группы могут, с точки зрения клинициста, проявлять себя различным образом. Наиболее важным запутывающим моментом является то, как антиаритмические препараты влияют на натриевые и калиевые каналы. На самом деле, успех классификации в большей степени обусловлен ее способностью характеризовать различные эффекты препаратов I и III классов на натриевые и калиевые каналы, а значит, на скорость проведения и рефрактерные периоды.
Например, характеристики связывания препаратов, блокирующих натриевые каналы, весьма сложны. Хотя все препараты I класса обладают свойством соединяться с натриевыми каналами, этот эффект не постоянен (то есть они не «прилипают»
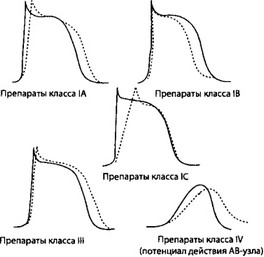
Рис. 2.4. Типичные эффекты антиаритмических препаратов различных классов на потенциал действия. Сплошной линией обозначены исходные потенциалы действия, пунктирной — изменения, вызванные антиаритмическими средствами различных классов. На рисунке отображено влияние антиаритмических препаратов классов IA, IB, 1C и III на потенциалы действия волокон Пуркинье и препаратов IV класса на потенциал действия АВ-узла
к каналу, а непрерывно связываются с ним и отсоединяются от него). Фактическая блокада натриевого канала (и поэтому замедление деполяризации) наблюдается только тогда, когда препарат связывается с открывающимся каналом. Однако многие препараты I класса связываются с натриевым каналом только после того, как он уже открылся (то есть когда он находится в «активированном» состоянии). Поэтому, для того чтобы вызвать блокаду натриевого канала, препарат I класса должен связаться с активированным каналом и затем оставаться в связанном с ним состоянии до тех пор, пока канал не начнет снова открываться (в этот момент блокада наконец произойдет). Таким образом, эффект препарата I класса на натриевый канал зависит от кинетики его связывания — от скорости, с которой препарат связывается и разъединяется с натриевым каналом (или, другими словами, эффект препарата зависит от того, насколько он «прилипает» к каналу, связываясь с ним) (рис. 2.5). Если препарат «нелипучий» и быстро разъединяется с каналом (то есть имеет быструю кинетику связывания), блокада натриевого канала может быть минимальной. Поэтому препараты с быстрой кинетикой связывания вызывают относительно малые изменения скорости проведения. Наоборот, «липучие» препараты, которые разъединяются с каналом медленно (то есть препараты имеют медленную кинетику связывания), вызывают существенную блокаду натриевых каналов, снижая таким образом скорость проведения. В целом, чем медленнее кинетика связывания препарата, блокирующего натриевые каналы, тем больший эффект он оказывает на скорость проведения.
Эффект препаратов I класса частично зависит от ситуации, что еще больше усложняет его понимание. Так, у всех препаратов I класса наблюдается зависимость эффекта от частоты, а именно: при более высоких частотах ритма степень блокады натриевых каналов увеличивается. Такая зависимость, являясь результатом кинетики связывания, отражает тот факт, что при больших частотах ритма имеется меньше времени для разъединения с натриевым каналом до начала следующего потенциала действия; поэтому при учащении ритма препараты оказывают более выраженный эффект на скорость проведения, чем при меньшей частоте. Кроме того, ишемия, гиперкалиемия и ацидоз способны замедлять кинетику связывания препаратов I класса, увеличивая тем самым их влияние на натриевые каналы. Например, лидокаин (препарат класса IB с очень быстрой кинетикой связывания, а значит, и малым эффектом на скорость проведения в нормальной ткани) может оказывать выраженное влияние на ишемизированную ткань.
В классификации Vaughan-Williams учтена кинетика связывания препаратов, блокирующих натриевые каналы. Препараты класса IB обладают очень быстрой кинетикой связывания с натриевыми каналами и, как уже отмечалось выше, оказывают относительно малое воздействие на скорость проведения. Препараты класса 1C, для которых характерна очень

Рис. 2.5. Влияние кинетики связывания («прилипчивости») препарата I класса определяет его эффект на натриевый канал. Буквами m и h (как и на рис. 2.1) отмечены ш- и h-ворота; белыми кружками — ан- тиаритмические препараты. На рисунках А-Е проиллюстрирован эффект лидокаина, препарата с быстрой кинетикой связывания. А. Лидокаин еще не связан с h-воротами. В. Когда клетка стимулируется, натриевый канал функционирует нормально. С. Однако когда h-во- рота активируются, лидокаин связывается с ними (многие препараты I класса соединяются только с соответствующим местом, находящимся в активированном состоянии, как h-ворота на данном рисунке). Однако, обладая быстрой кинетикой связывания, лидокаин достаточно скоро разъединяется с h-воротами. D. Непосредственно перед генерированием следующего потенциала действия лидокаин уже не связан. Е. Поэтому следующая активация натриевого канала протекает нормально и замедления проведения не наблюдается. На рисунках F-J продемонстрирован эффект флекаинида, препарата с медленной кинетикой связывания. На рисунках F-H представлены реакции, идентичные таковым на рисунках А-С. G. Первая активация натриевого канала в присутствии флекаинида протекает нормально.
медленная кинетика связывания, значительно замедляют скорость проведения. Кинетика связывания препаратов класса IA является промежуточной, поэтому их влияние на скорость проведения весьма умеренно. Ни одна классификация не может в полной мере четко характеризовать все нюансы связывания с натриевыми каналами для каждого препарата, однако классификация Vaughan-Williams предлагает достаточно точные обобщения свойств антиаритмических препаратов, отражающих степень их связывания с натриевыми каналами.
Правомочность классификации Vaughan-Williams тем не менее вызывает некоторые сомнения, если рассматривать эффект антиаритмических препаратов на калиевые каналы. Одной из базовых предпосылок классификации Vaughan-Williams является то, что препараты I класса связываются с натриевыми каналами, а препараты III класса — с калиевыми, но в действительности многие препараты оказывают влияние как на натриевые, так и на калиевые каналы. В результате в некоторых случаях применение классификации Vaughan-Williams становится весьма затруднительным. Так, многие специалисты до сих пор не могут прийти к соглашению, к какому классу — IB или 1C — принадлежит этмозин. (Автор поддерживает тех, кто считает, что к 1C, поскольку его самое главное клиническое свойство — это выраженная способность вызывать проаритмии, что характерно для препаратов класса 1C.) Амиодарон, согласно классификации Vaughan-Williams, имеет свойства всех четырех классов. Так что в конечном итоге решение вопроса об отнесенности отдельных препаратов к тому или
Н. Флекаинид, подобно лидокаину, впервые связывается с h-воротами сразу же после того, как они активируются. Однако, в отличие от ли- докаина, флекаинид имеет медленную кинетику связывания. I. Непосредственно перед генерированием следующего потенциала действия препарат еще соединен с h-воротами. J. Поэтому h-ворота частично закрыты, что приводит к замедлению входа натрия внутрь клетки, уменьшению наклона фазы 0 потенциала действия и снижению скорости проведения. При большей частоте ритма препараты, по механизму действия сходные с лидокаином, имеют меньше времени для разъединения, и в таких ситуациях их эффект может быть аналогичен таковому у флекаинида
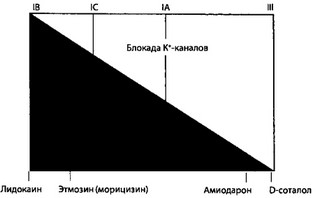
Рис. 2.6. Натрий (Na+)- и калий (К+)-блокирующие свойства анти- аритмических средств можно изобразить как континуум эффектов. Препараты класса IB рассматриваются как имеющие чистое натрий- блокирующее действие, в связи с чем располагаются в левой части координатной сетки, а препараты III класса — как имеющие чистое ка- лийблокирующее действие, в связи с чем располагаются в правой ее части. На рисунке также показаны приблизительные позиции препаратов классов 1C и IA. Антиаритмическим средствам, не совсем вписывающимся в классификацию Vaughan-Williams (например этмозин и амиодарон), соответствует свое место на координатной сетке
иному классу состоит не в строго научном обосновании, а скорее в выработке консенсуса.
Хотя система Vaughan-Williams не позволяет четко классифицировать все возможные сочетания блокады натриевых и калиевых каналов, она, тем не менее, предлагает общую схему характеристики даже для препаратов, трудно поддающихся классификации. Эта общая схема становится очевидной, если представить общее взаимодействие натрийблокирующих и калийблокирующих свойств как непрерывный континуум возможных эффектов, а не как серию дискретных эффектов (рис. 2.6). Преимущество такого подхода заключается в том, что трудно классифицируемые препараты, например этмозин и амиодарон, можно расположить в соответствующих точках вдоль данного континуума, вместо того чтобы произвольно
приписывать их к определенному классу. Проблема классификации значительно упрощается, когда на данном континууме после окончания одного класса начинается другой (то есть проблема становится делом степени, а не класса). Классификация Vaughan-Williams (по общему признанию, несовершенная) помогает расположить препараты вдоль такого континуума и тем самым прояснить электрофизиологические свойства даже тех препаратов, которые трудно формально классифицировать.
Таблица 2,2
Клинические обобщения, основанные на классификации Vaughan-Williams
|
Класс |
Локализация действия |
Общая эффектив ность |
Токсичность |
Проаритми- ческое действие |
|
IA |
аж |
2+ |
3+ |
2+ |
|
IB |
ж |
1 + |
1 + |
1 + |
|
1C |
аж |
3+ |
1 + |
3+ |
|
1! |
АВУ, ж |
1 + |
1 + |
° |
|
Ill |
аж |
2+ (амио 4+) |
1 + (амио 4+) |
2+ (амио1+) |
|
IV |
АВУ |
1 + |
1 + |
0 |
П — предсердие; Ж — желудочек; АВУ — атриовентрикулярный узел; амио — амиодарон.
Классификация Vaughan-Williams позволяет также сделать некоторые другие клинически важные обобщения относительно антиаритмических средств. Эти обобщения, суммированные в табл. 2.2, включают типы аритмий, поддающиеся лечению данным препаратом, общую эффективность, побочные эффекты, ограничивающие терапию, и риск проаритмии, обусловленный применением препаратов определенного класса. (Свойства антиаритмических средств, связанные с их принадлежностью к тому или иному классу, обсуждаются в части II данной книги.)
Источник: Фогорос Р.Н., «Антиаритмические средства. Изд. 2-е.» 2009