Биохимические системы обезвреживания токсических мутагенных и канцерогенных веществ
Постоянно функционируют и биохимические системы защиты организма. Например, в крови имеются в небольших количествах различные физиологические активные вещества (желчные кислоты и т. д.), проникновению которых в мозг препятствует гематоэнцефалический барьер. Если желчные пигменты все же проникают в мозг (это бывает, например, при желтухе новорожденных), они оказывают на него токсическое действие.
В экстремальных условиях функции "физиологических мер защиты" (И. П. Павлов) проявляются более отчетливо. Но наряду с этим те же функции могут стать препятствием для лечения патологического процесса, изолируя орган от медикаментозных средств, например, мешая проникновению в инфицированный орган антибиотиков или других антибактериальных или противовирусных препаратов.
И при анализе биохимических систем внутренней защиты можно увидеть закономерность, которую мы видели раньше, говоря о проблеме физиологических систем защиты. Тогда была подчеркнута тесная связь регуляторных и защитных функций этих систем. Например, одним из важнейших нейромедиаторов является ацетилхолин — медиатор парасимпатического отдела вегетативной нервной системы. После выполнения своей функции (передачи нервного импульса) часть молекул ацетилхолина должна быть разрушена, иначе его постоянное образование с участием синтезирующего фермента — холинацетилтрансферазы приведет к накоплению его в больших количествах в нервных окончаниях и к поступлению его в нефизиологических количествах в кровь. Это нарушит нейрогуморальную регуляцию в организме. Защиту от такого нарушения осуществляет фермент холинэстераза, разрушающая ацетилхолин.
Но часть ацетилхолина все же попадает в кровь, и хотя небольшое его количество необходимо для гуморальной регуляции функции, накопление его в крови очень опасно.
Но организм обезопасил себя, вероятно, еще одной линией защиты от избытка ацетилхолина в крови. По данным Г. Н. Кассиля с сотрудниками, такую защиту осуществляют эритроциты, связывающие и тем самым обезвреживающие ацетилхолин. В уже цитированной книге этого автора проводится интересный анализ, свидетельствующий о существовании целого ряда уровней защиты организма от гистамина — физиологически очень активного вещества, постоянно вырабатываемого в организме и участвующего в регуляции деятельности некоторых органов. Однако если гистамин в крови человека начинает накапливаться, это вызывает нарушение различных функций. Избыточное образование в организме гистамина (или
недостаточная защита от него!) может иметь значение в патогенезе таких широко распространенных заболеваний, как язвенная болезнь желудка или аллергия.
Приведенные примеры можно было бы продолжить, но и сказанного достаточно для того, чтобы представление И. П. Павлова о "физиологических мерах защиты" распространить на область биохимии.
Существует и специальная биохимическая система защиты от чужеродных веществ (ксенобиотиков), обладающих токсическими, мутагенными или канцерогенными свойствами. Эта барьерно-химическая защита особенно сильна в печени: с помощью ее обезвреживается большая часть поступающих в организм ксенобиотиков.
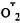 Важным элементом этой защиты являются гемсодержащие белки цитохром Р-450. Эта группа белков названа так вследствие того, что в восстановленной форме она в комплексе с окисью углерода имеет спектр поглощения с максимумом при 450 нм или вблизи этой полосы. Цитохром Р-450 — это общее название серии гемпротеидов, относимых к классу гидроксилаз, т. е. белков, участвующих в гидроксилировании поступающих в клетку веществ (или образуемых в ней или в других клетках стероидов и некоторых других метаболитов). При функционировании этих гидроксилаз (их называют еще монооксигеназами, так как они осуществляют включение только одного атома кислорода) происходит транспорт электронов по сложной цепи переносчиков, в результате чего восстанавливаются ионы железа, входящие в комплекс субстрата с цитохромом Р-450. В результате Fe3+ восстанавливается в Fe2+, а затем к последнему присоединяется О2. Тогда из внутриклеточной цепи переноса электронов "прибывает" еще один
Важным элементом этой защиты являются гемсодержащие белки цитохром Р-450. Эта группа белков названа так вследствие того, что в восстановленной форме она в комплексе с окисью углерода имеет спектр поглощения с максимумом при 450 нм или вблизи этой полосы. Цитохром Р-450 — это общее название серии гемпротеидов, относимых к классу гидроксилаз, т. е. белков, участвующих в гидроксилировании поступающих в клетку веществ (или образуемых в ней или в других клетках стероидов и некоторых других метаболитов). При функционировании этих гидроксилаз (их называют еще монооксигеназами, так как они осуществляют включение только одного атома кислорода) происходит транспорт электронов по сложной цепи переносчиков, в результате чего восстанавливаются ионы железа, входящие в комплекс субстрата с цитохромом Р-450. В результате Fe3+ восстанавливается в Fe2+, а затем к последнему присоединяется О2. Тогда из внутриклеточной цепи переноса электронов "прибывает" еще один
2-
электрон, после чего координационно связанный кислород или О2
цитохром Р-450 освобождается в состоянии, содержащем Fe3+.
атакует субстрат, а
Все исследованные до сих пор формы цитохрома Р-450 печени млекопитающих прочно связаны с мембранами эндоплазматического ретикулума (микросомами). Под влиянием различных ксенобиотиков концентрация этих белков резко возрастает. Такой процесс индукции происходит и под влиянием синтетических лекарств, также являющихся, как правило (к сожалению), чужеродными для организма. Например, после введения фенобарбитала гидроксилазная активность в печени возрастает примерно в 20 раз. Из важнейших свойств рассматриваемой биохимической системы отметим еще одно, касающееся механизмов ее действия, а именно превращение ксенобиотика из трудно в легко экскретируемую форму.
Как мы уже видели, такая работа сопровождается образованием
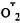 , являющегося, как мы теперь знаем, индуктором переокисления липидов и генотоксическим агентом.
, являющегося, как мы теперь знаем, индуктором переокисления липидов и генотоксическим агентом.
Рассматривая биологическую роль активных форм кислорода, мы подчеркнули и его участие в разрушении макрофагами бактерий. Таким образом, прослеживается практически одинаковая зависимость функционирования систем защиты от, казалось бы, столь разных факторов: химических чужеродных веществ или чужеродных бактерий.
Мы обсудили защитную функцию Р-450. Но драматический парадокс состоит в том, что Р-450 может не только обезвреживать потенциально канцерогенные вещества, но и катализировать их превращение в активные канцерогены. Например, 3-метилхолантрен, который содержится в выхлопных газах транспортных средств, индуцирует такую форму цитохрома Р-450, которая путем гидроксилирования этого полициклического углеводорода превращает его в сильный канцероген. Таким образом, мы опять приходим к парадоксальному заключению: защитная система оказывается и потенциально опасной, причем опасность эта скрытая.
Но все же регуляция ее возможна. Так, известно, что цитохром Р-450, индуцируемый барбитуратами, отличается от соответствующего белка, индуцируемого 3-метилхолентреном.
Теперь, имея представление о важнейших свойствах биохимической системы защиты,
рассмотрим вкратце, как она изменяется при старении организма. Общее количество микросом (1 мг белка в расчете на 1 г массы ткани) в процессе старения крыс уменьшается. Изменение функциональной способности оксидазной системы микросом печени может быть обусловлено также уменьшением текучести липидного бислоя мембран микросом. О том, что физико- химическое изменение мембран происходит, свидетельствует изменение спектров электронного парамагнитного резонанса спиновой метки, растворимой в липидной фазе.
Дуглас Шмуклер и Роза Уонг из отдела биологии старения клетки медицинского центра и центра анатомии печени Калифорнийского университета исследовали активность системы НАДРН-цитохрома с — Р-450 — редуктазы микросом печени крыс 3, 9 и 27 месяцев. Оказалось, что удельная активность последнего фермента, как связанного, так и не связанного с мембранами микросом, наибольшая у 3- и 9-месячных крыс.
Поскольку содержание цитохрома Р-450 может возрастать при воздействии на организм токсических веществ большое значение имеет не только исходный уровень его активности, но и способность клеток к индуцированному синтезу такого белка. Добавки в пищу определенных сорбентов приводили к увеличению продолжительности жизни крыс на 30–40 %. Хотя содержание цитохрома Р-450 в их печени уменьшалось, потенциальная активность ферментных систем, обезвреживающих токсические вещества, существенно возрастала.
На основе этих данных можно полагать, что цитохром Р-450 участвует в обезвреживании не только токсических веществ, которые поступают извне, но и эндогенных токсических факторов. Иными словами, исходя из анализа биологических основ старения, мы можем предположительно находить новые грани работы биохимических систем. Что же касается самой идеи значения эндогенных токсических факторов в старении, то ее можно рассматривать как естественное продолжение представления И. И. Мечникова о роли токсинов. Правда, он имел в виду "токсины", синтезируемые не клетками организма, а живущими в его кишечнике микроорганизмами. Но ведь микроорганизмы, рассматривавшиеся И. И. Мечниковым, были не патогенными, а постоянно находящимися в организме. Во всяком случае, становится ясным, что в пожилом и старческом возрасте из-за снижения защитных возможностей даже эндогенная интоксикация организма может нарушать те или иные его функции путем усиления молекулярных механизмов деструкции: генома, полирибосом, мембран или "энергетических станций" клетки.
Тот же факт, что при старении уменьшается способность к индуцируемому синтезу микросомальных защитных ферментов, подтверждает общие закономерности, которые мы выявили ранее (см. главу II) при анализе других биологических основ старения: во-первых, то, что один из характерных признаков старения — снижение не только (и даже не столько) уровня функциональной активности клетки, органа или организма, сколько функциональной способности их, и, во-вторых, что в процессе, старения уменьшается способность клеток к индуцируемому синтезу по крайней мере некоторых белков. — Однако данные, полученные при экспериментальном исследовании печени грызунов, следует с осторожностью переносить на людей. Ведь такие данные позволяют делать лишь предположительные заключения об изменении защитной функции печени при старении всех млекопитающих. Так, один из основных результатов исследований рассматриваемой защитной системы состоит в том, что активность большинства ферментов микросом печени, участвующих в метаболизме чужеродных веществ, в частности лекарств, уменьшается с возрастом. Но значительны такие изменения лишь в печени самцов крыс, а не самок. В изолированных гепатоцитах печени самцов крыс обнаружено значительное снижение активности монооксигеназной системы, участвующей в метаболизме ксенобиотиков. Даже у мышей закономерности возрастных и половых различий ферментов, участвующих в таком метаболизме, отличаются от закономерностей, наблюдаемых у
крыс. Правда, как правило, при старении всех исследованных грызунов наблюдается снижение с возрастом способности организма экскретировать с желчью неметаболизируемые печенью ксенобиотики и содержания в микросомах печени цитохрома Р-450.
Следовательно, можно предположить, что окислительный метаболизм ксенобиотиков, в частности лекарств, при старении млекопитающих, как правило, уменьшается. Если такая закономерность верна и для человека, то нужно предвидеть, что печень и организм в целом пожилого и тем более старого человека более чувствительны к токсическому действию факторов, загрязняющих окружающую среду, а также к побочному (токсическому) действию лекарств.
Неожиданными являются данные о половых различиях изменений у крыс активности ферментов микросом при старении. То, что такие изменения наблюдаются преимущественно у самцов, "соблазнительно" связать с известной закономерностью: ведь у млекопитающих вообще (включая человека) продолжительность жизни самцов обычно меньше, чем самок. Однако вопрос о том, какой "вклад" в это различие вносят половые особенности старения ферментов монооксигеназной системы клеток печени и всей печени в целом, пока может быть только поставлен.
Мы видим, что система защитных механизмов сложна и разнообразна, однако в организации и работе этой системы прослеживается систематичность. Прежде всего это касается взаимосвязи механизмов защиты на различных уровнях организации. Так, рассматривая физиологические механизмы защиты, мы пришли к заключению, что они взаимосвязаны с молекулярными (внутриклеточными) механизмами самозащиты, а последние представляют лишь часть глубинных ее эшелонов. Можно даже отметить однонаправленность физиологических и молекулярных механизмов защиты. Например, мы теперь понимаем, что в крови содержатся эндогенные, генотоксические вещества, от которых так же, как и от содержащихся в окружающей среде генотоксических факторов, нервные клетки головного мозга должны быть надежно защищены.
Сегодня мы можем расшифровать уже цитированное нами предвидение Стефана Цвейга: "Наш мозг… так хрупок, так сложен, что достаточно задетого сосудика… малейшего изменения какой-нибудь молекулы, чтобы нарушить высшую всеобъемлющую гармонию человеческого ума". Такая молекула теперь известна. Это ДНК, "малейшее изменение" которой может нарушить структуру жизненно важного белка и, следовательно, функцию нервной клетки.
Но если функции гематоэнцефалического барьера будут нарушены, то снизить уязвимость ДНК могут еще молекулярные системы обороны, включая механизмы репарации ДНК. Защиту же ДНК половых клеток осуществляют наряду с последними и гистогематические барьеры, а мужских половых клеток — гематотестикулярный.
Существуют и другие различные биологические барьеры для мутагенных и канцерогенных веществ. Например, чужеродные вещества, содержащиеся в окружающей среде и обладающие мутагенными свойствами, могут нейтрализоваться факторами, содержащимися в слюне. Известно также, что активность такого сильного мутагена, как N-метил-N?-нитро-N- нитрозогуанидана при попадании в кровь млекопитающих резко снижается. Ну а роль кожных покровов в предохранении организма от факторов, загрязняющих окружающую среду, известна каждому.
При сравнении молекулярных механизмов (биохимических) и клеточных защитных систем обнаруживается столь сильное сходство, что это не может не привести к мысли об общности их происхождения. Например, выше мы пришли к заключению, что в работе микросомальных гидроксилаз, защищающих организм от токсических и канцерогенных чужеродных веществ, и в функции макрофагов, защищающих организм от микробов, значение имеет образование
супероксидного радикала.
Мы ограничили наш анализ защитных механизмов лишь животными организмами. Но ведь и растения имеют защитные механизмы, в частности, определяющие их устойчивость к патогенным для растений вирусам и грибкам. Есть основания полагать, что одно из звеньев этой системы обороны — выработка активных форм кислорода клетками растений с целью поражения этим химическим оружием патогенных для них биологических систем. Но клетки и животных, и растений, вырабатывая активные формы кислорода, неизбежно повреждают собственные структуры, включая генетические (о чем подробно было рассказано ранее), а также структуры других клеток. ДНКазы, участвуя в репарации ДНК, также неизбежно повреждают и здоровые участки генома и т. д.
 Таким образом, работа защитных механизмов, направленная против вредных для клеток и организма воздействий, сама, оказывается, имеет "вредный" компонент. Становится ясным, что длительность существования клеток и организмов должна зависеть от соотношения благотворной функции и вредных последствий работы этих механизмов. Несовершенство
Таким образом, работа защитных механизмов, направленная против вредных для клеток и организма воздействий, сама, оказывается, имеет "вредный" компонент. Становится ясным, что длительность существования клеток и организмов должна зависеть от соотношения благотворной функции и вредных последствий работы этих механизмов. Несовершенство
систем защиты генетических и других структур клетки от радикалов ОН·, , от Н2О2, перекисей липидов и других эндогенно-образуемых потенциально вредных факторов служит одной из основных причин накопления с возрастом повреждений в ДНК, липофусцина — в цитоплазме, межмолекулярных сшивок — в межклеточном веществе.
Несовершенство систем репарации ДНК состоит не только в том, что часть повреждений "ускользает" от ре-парирующих ферментов, но и в том, что эти же ферменты могут функционировать с ошибками, тем самым усиливая повреждения и становясь механизмом не защиты, а развития болезни.
Лишь имея это в виду, можно понять и следующую, казалось бы, парадоксальную закономерность в организации различных млекопитающих. Активность ферментов цитохрома Р-450 тем больше, чем меньше их видовая продолжительность жизни. Эти ферменты участвуют в метаболизме не только чужеродных веществ (о чем было рассказано ранее), но и стероидных гормонов, причем и в процессе таких биохимических превращений могут образовываться свободные радикалы. Эти вещества, содержащие неспаренные электроны и потому обладающие высокой реакционной способностью, также могут повреждать и ДНК, и другие структуры клетки и разрушать межклеточное вещество. Таким образом, защитные биохимические системы участвует и в нормальном метаболизме; причем в результате этого могут происходить "побочные" биохимические процессы, отдаленным последствием которых может быть снижение жизнеспособности организма и увеличение его предрасположенности к болезням.
Следовательно, при обобщении основного из сказанного до сих пор о механизмах старения логичен вывод: снижение функциональной способности с возрастом можно связать с отмеченным несовершенством функции защитных систем и тем, что это несовершенство в процессе старения усиливается, т. е. эффективность работы защитных систем ухудшается.
Кроме того, со снижением эффективности работы защитных систем связан, вероятно, и другой класс свойств организма, неизбежно сопровождающий старение, — увеличение предрасположенности к болезням.
А так же в разделе «Биохимические системы обезвреживания токсических мутагенных и канцерогенных веществ »
- Механизмы молекулярной самозащиты клетки. Системы репарации ДНК
- Антиоксидантные системы самозащиты клетки
- Клеточные системы защиты целостного организма и отдельных его систем
- Глава V Старение и связанные с ним болезни
- Глава VI Зависимость продолжительности жизни от генетических факторов
- Глава VII Биологические аспекты проблемы здорового образа жизни