ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ПОДАГРЫ
Этиология. Детерминирующим фактором риска развития подагры является содержание уратов в плазме. Под гиперурикемией понимают концентрацию ура- тов в сыворотке выше 7,0 мг/дл (или 0,42 ммоль/л) у мужчин и выше 6,0 мг/дл (или 0,36 ммоль/л) у женщин.
Значительная агрегация подагры и гиперурикемии у родственников свидетельствует о значении генетических факторов в предрасположенности к этому забо
леванию. Так, например, в Японии описано шесть поколений японской семьи с подагрическим артритом и прогрессирующей нефропатией (Yokota N. [et al.j, 1991). Имеются сведения о существовании слабой ассоциации подагры с HLA-B14 (В. Casstum [et al.], 1994).
Используя молекулярно-генетические методы исследования, было выявлено ингибирование репаративного синтеза ДНК при воздействии мутагенов УФ-типа у больных подагрой. Выявленные изменения сохранялись в перевиваемых клеточных линиях фибробластов у пациентов с нарушением пуринового обмена. В подтверждение роли генетических факторов при подагре можно привести и данные NicklasJ., который показал, что ген, ответственный за гипоксантин-гуа- нин-фосфорибозилтрансферазу, находится на длинном рукаве Х-хромосомы (Xq 26).
Запасы мочевой кислоты в организме в норме составляют 1000 мг при скорости их обновления в пределах 650 мг/сут. Нарушение обмена пуринов может приводить к повышению уровня мочевой кислоты в крови. Источником образования мочевой кислоты в организме являются пуриновые соединения, поступающие с пищей, а также образующиеся в организме в процессе обмена нуклеотидов (схема 5).
Метаболизм пуриновых оснований регулируется несколькими ферментами. В настоящее время доказано наличие двух ферментативных дефектов, сопровождающихся усилением синтеза мочевой кислоты и развитием подагры в детском или подростковом возрасте. Речь идет о дефиците гипоксантингуанинфос- форибозилтрансферазы (ГГФТ) и повышенной активности фосфорибозилпиро- фосфатсинтетазы (ФРПФ-синтетаза). Данные ферменты контролируются
Рибозо-5-фосфат + АТФ
| ¦lt;- фРПФ-синтетаза 5-фосфорибозил-1 -пирофосфат (фРПф) + глутамин
+ ¦+- ФРПФ-аминотрансфераза 5-фосфорибозиламим
I
Последующие этапы биосинтеза пуринов (включая инкорпорацию глицина,
двуокиси углерода, аспартата)
Н у кле оп роте и н Ну кпеоп роте и н
Гл х ; hi Инозиноиан кислое —Аденинооан кисло i а
Гуаниноваякислота , * , . , , ^ .
7 . (гипоксантинрибозофосфат) (аденинрибозофосфат)
Гушюуип Инозин |
(гуанинрибоза) ггЛг \^Лгипоксантинрибоза} Аденозин
i ГГФТ -+¦ | {аденинрибоза)
Гуанин Гипоксантин $ м АТФ
Ксантиноксидаза | Дценин
Ксантин
t
Мочевая кислота
Схема 5. Метаболизм пуриновых нуклеотидов. ГГФТ — гипоксантингуанинфосфорибозил- трансфераза; АФТ — аденинфосфорибозилтрансфераза; АТФ — аденозинтрифосфаг,
ФРПФ — фосфорибозилпирофосфат
генами, связанными с Х-хромосомой. Повышенное внутриклеточное разрушение АТФ (с образованием большого количества аденина), наблюдаемое при врожденных (гликогенозы, непереносимость фруктозы) и приобретенных заболеваниях и состояниях (гипоксемия, физическая нагрузка, злоупотребление алкоголем), также может приводить к гиперурикемии. Полный дефицит ГГФТ наряду с развитием подагрического артрита приводит к выраженным психоневрологическим нарушениям: умственной отсталости, аутоагрессивности, хореоате- тозу. Данный симптомокомплекс получил название синдрома Леша — Найхана.
В норме процессы синтеза мочевой кислоты и ее выделения сбалансированы. Но при каком-либо нарушении этого процесса повышается содержание мочевой кислоты в сыворотке крови: развивается гиперурикемия.
Подробный перечень факторов, способствующих гиперурикемии, приводит в своей работе Дж. Скотт (1990):
- факторы, обусловливающие повышенное образование мочевой кислоты:
- специфические ферментные дефекты;
- снижение активности гипоксантингуанинфосфорибозилтрансферазы;
- повышение активности фосфорибозилпирофосфатсинтетазы;
- усиление обмена нуклеотидов;
- характер питания и др.;
- факторы, обусловливающие замедление выведения мочевой кислоты:
- нарушение функции почек;
- лекарственные препараты;
- накопление кетоновых соединений;
- артериальная гипертензия;
- другие факторы:
- раса;
- пол;
- возраст;
- нарушение липидного обмена;
- алкоголь.
Патогенез. Процессы отложения солей мочевой кислоты в тканях определяют клинические проявления подагры. Механизм отложения уратов до конца не выяснен. Определенное значение имеет недостаточная васкуляризация тканей, что подтверждается преимущественным отложением уратов в сухожилиях и хрящах. К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру и наличие субстанций, удерживающих ураты в жидкости, — протеогликанов. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов. что способствует их кристаллизации.
Большое значение для кристаллизации мочевой кислоты имеет и pH сыворотки крови. Доказано, что полное растворение солей мочевой кислоты происходит при pH = 12,0-13,0, что невозможно in vivo. Растворимость уратов зависит от температуры окружающей среды: переохлаждение периферических суставов способствует кристаллизации уратов и образованию микротофусов.
Образование кристаллов уратов натрия рассматривается как основной патологический процесс при подагрическом артрите. К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру и присутствие или отсутствие субстанций, удерживающих ураты в жидкости, главным образом протеогликанов. Концентрация уратов в синовиальной жидко-
сти, как правило, близка к их плазменному и тканевому содержанию, но может нарастать, если в силу каких-то причин содержание воды, например в суставе, уменьшается. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов, что, в свою очередь, способствует их кристаллизации. Предполагается, что на последний процесс влияет и концентрация других катионов, таких как кальций и натрий.
Одновременно в результате метаболической активности нейтрофилов в синовиальной жидкости происходит снижение pH, что ведет к дальнейшему осаждению кристаллов уратов. Наиболее ярким проявлением этого процесса является острый подагрический артрит.
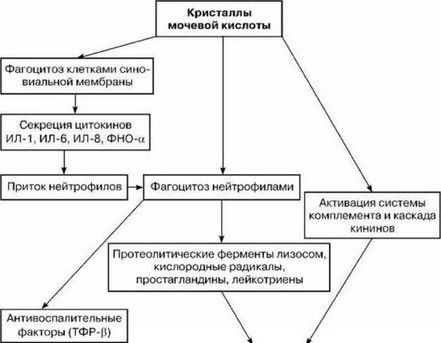
Еще в 1961 г. D. McCarty и J. Hollander установили, что острый приступ артрита развивается вследствие выпадения микрокристаллов урата натрия в полость сустава. М. Cohen и В. Emmerson (1994) полагают, что острая атака подагры ассоциируется с образованием кристаллов, а не с выходом последних из ранее образованных депозитов в субсиновии. Кристаллы уратов способны инициировать интенсивную атаку острого воспаления, так как обладают способностью стимулировать высвобождение различных медиаторов воспаления, таких как С5а, брадикинин, а также ИЛ-1, ИЛ-6 и ИЛ-8, ФНО и кислородные радикалы (схема 6).
Воспаление
Именно эти цитокины провоцируют приток нейтрофилов в полость сустава. Описывая воспалительную реакцию при подагре, авторы подчеркивают, что кристаллы, покрытые протеином (IgG), через реакцию с Fc-рецепторами на поверхности клеток обеспечивают фагоцитоз с образованием фаголизосом. Фаголизосо- мальные энзимы удаляют IgG с поверхности кристаллов, а водородные соединения индуцируют лизис мембран. В результате высвобождаются протеолитические ферменты лизосом, происходит секреция радикалов кислорода, простагландинов, лей- котриенов и других медиаторов воспаления. Кристаллы уратов являются активаторами комплемента, они активируют фактор Хагемана и каскад кининов.
Таким образом, активация калликреиновой и кининовой систем, увеличение проницаемости сосудистой стенки, активация системы комплемента, усиливая хемотаксис лейкоцитов к кристаллам уратов, поддерживают воспалительный процесс. В очаге воспаления снижается pH среды, что способствует еще большей кристаллизации уратов. Создается патогенетический порочный круг.
Причины, самоограничивающие течение острого подагрического артрита, до конца не ясны, но, вероятно, связаны с синтезом «антивоспалительных» медиаторов (рецепторный антагонист ИЛ-1, ТФР-р).
Патоморфология. Отложения уратов выявляются преимущественно в тканях суставов (синовиальной мембране, хряще, эпифизах костей, капсуле), околосуставных тканях (сухожилиях, связках). Гистопатологические изменения, наблюдаемые в синовиальной оболочке, включают отложения фибрина, пролиферацию синовиальных клеток и выраженную инфильтрацию нейтрофильными лейкоцитами.
Острый подагрический артрит характеризуется наличием кристаллов уратов в поверхностном слое синовиальной мембраны. Уратные кристаллы при остром артрите, как правило, находятся внутри фагоцитирующих клеток синовиальной жидкости; в составе клеточных инфильтратов преобладают нейтрофилы.
При хронической подагре поражение суставов характеризуется значительной деструкцией хряща, изменениями сухожилий, связок и синовиальных сумок, нередко выявляется и субхондральное нарушение целостности кости. При этой форме подагры происходит образование тофусов и поражение внутренних органов.
В тофусах отмечается большое скопление кристаллов уратов, окруженное гранулематозной тканью, в составе которой обнаруживаются гигантские гранулематозные многоядерные клетки. С течением времени тофусы могут кальцифицироваться, оссифицироваться.
Среди внутренних органов наиболее выраженные изменения наблюдаются в почках. Отложения уратов обнаруживают в интерстициальной ткани, в клубочках, в просвете канальцев и их стенках, в чашечках и лоханках. В интерстиции выявляется гигантоклеточная и лейкоцитарная воспалительная реакция. Изменения в клубочках (утолщение петель капилляров, умеренные клеточные инфильтраты преимущественно на периферии петель) непосредственно не связаны с отложением уратов, а являются вторичными. Возможно увеличение мезангиаль- ного матрикса, реже наблюдается мезангиальная пролиферация. В сосудах встречаются изменения типа артерио- и артериолосклероза, которые коррелируют с выраженностью тубулярной атрофии.
Несмотря на то что увеличение уровня мочевой кислоты является фактором риска, у многих больных с выраженной гиперурикемией подагра не развивается. Следовательно, в развитии подагры наряду с гиперурикемией имеют значение и другие факторы, требующие дальнейшего изучения.
Источник: В. И. Мазуров, «Болезни суставов : руководство для врачей» 2008