В естественных условиях клетки миокарда находятся в состоянии ритмической активности (возбуждения), поэтому об их потенциале покоя можно говорить лишь условно. У большинства клеток он составляет около 90 мВ и определяется почти целиком концентрационным градиентом ионов К*.
Потенциалы действия (ПД), зарегистрированные в разных отделах сердца при помощи внутриклеточных микроэлектродов, существенно различаются по форме, амплитуде и длительности (рис. 7.3, А). На рис. 7.3, Б схематически показан ПД одиночной
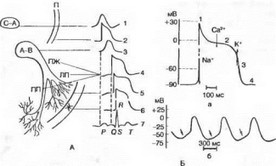
Рис. 7.3. Различные типы потенциалов действия сердечных клеток, коррелированные с временным ходом ЭКГ.
А — конфигурация потенциалов действия кардиомиоцитов различных отделов сердца; С—А — синоатриальный узел; П — предсердие; А—В — предсердно-желудочковый (атриовентрикулярный) узел; ПЖ — предсердно-желудочковый пучок (пучок Гиса); ПП и ЛП — правая и левая ножки пучка; Ж — желудочки. I—6 — потенциалы действия клеток миокарда; 7 — ЭКГ; Б — потенциал действия одиночной клетки миокарда; а — ПД желудочка. Стрелками показаны преобладающие потоки ионов Na , Са , К , ответственные за различные фазы (1—4) ПД; б — авторитмическав активность синусно-предсердного (синоатриального) узла. Стрелками показана медленная диастолическая деполяризация.
клетки миокарда желудочка. Для возникновения этого потенциала потребовалось деполяризовать мембрану на 30 мВ. В ПД различают следующие фазы: быструю начальную деполяризацию — фаза 1; медленную реполяризацию, так называемое плато — фаза 2; быструю реполяризацию — фаза 3; фазу покоя — фаза 4.
Фаза 1 в клетках миокарда предсердий, сердечных проводящих миоцитов (волокна Пуркинье) и миокарда желудочков имеет ту же природу, что и восходящая фаза ПД нервных и скелетных мышечных волокон — она обусловлена повышением натриевой проницаемости, т. е. активацией быстрых натриевых каналов клеточной мембраны. Во время пика ПД происходит изменение знака мембранного потенциала (с —90 до +30 мВ).
Деполяризация мембраны вызывает активацию медленных на- трий-кальциевых каналов. Поток ионов Са2* внутрь клетки по этим каналам приводит к развитию плато ПД (фаза 2). В период плато натриевые каналы инактивируются и клетка переходит в состояние абсолютной рефрактерности. Одновременно происходит активация калиевых каналов. Выходящий из клетки поток ионов К* обеспечивает быструю реполяризацию мембраны (фаза 3), во время которой кальциевые каналы закрываются, что ускоряет процесс реполяризации (поскольку падает входящий кальциевый ток, деполяризующий мембрану).
Реполяризация мембраны вызывает постепенное закрывание калиевых и реактивацию натриевых каналов. В результате возбуди-
мость миокардиальной клетки восстанавливается — это период так называемой относительной рефрактерности.
В клетках рабочего миокарда (предсердия, желудочки) мембранный потенциал (в интервалах между следующими друг за другом ПД) поддерживается на более или менее постоянном уровне. Однако в клетках синусно-предсердного узла, выполняющего роль водителя ритма сердца, наблюдается спонтанная диастолическая деполяризация (фаза 4), при достижении критического уровня которой (примерно —50 мВ) возникает новый ПД (см. рис. 7.3, Б). На этом механизме основана авторитмическая активность указанных сердечных клеток. Биологическая активность этих клеток имеет и другие важные особенности: 1) малую крутизну подъема ПД; 2) медленную реполяризацию (фаза 2), плавно переходящую в фазу быстрой реполяризации (фаза 3), во время которой мембранный потенциал достигает уровня —60 мВ (вместо —90 мВ в рабочем миокарде), после чего вновь начинается фаза медленной диастолической деполяризации. Сходные черты имеет электрическая активность клеток предсердно-желудочкового узла, однако скорость спонтанной диастолической деполяризации у них значительно ниже, чем у клеток синусно-предсердного узла, соответственно ритм их потенциальной автоматической активности меньше.
Ионные механизмы генерации электрических потенциалов в клетках водителя ритма полностью не расшифрованы. Установлено, что в развитии медленной диастолической деполяризации и медленной восходящей фазы ПД клеток синусно-предсердного узла ведущую роль играют кальциевые каналы. Они проницаемы не только для ионов Са2*, но и для ионов Na+. Быстрые натриевые каналы не принимают участия в генерации ПД этих клеток.
Скорость развития медленной диастолической деполяризации регулируется автономной (вегетативной) нервной системой. В случае влияния симпатической части медиатор норадреналин активирует медленные кальциевые каналы, вследствие чего скорость диастолической деполяризации увеличивается и ритм спонтанной активности возрастает. В случае влияния парасимпатической части медиатор АХ повышает калиевую проницаемость мембраны, что замедляет развитие диастолической деполяризации или прекращает ее, а также гиперполяризует мембрану. По этой причине происходит урежение ритма или прекращение автоматии.
Способность клеток миокарда в течение жизни человека находиться в состоянии непрерывной ритмической активности обеспечивается эффективной работой ионных насосов этих клеток. В период диастолы из клетки выводятся ионы Na*, а в клетку возвращаются ионы К*. Ионы Са2\ проникшие в цитоплазму, поглощаются эндоплазматической сетью. Ухудшение кровоснабжения миокарда (ишемия) ведет к обеднению запасов АТФ и креатинфосфата в миокардиальных клетках; работа насосов нарушается, вследствие чего уменьшается электрическая и механическая активность миокардиальных клеток.
