А. Химический состав плазмолеммы
- Липиды: фосфолипиды, сфинголипиды, холестерин,
а. Фосфолипиды. Молекула фосфолипида состоит из полярной (гидрофильной) части (головка) и аполярного (гидрофобного) двойного углеводородного хвоста. В водной фазе молекулы фосфолипидов автоматически агрегируют хвост к хвосту, формируя каркас биологической мембраны (рис. 2-1) в виде двойного слоя (бислой). Таким образом, в мембране хвосты фосфолипидов направлены внутрь бислоя, а головки
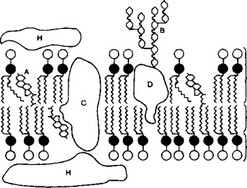
Рис. 2-1. Компоненты плазматической мембраны. А — холестерин; В — олигосахарид в составе гликопротеина на наружной поверхности; ChD- интегральные белки; E — молекулы фосфолипидов; F — хвосты жирных кислот в составе фосфолипидов; G — полярные головки фосфолипидов; H — периферический белок [из Poulsen DF, 1993]
обращены кнаружи. В ЭМ мембрана выглядит как трёхслойная структура. Гидрофильные наружный и внутренний слои электроноплотные (тёмные), а гидрофобный средний слой светлый Это объясняется тем, что тетраоксид осмия, используемый для контрастирования, связывается с гидрофильными головками фосфолипидного бислоя, а также с встроенными в мембрану белками.
- Проницаемость мембраны. Гидрофобный характер сердцевины бислоя определяет возможность (или невозможность) непосредственного проникновения через мембрану различных с физико-химической точки зрения веществ.
(а) Неполярные вещества (например, холестерин и его производные) свободно проникают через биологические мембраны. По этой причине эндоцитоз (см. I В 3) и экзоцитоз (см. I В 4) полярных соединений (например, пептидных гормонов) происходят при помощи мембранных пузырьков, а секреция стероидных гормонов — без участия таких пузырьков. По этой же причине рецепторы неполярных молекул (например, стероидных гормонов) расположены внутри клетки.
(б) Полярные вещества (например, белки и ионы) не могут проникать через биологические мембраны. Именно поэтому рецепторы полярных молекул (например, пептидных гормонов) встроены в плазматическую мембрану, а передачу сигнала к другим клеточным комнартментам осуществляют вторые посредники. По этой же причине трансмембранный перенос полярных соединений осуществляют специальные системы, встроенные в биологические мембраны \см. I В I б (I)].
- Арахидоновая кислота. Из мембранных фосфолипидов освобождается арахи- доновая кислота — предшественник простагландинов, тромбоксанов, лейкотрие- нов и ряда других биологически активных веществ с множеством функций (медиаторы воспаления, вазоактивные факторы, вторые посредники и др.).
- Липосомы — искусственно приготовленные из фосфолипидов мембранные пузырьки диаметром от 25 нм до I мкм. Липосомы используют как модели биологических мембран, а также для введения внутрь клетки различных веществ (например, генов, лекарственных препаратов); последнее обстоятельство основано на том, что мембранные структуры (в т.н. и липосомы) легко сливаются (за счёт фосфолипидного бислоя).
б. Сфинголипиды — липиды, содержащие основание с длинной цепью (сфингозин или сходную с ним группу); сфинголипиды в значительном количестве находятся в миелиновых оболочках нервных волокон, слоёв модифицированной плазмолеммы шванновских клеток и олигодендроглиоцитов ЦНС.
Сфинголипидозы — различные болезни, характеризующиеся аномальным метаболизмом сфинголипидов.
Церебральный сфинголипидоз — общее наименование группы наследственных заболеваний, характеризующихся мышечным гипертонусом, прогрессирующим спастическим параличом, потерей зрения (обычно с центральной дегенерацией сетчатки и атрофией зрительного нерва), судорогами и умственными дефектами; сочетается с аномальным отложением сфингомиелина и родственных липидов.
в. Холестерин (рис. 9-21). Этот стероид имеет чрезвычайно важное значение не только как компонент биологических мембран.
- Стероидные гормоны. На основе холестерина происходит синтез стероидных гормонов — половых, глюкокортикоидов, минералокортикоидов.
- Липопротеины. Холестерин циркулирует во внутренней среде организма в составе липопротеинов. Транспорт холестерина осуществляют липопротеины низкой плотности (ЛНП), очень низкой плотности (ЛОНП) и липопротеины высокой плотности (ЛВП). Вероятность атеросклеротического поражения сосудов (в т.ч. ишемическая болезнь сердца — ИБС) прямо пропорциональна уровню общего холестерина сыворотки крови. Чем выраженнее гиперхолестеринемия (точнее, отношение содержания холестерина в ЛНП к содержанию холестерина в ЛВП), тем выше риск развития ИБС.
(а) При отношении ЛНП к ЛВП более 5:1 риск развития ИБС очень высок.
(б) Высокий уровень ЛВП предотвращает развитие ИБС. Считают, что ЛВП способствуют удалению холестерина из коронарных сосудов.
- Белки составляют более 50% массы мембран. Большинство мембранных белков имеет глобулярную структуру.
а. Интегральные мембранные белки прочно встроены в липидный бислой. Их гидрофильные аминокислоты взаимодействуют с фосфатными группами фосфолипидов, а гидрофобные — с цепями жирных кислот. Примеры интегральных мембранных белков — белки ионных каналов и рецепторные белки (мембранные рецепторы). Молекула белка, проходящая через всю толщу мембраны и выступающая из неё как на наружной, так и на внутренней поверхности, — трансмембранный белок.
б. Периферические мембранные белки (фибриллярные и глобулярные) находятся на одной из поверхностей клеточной мембраны (наружной или внутренней) и нековалентно связаны с интегральными мембранными белками.
- Наружная поверхность. Примерами периферических мембранных белков, связанных с наружной поверхностью мембраны, могут служить рецепторные \см. I В 2 (2) (а)] и адгезионные белки (см. главу 4 III А 2).
- Внутренняя поверхность. Примеры периферических мембранных белков, связанных с внутренней поверхностью мембраны, — белки цитоскелета (например, спек- трины, анкирин), белки системы вторых посредников [см. I В 2 (3)].
- Углеводы (преимущественно олигосахариды) входят в состав гликопротеинов и гликолипидов мембраны, составляя 2-10% её массы. С углеводами клеточной поверхности взаимодействуют лектины. Цепи олигосахаридов выступают на наружной поверхности мембран клетки и формируют поверхностную оболочку — гликокаликс (см. I Б 4).
Б. Организация плазматической мембраны
- Общепринята жидкостно-мозаичная модель.
- Для интегральных белков характерна латеральная подвижность, они могут перераспределяться в мембранах в результате взаимодействия с периферическими белками, элементами цитоскелета, молекулами в мембране соседней клетки и компонентами внеклеточного матрикса.
- Скопление интегральных белков в одном участке мембраны — кэппинг.
- Гликокаликс
а. Толщина » 50 нм.
б. Состав. Гликокаликс состоит из олигосахаридов, ковалентно связанных с гликопротеинами и гликолипидами плазмолеммы.
в. Функции
- Межклеточное узнавание (см. главу 4 III).
- Межклеточные взаимодействия (см. I В 2).
- Пристеночное пищеварение. Гликокаликс, покрывающий микроворсинки каёмчатых клеток эпителия кишечника, содержит пептидазы и гликозидазы, завершающие расщепление белков и углеводов.
В. Функции плазматической мембраны. Избирательная проницаемость (I), межклеточные взаимодействия (2), эндоцитоз (3), экзоцитоз (4).
- Избирательная проницаемость поддерживает клеточный гомеостаз, оптимальное содержание в клетке ионов, воды, ферментов и субстратов. Пути реализации: пассивный транспорт, облегчённая диффузия, активный транспорт.
а. Пассивный транспорт — движение небольших неполярных (например, O2, N2) и небольших полярных (например, H2O, CO2) молекул в обоих направлениях по градиенту концентрации или электрохимическому градиенту и без затрат энергии; характеризуется низкой специфичностью.
Диффузия газов при дыхании. Транспорт O2, CO2, N2 и других газов по градиенту их концентрации происходит при дыхании. Определяющий фактор — парциальное давление газов (например, р02 и рС02).
(а) Внешнее дыхание — двусторонняя диффузия газов между полостью альвеол лёгких и просветом кровеносных капилляров межальвеолярных перегородок (аэрогематический барьер; см. главу 13 Г 3 г).
(б) Тканевое дыхание — двусторонняя диффузия газов между просветом кровеносных капилляров и клетками внутренних органов (термин тканевое дыхание имеет и более широкое значение — утилизация O2 в метаболизме клеток).
б. Облегчённая диффузия веществ с участием компонентов мембраны (каналы и/или белки-переносчики), чаще всего в одном направлении (в клетку), происходит по градиенту концентрации и без непосредственных затрат энергии; проявляет специфичность по отношению к транспортируемым молекулам. В ряде случаев одновременно осуществляется сочетанный или обменный транспорт ионов, чаще Na+. Существуют многочисленные белки-переносчики (транспортёры, ионофоры) и ионные каналы.
- Белки-переносчики
(а) Глюкоза
- Переносчики глюкозы — интегральные гликопротеины. Инсулин увеличивает захват глюкозы клетками, вызывая быстрое перемещение этих гликопротеинов из цитоплазмы клетки в плазмолемму. Известно не менее 6 кодируемых генами GLUT трансмембранных переносчиков глюкозы из внеклеточной среды.
- Нервная ткань и GLUT3. Органы и клетки, имеющие значительную потребность в глюкозе (в первую очередь мозг), содержат переносчик GLUT3.
- Сперматиды и GLUT5. Экспрессия гена GLUT5 — маркёр созревания сперматозоидов.
[IIIj Всасывание в кишечнике. QLUT5 содержится в щёточной каёмке энтеро- цитов тонкой кишки (также переносчик фруктозы). GLUT2 базолатеральной части энтероцитов реализует выход сахаров из клеток.
[IV] Иисулин-независимый сахарный диабет. Точечная мутация гена GLUT2 (замена валина на изолейцин в позиции 197) — одна из причин развития диабета II типа.
- Сочетанный транспорт глюкозы и Na+ в тонкой кишке и канальцах почки обеспечивают мембранные гликопротеины, кодируемые генами SGLT. Это главный механизм почечной реабсорбции глюкозы, происходящей в начальном отделе проксимальных извитых канальцев нефрона.
Глюкозурия. Известно несколько мутаций гена SGLT2, приводящих к потере глюкозы в почках (до 60 г в сутки).
(б) Аминокислоты. Всасывание аминокислот в кишечнике, их реабсорбция в канальцах нефрона, а также поглощение аминокислот-нейромедиаторов ней-
ронами и глиоцитами мозга реализуются при помощи переносчиков, кодируемых генами SLCl и SLСЗ. Идентифицировано не менее десятка переносчиков, специфичных по отношению к р-, двухосновным, нейтральным и отдельным аминокислотам.
- Дистинурия. Несколько мутаций гена SLC3A1 приводит к избыточной секреции цистина (при некоторых формах также лизина, аргинина и орнитина) и к образованию почечных конкрементов.
- Глутамат и аспартат (аминокислоты-нейромедиаторы), накапливаясь в межклеточном пространстве ЦНС, могут оказывать цитотоксическое действие. Кодируемый геном SLC1A2 белок-переносчик транспортирует эти аминокислоты в цитоплазму нейронов и глиоцитов.
(в) Анионообменники — регуляторы внутриклеточного pH — осуществляют обмен Cl" на бикарбонат. Среди переносчиков этой группы хорошо изучены функции гликопротеина — полоса 3 мембраны эритроцитов.
Полоса 3 мембраны эритроцитов — многофункциональный транспортный белок глюкозы, анионов и воды.
- Респираторный обмен CO2. Анионообменник обеспечивает эффективный обмен Cl' на HCO3*: поступление бикарбоната в эритроциты в обмен на СГ в капиллярах разных органов, обратный процесс — в капиллярах лёгкого (см. Хамбургера закон и Хамбургера феномен).
- Ar старения клеток. При деградации полосы 3 мембраны эритроцитов образуется т.н. Ar старения клеток — метка, распознаваемая иммунной системой. Эритроциты, несущие эту метку (повреждённые, заканчивающие жизненный цикл, инфицированные плазмодиями малярии), распознаются макрофагами селезёнки и печени и фагоцитируются ими.
(г) Фосфаты. Система сочетанного транспорта фосфатов и Na+ в почке важна для гомеостаза фосфатов в организме.
- Реабсорбция фосфатов происходит в проксимальных извитых канальцах нефрона при помощи двух кодируемых генами NPT2 переносчиков.
- Почечные потери фосфатов при ряде наследуемых болезней (гипофосфатемия, К; гипофосфатемический рахит, 5?, р; гипофосфатемический рахит с гипокальций- урией, гипофосфатемическая болезнь костей), вероятно, обусловлены дефектами генов NPT2.
(д) Обмен Na+ на H+. Гены SLC9A кодируют белки плазмолеммы NHE (от Na, Н, Exchanger [обменник]), осуществляющие обмен внеклеточного Na+ на внутриклеточный Я+. Мембранные белки NHE — регуляторы внутриклеточного pH.
- Диуретик амилорид ингибирует NHEl, NHE2 и NHE4 и не оказывает действия на NHE3 и NHE5.
(ii ) NHEl (ген SLC9A1) экспрессируется практически во всех клетках, а в клетках эпителия — в базолатеральных отделах плазмолеммы (в т.ч. в канальцах почки). Амилорид ингибирует, а факторы роста, митогены, нейромедиаторы — активируют деятельность этого обменника. Дефекты гена SLC9A1, скорее всего, приводят к артериальной гипертензии (эссенциальная гипертоническая болезнь).
- NHE2 экспрессируется в канальцах почки и эпителии слизистой оболочки ЖКТ.
- NHE3 апикальной мембраны эпителиальных клеток кишечника и канальцев почки важен для трансэпителиального переноса Na+. В отличие от базолатерально расположенного NHE2, NHE3 нечувствителен к амилориду.
- NHE4 локализован преимущественно в эпителии слизистой оболочки желудка, (vi) NHE5 функционирует как регулятор pH и объёма клеток в ЦНС.
(е) Разные переносчики
- Таурин (см. главу 18).
- Креатин. Кардиомиоциты и скелетные мышечные волокна не синтезируют креатин, необходимый для энергетического обеспечения их функции (цикл кре- атин-фосфокреатин). Ингибирование переносчика креатина ведёт к развитию мышечной слабости. Дефекты кодирующего переносчик гена SLC6A8 — причина одной из форм кардиомиопатии (синдрома Барта).
- Фолаты. Этот переносчик обнаружен в плаценте и печени.
- Лактат и пируват транспортируются в обоих направлениях через плазмо- лемму эритроцитов, гепатоцитов, эпителия кишечника и почки, клеток мышечных тканей.
- Норадреналин. Выделившиеся в синаптическую щель нейромедиаторы частично транспортируются обратно в пресинаптические терминали. Трицикли- ческие антидепрессанты (например, дезипрамин, имипрамин), а также кокаин и амфетамины взаимодействуют с синаптическими транспортными системами биогенных аминов. Мутации генов, кодирующих переносчики норадреналина и серотонина, могут привести к развитию психической патологии (например, маниакально-депрессивного психоза).
- Ионные каналы состоят из нескольких связанных между собой белковых субъединиц (CE), формирующих в мембране небольшую пору. Через пору по электрохимическому градиенту проходят ионы. Наиболее распространённые каналы — для Na+, K+, Ca2+, СГ.
(а) Натриевые каналы. В возбудимых структурах (например, скелетные мышечные волокна, кардиомиоциты, нейроны) натриевые каналы генерируют потенциал действия, точнее, начальный этап деполяризации мембраны. Натриевые каналы присутствуют практически в любой клетке, не обязательно генерирующей потенциалы действия. Потенциаловозбудимые натриевые каналы — гетеродимеры; в их состав входят большая а-субъединица с Mr около 260 кД и несколько р-субъединиц (Mr 33-38 кД). Свойства канала определяет трансмембранная а-СЕ (известно минимально 6 органоспецифических изоформ).
- Антагонисты натриевых каналов (блокирующие функцию каналов агенты). [I] Местные анестетики (например, лидокаин)
- Противосудорожные препараты (например, карбамазепин)
- Токсины (например, тетродотоксин, сакситоксин, батрахотоксин)
- Антиаритмические препараты класса IA (например, хинидин)
- Амилорид. Мочегонные свойства амилорида объясняют закрытием натриевых каналов канальцев почки. Диуретик амилорид и его аналоги — блокаторы этих каналов.
- Амилорид-связывающий белок (диамин оксидаза, КФ 1.4.3.6) и рецептор амилорида в составе канала имеют примерно одинаковое сродство к своим лигандам.
- Амилорид-чувствительные Na+-KaHaAH, помимо канальцев почки, присутствуют в эпителии воздухоносных путей.
- Генные дефекты а-субъединицы (мутации гена SCN4A) — причина ряда заболеваний с эпизодически возникающей мышечной адинамией.
- Гиперкалиемический периодический паралич типа II.
- Миотония врождённая.
[Ш[ Парамиотония врождённая.
- Удлинённого интервала QT синдром (III типа) — мутация гена SCN5A, кодирующего а-СЕ натриевого канала кардиомиоцитов.
- Синдром Лйддла — дефект гена SCNEB, кодирующего р-СЕ потенциалозависимого натриевого канала в собирательных трубочках почки.
(б) Калиевые каналы — интегральные мембранные белки, обнаружены в плаз- молемме всех клеток; их функции: поддержание мембранного потенциала, регуляция объёма клетки, модуляция электрической возбудимости нервных и мышечных структур.
- Классификация. Гены калиевых каналов впервые детально изучены у Drosophila. Так, гены семейства Shaker[*] (Sh, подсемейства Shaker, Shaw, Shab, ShaO кодируют потенциалзависимые каналы, ген slowpoke — Са2+-зави- симый канал. Выделено также подсемейство J, гены которого кодируют потен- циалнезависимые входящие выпрямляющие калиевые каналы.
- Потенциалзависимые калиевые каналы человека (общее наименование — KCN) относят к подсемействам Shaker (не менее 8 генов KCNA) и Shaw (не менее 4 генов KCNQ.
- Потенциалнезависимые (в т.ч. активируемые Ca2t и выпрямляющие) калиевые каналы. В настоящее время идентифицирован единственный активируемый Са2*-канал, кодируемый геном SLO. Выпрямляющие калиевые каналы (не менее 4 генов KCNJ) контролируют мембранный потенциал покоя и возбудимость мембраны нейронов и кардиомиоцитов.
- Управляемые рецепторами и лигандами (например, ацетилхолин, АТФ).
- KCNAl
- Секреция инсулина. Этот калиевый канал регулирует в р-клетках островков Лангерханса секрецию инсулина в ответ на повышение содержания глюкозы в крови, а также на гипогликемические препараты сульфонилмочевины.
- Препараты сульфонилмочевины, принимаемые per os, широко используют для снятия гипергликемии при инсулин-независимом сахарном диабете (сахарный диабет типа II). Лекарственные препараты этого типа блокируют калиевые каналы в плазмолемме р-клеток островков поджелудочной железы, взаимодействуя с белком SUR (Mr от 140 до 170 кД, рецептор сульфонилмочевины, CE К+[АТФ-зависимого]-ионного канала).
- Незидиобластоз, для которого характерна упорная гиперинсулинемичес- кая гипогликемия, скорее всего, развивается при дефекте гена SUR, кодирующего рецептор сульфонилмочевины.
- Атаксия эпизодическая (тип I, известно не менее 5 мутантных аллелей) развивается при дефектах гена KCNA1.
- Лимфоциты экспрессируют минимально 3 подтипа KCNA3 (п, п', I). п-Под- тип важен для активации и пролиферации Т-лимфоцитов.
- KCNA4. Этот калиевый канал функционирует в скелетных мышцах плода.
- KCNA8 и KCNC1. Дефекты генов KCNA8 и KCNCl рассматривают как одну из причин развития фибрилляции желудочков сердца в сочетании с удлинённым интервалом QT типа I.
- Удлинённого интервала QTсиндром. Удлинённый интервал QT, фиксируемый на ЭКГ, — фактор риска внезапной коронарной смерти. Удлинённый интервал QT может быть приобретённым (при выраженной гипокалиемии; и врождённым (III типа).
(в) Са2+-каналы плазмолеммы (каналы депо кальция см. Ill А 3 б). Кроме потенциалзависимых, существуют также управляемые рецепторами (например, адренергическими) кальциевые каналы.
- Состав. Са2+-каналы — сложные белковые комплексы, состоящие из нескольких CE (а,, а2, р, у, 5).
- Изоформы CE а, (4 изоформы) и P (2 изоформы) — определяют разнобра- зие каналов и их свойства. Так, в состав каналов скелетных мышечных волокон, кардиомиоцитов, нейронов, эндокринных клеток входят разные Ot1-CE.
(Hi) Функции: сокращение, секреция (в т.ч. гормонов и нейромедиаторов) и множество иных клеточных процессов.
- Активация: деполяризация клеточной мембраны, взаимодействие лигандов с рецепторами.
- Классификация
- Типы кальциевого тока. Фармакологические и кинетические характеристики позволили выделить кальциевые каналы типов L (от long lasting — медленные), T (от transient — быстрые), N (от neuronal — нейронные), P (от Purkinje).
- L-тип. 1,4-Дигидропиридины (например, нифедипин), а также другие блокаторы кальциевых каналов (например, фенилалкиламины) угнетают кальциевый ток (например, в содержащих Ot1-CE кальциевых каналах скелетных мышц, миокарда, эндокринных клеток/нейронов).
- P-тип. Дигидропиридины не блокируют активность каналов (например, в содержащей Ct1-CE кальциевых каналах нервных клеток).
- Номенклатура. Имя гена и кодируемого полипептида включает тип канала (CACN — calcium channel [кальциевый канал]), тип и подтип кальциевого тока (L, Т, N, Р), тип CE (а, — Al, а2 — А2, р — В, у — G, 6 — D), изоформу CE (I, 2 и т.д.). Например, аббревиатура CACNL1A2 характеризует скелетномышечный (изоформа 2 Ct1-CE) потенциалозависимый кальциевый канал, блокируемый дигидропиридинами.
- CACNL1A3. Этот главный тип скелетномышечного медленного кальциевого канала состоит из двух больших (Ot1 и а2) и трёх меньшего размера (р, у, 5) CE. CE Ct1 ответственна за основные свойства канала и содержит участок связывания кальциевых блокаторов. CACNL1A3 (как и CACNL2A) играет ключевую роль в передаче возбуждения с плазмолеммы Т-трубочек (потенциал действия) на внутриклеточные депо кальция (саркоплазматическая сеть). Известно несколько мутаций CACNL1A3, ведущих к эпизодам мышечной слабости.
(г) Хлорные каналы. Плазмолемма скелетных мышечных волокон имеет высокую СГ-проводимость, определяемую преимущественно хлорным каналом CLC-1. CLC-I регулирует электрическую возбудимость плазмолеммы. Уменьшение СГ-про- водимости ведёт к электрической нестабильности мембраны мышечных волокон и развитию миотонии.
Врождённая миотония (болезнь Томсена). Эту болезнь впервые описал в 1876 г. страдавший от неё датский врач Юлиус Томсен.
(д) Водные каналы (аквапорины) — семейство мембранных пор для воды.
- Аквапорин I (ген AQPI, 107776, 7р14) экспрессируется в ряде органов.
[I] Эритроциты. Аквапорин I появляется в эритроцитах после рождения практически одномоментно с формированием способности почки концентрировать мочу. Вероятно, аквапорин способствует регидратации эритроцитов, обезвоженных в гипертонической среде капилляров мозговой части почки.
- Почка. Экспрессия аквапорина I происходит в почке (проксимальные извитые канальцы и тонкий отдел петли Хёнле) плода, начиная с II триместра беременности. Полной экспрессии этот водный канал достигает после рождения, что связывают со способностью почки концентрировать мочу.
- Глаз. Аквапорин I в тканях глаза обеспечивает гомеостаз внутриглазной жидкости.
- Аквапорин 2 (ген AQP2, 107777, 12ql3) экспрессируется только в собирательных трубочках почки. Активность этого канала регулирует антидиурети- ческий гормон (АДГ), увеличивая реабсорбцию воды из просвета трубочек в межклеточное пространство.
Нефрогенный несахарный диабет (тип II, 107777, 12ql3, р) — следствие мутации гена аквапорина 2.
- Аквапорин 3 (ген AQP3, 600170, 7q36.2-q36.3) — водный канал базолатеральных мембран собирательных трубочек почки. Экспрессия аквапорина 3 найдена также в печени, поджелудочной железе, кишечнике, селезёнке, простате.
- Аквапорин 4 экспрессируется в клетках эпендимной выстилки сосудистого сплетения желудочков и водопровода мозга, в синтезирующих вазопрессин нейросекреторных нейронах гипоталамуса. Этот канал расценивают как осморецептор.
- Аквапорин 5 принимает участие в формировании слёзной жидкости, слюны, секретов желёз воздухоносных путей.
(е) Управление ионными каналами. Термин воротные ионные каналы подразумевает идею управления ионными каналами (аналогия с открытыми и закрытыми воротами). В целом различают ионные каналы потенциалзависимые, механочувствительные, рецептор-зависимые, Са2+-зависимые, G-белок-зависимые.
- Потенциалзависимые ионные каналы открываются при изменении мембранного потенциала.
- Механочувствительные. Открываются при деформации мембраны (например, волосковые клетки внутреннего уха или чувствительная нервная терми- наль механорецепторов — телец Пачйни).
- Рецептор-зависимые. Открываются или закрываются при участии нейромедиаторов, биогенных аминов, АТФ, циклических нуклеотидов. Например, в клетках обонятельной выстилки внутриклеточный цАМФ связывается с цитоплазматическим участком каналообразующего белка.
- G-белок-зависимый К+-канал присутствует в кардиомиоцитах и открывается при взаимодействии ацетилхолина с его рецептором в составе комплекса «G-белок + мускариновый холинорецептор».
- Са2+-зависимые ионные каналы регистрируют внутриклеточную концентрацию Ca2+.
в. Активный транспорт — энергозависимый трансмембранный перенос против электрохимического градиента, происходящий при участии АТФаз. Наиболее известны Na+,K+-, H+,K+- и Са2+-АТФазы.
- Натрий, калиевая АТФаза
(а) Функции. Na+,К+-насос выкачивает Na+ из клетки в обмен на K+(трансмембранный градиент Na+ и K+). Насос регулирует потоки воды, поддерживая постоянный объём клетки, обеспечивает №+-связанный транспорт множества органических и неорганических молекул, участвует в создании мембранного потенциала и генерации потенциалов действия нервных и мышечных элементов.
(б) Состав. Na+,K+-Hacoc — интегральный мембранный белок, состоящий из 2 CE (каталитическая субъединица а и гликопротеин р).
(в) Изоформы
- Каталитическая субъединица. Известно 2 изоформы (а и а+) и 4 гена (ад, ав, ас, а0) каталитической CE. Почка содержит преимущественно форму a, a ЦНС, жировая ткань, скелетные мышцы — обе формы каталитической CE.
- р-Субъединица имеет две формы, P2-CE экспрессируется преимущественно в ЦНС.
Молекула адгезии глиальных клеток (ген AMOG) — интегральный мембранный гликопротеин с Mr 45-50 кД. При формировании мозжечка экспрессируется глиоцитами и направляет миграцию зернистых клеток. He исключено, что этот гликопротеин идентичен P2-CE №+,К*-АТФазы.
(г) Связывание катионов. Участки связывания Na+ расположены на цитоплазматической поверхности а-СЕ, a K+ — на наружной её поверхности.
(д) Кинетика. При гидролизе одной молекулы АТФ 3 иона Na+ выкачиваются из клетки и 2 иона K+ закачиваются в неё.
(е) Блокатор. Ыа+,К+-АТФазу блокирует гликозид уабаин, специфически взаимодействующий с участком связывания K+.
(ж) Уабаин — стероид, получаемый из древесины Acocanthera ouabaio или из семян Strophanthus gratus, действие идентично действию гликозидов наперстянки. Применяют для быстрой дигитализации.
- Протонная и калиевая АТФаза. При помощи этого фермента париетальные клетки желёз слизистой оболочки желудка участвуют в образовании соляной кислоты (электронейтральный обмен внеклеточного K+ на внутриклеточный H+). Н+,К+-АТФаза — гетеродимер (высокомолекулярная а-СЕ + меньшей мол. массы и сильно гликозилированная |5-СЕ). р-СЕ — главный Ar, к которому при некоторых заболеваниях (например, пернициозная анемия, атрофический гастрит) в крови циркулируют AT.
- Са2+-транспортирующие АТФазы (Са2+-АТФазы) выкачивают ионы кальция из цитоплазмы против значительного концентрационного градиента.
(а) Са2+-АТФазы плаЗмолеммы переносят ионы кальция из цитоплазмы во внеклеточное пространство. Существует минимально 4 изоформы этих АТФаз.
(б) Са2+-АТФазы саркоплазматического ретикулума. Как и Са2+-АТФазы плазмолеммы, Са2+-транспортирующие АТФазы саркоплазматического ретикулума откачивают ионы кальция из цитоплазмы, но не во внеклеточное пространство, а во внутриклеточные депо кальция (как правило, в замкнутые межмембранные объёмы гладкой эндоплазматической сети, именуемой в скелетных мышечных волокнах и кардиомиоцитах саркоплазматической сетью). Гистологические элементы мышечной ткани (быстрые мышечные волокна и медленные мышечные волокна + кардиомиоциты) имеют соответственно две такие Са2+-транспортирующие АТФазы.
Миопатия Броди — недостаточность Са2+-АТФазы саркоплазматического ретикулума, проявляющаяся симптомами мышечной усталости при физической нагрузке.
- Межклеточные взаимодействия. Клетка, воспринимая и трансформируя различные сигналы, реагирует на изменения окружающей её среды. Плазматическая мембрана — место приложения физических (например, кванты света в фоторецепторах), химических (например, вкусовые и обонятельные молекулы, pH), механических (например, давление или растяжение в механорецепторах) раздражителей внешней среды и сигналов информационного характера (например, гормоны, нейромедиаторы) из внутренней среды организма. При участии плазмолеммы происходят узнавание и агрегация (например, межклеточные контакты) как соседних клеток, так и клеток с компонентами внеклеточного матрикса (например, адгезионные контакты, адресная миграция клеток и направленный рост аксонов в нейроонтогенезе). Совокупность этих процессов — межклеточные взаимодействия. Все виды информационных межклеточных взаимодействий реализуются в рамках концепции сигнал-ответ, основы которой предложил Пауль Эрлих.
Концепция сигнал-ответ. Всё многообразие информационных межклеточных взаимодействий укладывается в схему, предусматривающую следующую последовательность событий: сигнал рецептор —gt; второй посредник —» ответ.
- Сигнал. Передачу сигналов от клетки к клетке осуществляют сигнальные молекулы (первый посредник), вырабатываемые в одних клетках и специфически воздействующие на другие клетки — клетки-мишени. Специфичность воздействия определяют присутствующие в клетках-мишенях рецепторы, связывающие только собственные лиганды.
(а) Гидрофильные молекулы (например, нейромедиаторы, цитокины, пептидные гормоны, Ar) связываются с рецепторами плазмолеммы (мембранные рецепторы).
(б) Жирорастворимые молекулы (например, стероидные гормоны) проникают через плазмолемму и связываются с ядерными рецепторами.
- Рецепторы регистрируют поступающий к клетке сигнал и передают его вторым посредникам (G-белки, циклические нуклеотиды, ионы Ca2+, инозитолтрифосфат и др.).
(а) Мембранные рецепторы — гликопротеины. Они контролируют проницаемость плазмолеммы путём изменения конформации белков ионных каналов (например, н-холинорецептор), регулируют поступление молекул в клетку (например, холестерина при помощи рецепторов ЛНП), связывают молекулы внеклеточного матрикса с элементами цитоскелета (например, интегринов, участвующих в образовании межклеточных контактов и контактов клеток с внеклеточным матриксом), регистрируют присутствие информационных сигналов (например, нейромедиаторов, квантов света, обонятельных молекул, Ar, цитокинов, гормонов пептидной природы). Мембранные рецепторы подразделяют на каталитические, связанные с ионными каналами и оперирующие через G-белок.
- Каталитические рецепторы — трансмембранные белки, наружная часть которых содержит связывающий лиганд участок, а цитоплазматическая часть функционирует как протеинкиназа (тирозин киназа). Рецепторные тирозин киназы активируют Ras G-белок. Далее сигнал через активирующие ГТФазу белки передаётся на Ras-каскад. Так организованы, например, рецепторы инсулина, факторов роста. Эти рецепторы кодируются онкогенами.
- Лиганд-зависимые каналы подразделяют на две группы.
- Рецептор perse — канал (например, н-холинорецепторы, рецепторы глицина, у- аминомасляной и глутаминовой кислот).
[И] Рецептор влияет на проницаемость ионных каналов через вторые посредники (например, адренорецепторы, м-холинорецепторы, рецепторы серотонина, дофамина).
- Рецепторы, связанные с G-белком. Система второго посредника (G-бел- ки) передаёт сигнал от рецептора к находящемуся в связи с мембраной эффектору (например, ионный канал, фермент).
(б) Ядерные рецепторы — семейство, состоящее из белков-рецепторов стероидных гормонов (минерало- и глюкокортикоиды, эстрогены, прогестерон, тестостерон), ретиноидов, тиреоидных гормонов, витамина D3. Каждый рецептор имеет область связывания лиганда и участок, взаимодействующий со специфическими последовательностями ДНК. Другими словами, ядерные рецепторы — активируемые лигандом факторы транскрипции. Некоторые ядерные рецепторы — протоонкогены (например, трансформирующий ген ERBA кодирует рецепторы T3 и T4).
- Вторые посредники передают сигнал на эффекторы (исполнительные молекулы), опосредующие ответ клетки на сигнал.
(а) G-белки (связывающие гуаниновые нуклеотиды белки). Различают собственно G-белок и Ras G-белок.
- G-белок состоит из трёх субъединиц (CE) — a, P и у (рис. 2-2), расположенных ближе к цитоплазматической поверхности мембраны. В покое CE объединены, а-СЕ связана с гуанозиндифосфатом. При активации — взаимодействии G-белка с комплексом «лиганд-рецептор» — гуанозиндифосфат отделяется от а-СЕ, а место гуанозиндифосфата занимает ГТФ. В результате G-белок активируется и диссоциирует. а-СЕ с ГТФ перемещается а: мембране и связывается с эффектором, активируя его. Затем а-СЕ катализирует переход ГТФ в гуанозиндифосфат, инактивируется и вновь объединяется с другими CE G-белка.
- Активируемые эффекторы. Независимо, антагонистически или синергести- чески, G и комплекс G. активируют: калиевые каналы типа L . (G , G.)
a Py г j л, Ацетилхолин а’
и Ik дтф (Ga), фосфолипазы A2 (Gjlr) и С,_3 (Ga, Gfy), аденилатциклазы I-IV, Са2+-каналы типов LhN (Ga)1 фосфодиэстеразу цГМФ (Ga), киназу ацетилхолинового мускари- нового рецептора (G^)1 p-адренорецепторы (Gflf).
- Лиганды связанных с G-белком мембранных рецепторов: ангиотензин II, АТФ, ацетилхолин (мускариновые рецепторы), бомбезин, брадикинин, вазопрессин, вещество P1 гистамин, глутамат, люлиберин, кванты света, нейро- медин, нейропептид Y, норадреналин, одоранты, ПТГ, серотонин, ТТГ, тромбин, тромбоксан A2, фактор агрегации тромбоцитов, холецистокинин, эндотелии.
- Полиморфизм и регуляция. Существует несколько изоформ каждой CE; токсин коклюша инактивирует гетеротример при АДФ-рибозилировании Ga; кальмодулин и фосдуцин действуют на G?y, изменяя их активность.
- Функциональные формы. Различают: Gs — активатор аденилатциклазы. Gi — ингибитор аденилатциклазы, Gp- активатор фосфолипазы
С, Gt — активатор цГМФ-фосфодиэстеразы (трансдуцин). Эти формы выявле-
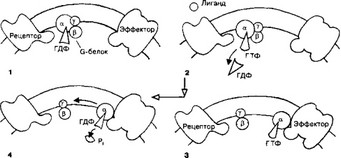
Рис. 2-2. Роль G-белка в активации эффекторов. I — выключенное состо
