Методы твердофазных иммуноанализов типа ELISA используют и для изучения молекулярных процессов проведения сигналов от мембранных рецепторов внутрь клетки. Эксперименты такого типа состоят из двух этапов.
Творческий поисковый этап — создание модели активации определенных живых клеток in vivo или в культуре in vitro.
Технический этап:
а) лизис клеток без денатурации макромолекул;
б) детекция искомых молекул передачи сигналов методом лову- шечного ИФА.
В качестве «ловушки» на твердой фазе используют высокоспецифичные антитела к определенным эпитопам, характерным для активированного состояния молекул, например сайтам фосфорилирования конкретных белков, участвующих в проведении сигнала. В этой связи коммерческие тест-системы такого назначения получили название «phosphoELISA».
Внутриклеточные белки исследуют в целях анализа конкретных молекулярных путей проведения сигналов в клетке (англ, pathways — путь), определяя конкретные киназы, фосфатазы, адаптерные белки, факторы транскрипции и др.
Для исследования внутриклеточных цитоплазматических белков и их производных интересующие клетки тщательно отмывают от внеклеточных субстанций 2—3-кратным центрифугированием (800 g, 5—6 мин) в фосфатном солевом буферном растворе, после чего лизируют буфером следующего состава (одного из возможных): 50 mM Tris, pH 7,4; 250 mM NaCl; 5 mM EDTA (этилендиаминте- траацетат); 1% NP40 (Nonidet Р40); 50 mM NaF; ImM Na3V04; 1 mM PMSF (ингибитор сериновых протеаз — трипсина и химотрипсина — фенилметан-сульфонил флюорид, матричный 0,3 М раствор в ДМСО, добавляют ex temporo); смесь ингибиторов протеаз (AEBSF, пепста- тин А, Е-64, бестатин, лейпептин, апротинин или других, добавляют ex temporo).
Осадок отмытых фосфатным буфером клеток ресуспендируют в лизирующем буфере и оставляют на 15 мин в условиях мягкого перемешивания. Затем лизат центрифугируют при 14 000 об/мин в течение 10 мин, разливают по аликвотам, определяют в нем общую концентрацию белков (чаще всего — методом Bradford). Наиболее приемлемы для дальнейших анализов концентрации белков 200— 400 мкг/мл.
В дальнейшем выполняют обычный ловушечный вариант ELISA (см. выше). Весьма важен как можно более многосторонний контроль (как минимум заведомо положительный контроль, заведомо отрицательный контроль, а также лизат одноименных, но неактивированных клеток, лизат клеток, обработанных «посторонним» биохимически родственным активатору веществом и др.).
Определение факторов транскрипции во внутриядерном содержимом
Процедура получения фракции ядер интересующих клеток может быть следующей.
Существуют технологии одновременного определения в одном биоматериале нескольких искомых факторов транскрипции (или цитокинов, или киназ и др.). Подобные методы в настоящее время осуществимы главным образом с применением высокотехнологичных коммерческих тест-систем. В качестве примера мы приведем описание процедур для тест-системы «Luminex 100» (Invitrogen. www.invitrogen.com). В данной технологии в качестве твердой фазы для ключевых реагентов используют микрошарики. Оценка результатов возможна только на уникальном приборе (большинство подобных тест-систем — так называемые закрытые, т.е. используют только свои приборы, свои реагенты, свои компьютерные программы).
Факторы транскрипции по своей природе реагируют, т.е. специфически связываются с определенными последовательностями нуклеотидов в двуспиральной ДНК.
Поэтому специфическими реагентами на факторы транскрипции являются строго определенные олигонуклеотиды ДНК, меченные биотином.
Второй олигонуклеотидный реагент конструируют из двух частей. Первая — последовательность нуклеотидов, комплементарная меченному биотином олигонуклеотиду. В виде двойной спирали они составляют сайт связывания искомого фактора транскрипции. Вторая часть этого олигонуклеотида — «ловушечная» последовательность, комплементарная последовательности нуклеотидов, фиксированной на твердой фазе (микрошариках).
Пробы раскапывают в лунки микропланшет, предназначенных для проведения ПЦР, чтобы использовать для инкубаций в качестве термостата термоциклер.
Минимальный набор анализируемых образцов включает:
Такой планшет инкубируют в течение 20 мин при 25 °С (можно в
ПЦР-термоциклере, который в данном случае используют как удобный динамичный термостат).
Затем в лунки с позитивным контрольным реагентом добавляют только буфер, тогда как в остальные лунки вносят буфер с нуклеа- зой, расщепляющей не связанную с белками ДНК. Инкубируют 20 мин при 37 °С. Только те ДНК-пробы, с которыми связались факторы транскрипции, не расщепляются нуклеазой, так как факторы транскрипции защищают последовательность нуклеотидов от атаки нуклеазы. Таким образом, количество биотиновой метки на молекулах ДНК прямо коррелирует с количеством того или иного фактора транскрипции в биопробе.
Стадия гибридизации с твердой фазой: в лунки вносят реагентные микрошарики и инкубируют 45 мин при комнатной температуре под светонепроницаемой крышкой, например, из алюминиевой фольги (рис. 4.14).
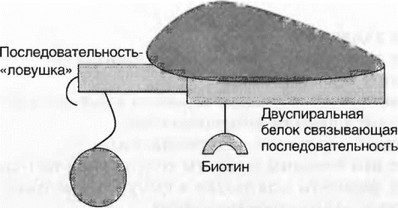
Рис. 4.14. Связывание с твердой фазой (шариками)
На следующей стадии (отмывке) применяют специальные планшеты из фильтрующего материала: содержимое лунок первоначальных планшет переносят в лунки планшет из фильтрующего материала и промывают трижды промывочным буфером с использованием вакуумной аспирации; растворимые компоненты вымываются, микрошарики остаются на дне лунок фильтровальных планшет.
Добавляют проявляющий реагент — конъюгат стрептавидина с люминофором, инкубируют 5 мин в темноте (рис. 4.15). Промывают и регистрируют люминесценцию на специальном приборе (например, Luminex 100).
Результаты считывают и обрабатывают специальной компьютерной программой (Luminex IS и др.).
В каждой биопробе за один цикл анализа, т.е. одновременно, можно количественно определить до 10 факторов транскрипции и более.
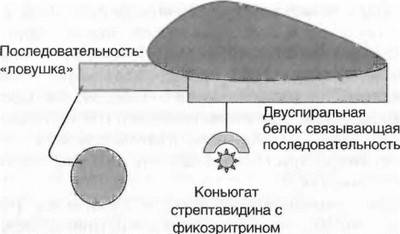
Рис. 4.15. Проявка Вопросы и задания
а) ловушечном;
б) конкурентном;
в) ингибиторном;
г) «сэндвич»;
д) иммунометрическом вариантах иммуноанализов.
Творческий поисковый этап — создание модели активации определенных живых клеток in vivo или в культуре in vitro.
Технический этап:
а) лизис клеток без денатурации макромолекул;
б) детекция искомых молекул передачи сигналов методом лову- шечного ИФА.
В качестве «ловушки» на твердой фазе используют высокоспецифичные антитела к определенным эпитопам, характерным для активированного состояния молекул, например сайтам фосфорилирования конкретных белков, участвующих в проведении сигнала. В этой связи коммерческие тест-системы такого назначения получили название «phosphoELISA».
Внутриклеточные белки исследуют в целях анализа конкретных молекулярных путей проведения сигналов в клетке (англ, pathways — путь), определяя конкретные киназы, фосфатазы, адаптерные белки, факторы транскрипции и др.
Для исследования внутриклеточных цитоплазматических белков и их производных интересующие клетки тщательно отмывают от внеклеточных субстанций 2—3-кратным центрифугированием (800 g, 5—6 мин) в фосфатном солевом буферном растворе, после чего лизируют буфером следующего состава (одного из возможных): 50 mM Tris, pH 7,4; 250 mM NaCl; 5 mM EDTA (этилендиаминте- траацетат); 1% NP40 (Nonidet Р40); 50 mM NaF; ImM Na3V04; 1 mM PMSF (ингибитор сериновых протеаз — трипсина и химотрипсина — фенилметан-сульфонил флюорид, матричный 0,3 М раствор в ДМСО, добавляют ex temporo); смесь ингибиторов протеаз (AEBSF, пепста- тин А, Е-64, бестатин, лейпептин, апротинин или других, добавляют ex temporo).
Осадок отмытых фосфатным буфером клеток ресуспендируют в лизирующем буфере и оставляют на 15 мин в условиях мягкого перемешивания. Затем лизат центрифугируют при 14 000 об/мин в течение 10 мин, разливают по аликвотам, определяют в нем общую концентрацию белков (чаще всего — методом Bradford). Наиболее приемлемы для дальнейших анализов концентрации белков 200— 400 мкг/мл.
В дальнейшем выполняют обычный ловушечный вариант ELISA (см. выше). Весьма важен как можно более многосторонний контроль (как минимум заведомо положительный контроль, заведомо отрицательный контроль, а также лизат одноименных, но неактивированных клеток, лизат клеток, обработанных «посторонним» биохимически родственным активатору веществом и др.).
Определение факторов транскрипции во внутриядерном содержимом
Процедура получения фракции ядер интересующих клеток может быть следующей.
- 5х106—2х107 клеток помещают в коническую пробирку объемом 15 мл, дважды отмывают в 10 мл фосфатно-солевого буфера (ФСБ) при 800 g 5—6 мин.
- Супернатант удаляют и к осадку клеток добавляют гипотонический лизирующий буфер из расчета 0,5 мл буфера на 5х106 клеток. Ex temporo (не ранее, чем за 10 мин до добавления к клеткам) на 0,5 мл гипотонического буфера добавляют 5 мкл ингибиторов фосфатаз, 5 мкл ингибиторов протеаз, 5 мкл DTT (дитиотреитол), 0,5 мкл PMSF.
- Клетки аккуратно перемешивают в гипотоническом буфере, переносят в чистую пробирку объемом 1,5 мл и оставляют на льду в течение 10 мин.
- Добавляют 25 мкл на 0,5 мл рабочего материала раствора детергента (0,1% SDS; 1% Triton Х-100; 0,1% Tween 20) и перемешивают в течение 5 с.
- Центрифугируют при 800 g 5—6 мин, 4 °С.
- Супернатант отделяют (он содержит цитоплазматические белки и может представлять интерес для отдельного анализа), а осадок ядер ресуспендируют в 1 мл полного буфера для отмывки ядер (к буферу добавляют ex temporo 10 мкл ингибиторов фосфатаз, 10 мкл ингибиторов протеаз, 10 мкл раствора DTT, 1 мкл раствора PMSF).
- Ядра дважды отмывают центрифугированием при 800 g 5—6 мин, 4 °С.
- Осадок ядер по объему примерно равен 25 мкл. К этому осадку добавляют равный объем специальных экстрагирующих буферов и аккуратно перемешивают в течение 2 с.
- Смесь инкубируют на льду в течение 30 мин, перемешивая каждые 10 мин.
- Осветляют ядерный экстракт центрифугированием при 14 000 g 30 мин при 4 °С.
- Супернатант содержит искомые вещества (факторы транскрипции). Его переносят в чистые охлажденные пробирки.
- Определяют концентрацию белков по Bredford. Как правило, из 5х106 клеток удается получить 25—100 мкг ядерных белков.
- Полученные образцы можно морозить при —80 °С в ожидании анализа, но только однократно.
Существуют технологии одновременного определения в одном биоматериале нескольких искомых факторов транскрипции (или цитокинов, или киназ и др.). Подобные методы в настоящее время осуществимы главным образом с применением высокотехнологичных коммерческих тест-систем. В качестве примера мы приведем описание процедур для тест-системы «Luminex 100» (Invitrogen. www.invitrogen.com). В данной технологии в качестве твердой фазы для ключевых реагентов используют микрошарики. Оценка результатов возможна только на уникальном приборе (большинство подобных тест-систем — так называемые закрытые, т.е. используют только свои приборы, свои реагенты, свои компьютерные программы).
Факторы транскрипции по своей природе реагируют, т.е. специфически связываются с определенными последовательностями нуклеотидов в двуспиральной ДНК.
Поэтому специфическими реагентами на факторы транскрипции являются строго определенные олигонуклеотиды ДНК, меченные биотином.
Второй олигонуклеотидный реагент конструируют из двух частей. Первая — последовательность нуклеотидов, комплементарная меченному биотином олигонуклеотиду. В виде двойной спирали они составляют сайт связывания искомого фактора транскрипции. Вторая часть этого олигонуклеотида — «ловушечная» последовательность, комплементарная последовательности нуклеотидов, фиксированной на твердой фазе (микрошариках).
Пробы раскапывают в лунки микропланшет, предназначенных для проведения ПЦР, чтобы использовать для инкубаций в качестве термостата термоциклер.
Минимальный набор анализируемых образцов включает:
- заведомо позитивный контроль;
- заведомо негативный контроль;
- пробу в виде постороннего белка;
- ядерный экстракт из нестимулированных клеток;
- ядерный экстракт из одноименных стимулированных клеток.
Такой планшет инкубируют в течение 20 мин при 25 °С (можно в
ПЦР-термоциклере, который в данном случае используют как удобный динамичный термостат).
Затем в лунки с позитивным контрольным реагентом добавляют только буфер, тогда как в остальные лунки вносят буфер с нуклеа- зой, расщепляющей не связанную с белками ДНК. Инкубируют 20 мин при 37 °С. Только те ДНК-пробы, с которыми связались факторы транскрипции, не расщепляются нуклеазой, так как факторы транскрипции защищают последовательность нуклеотидов от атаки нуклеазы. Таким образом, количество биотиновой метки на молекулах ДНК прямо коррелирует с количеством того или иного фактора транскрипции в биопробе.
Стадия гибридизации с твердой фазой: в лунки вносят реагентные микрошарики и инкубируют 45 мин при комнатной температуре под светонепроницаемой крышкой, например, из алюминиевой фольги (рис. 4.14).

Рис. 4.14. Связывание с твердой фазой (шариками)
На следующей стадии (отмывке) применяют специальные планшеты из фильтрующего материала: содержимое лунок первоначальных планшет переносят в лунки планшет из фильтрующего материала и промывают трижды промывочным буфером с использованием вакуумной аспирации; растворимые компоненты вымываются, микрошарики остаются на дне лунок фильтровальных планшет.
Добавляют проявляющий реагент — конъюгат стрептавидина с люминофором, инкубируют 5 мин в темноте (рис. 4.15). Промывают и регистрируют люминесценцию на специальном приборе (например, Luminex 100).
Результаты считывают и обрабатывают специальной компьютерной программой (Luminex IS и др.).
В каждой биопробе за один цикл анализа, т.е. одновременно, можно количественно определить до 10 факторов транскрипции и более.

Рис. 4.15. Проявка Вопросы и задания
- Дайте определение термина «иммуноанализы».
- Назовите варианты меток.
- Назовите технологические варианты иммуноанализов.
- Что такое «прямые» иммуноанализы?
- Что такое «непрямые» иммуноанализы?
- Какие вам известны варианты конструкций тест-систем?
- Какие ферменты используют в иммуноферментных анализах?
- Что такое иммунохроматография?
- Что такое иммуноблот?
- Дайте определение чувствительности и специфичности тест- систем.
- Тест-системы с какими чувствительностью и специфичностью (высокой/низкой) следует применять в скрининговых (первичных) обследованиях?
- Как зависит величина сигнала от концентрации определяемого вещества в биопробе в:
а) ловушечном;
б) конкурентном;
в) ингибиторном;
г) «сэндвич»;
д) иммунометрическом вариантах иммуноанализов.
- Нарисуйте схему иммунометрической тест-системы.
- Что означает вывод о «ложнопозитивном» результате иммуноанализа?
- Что означает вывод о «ложнонегативном» результате иммуноанализа?
- Какие варианты регистрирующих приборов применяют в иммуноанализах?
- Какова в среднем чувствительность иммуноанализов (относительно концентраций определяемых веществ)?
