Наиболее ранний предшественник Т-клеток, мигрировавший из костного мозга в субкапсулярную область тимуса, обладает нативной организацией генов для ТКР — исходным состоянием генома, которое определяется как генная организация зародышевой линии развития. В результате взаимодействия субкапсулярных тимоцитов с эпителиальными клетками данного региона происходит первое реорганизационное событие. На этом этапе внутри- тимусного развития оно касается только генов для p-цепи ТКР и проявляется в объединении одного из двух D-сегментов с одним из двенадцати J-сегментов.
По мере дальнейшего развития тимоцитов происходит второе реорганизационное событие — объединение одного из 30 V- генов с DJ, что приводит с синтезу полноценной p-цепи. На этом, третьем этапе развития синтезируемая p-цепь еще остается в цитоплазме, и фенотип клеток неотличим от фенотипа предыдущего этапа (CD4-, CD8", ТКР ).
Начало умеренной экспрессии p-цепи в комплексе с CD3- пептидами является сигналом для реорганизации генов a-цепи, a также выхода на клеточную поверхность CD4 и CD8. Эти внутриклеточные события сопряжены с переходом тимоцитов из субкапсулярной области во внутренний корковый слой. Фенотип этих клеток - CD4+, CD8\ рТКР±.
Вскоре тимоциты коры начинают умеренную экспрессию функционально полноценного сфТКР. Фенотип таких клеток — CD4+, CD8f, арТКР1 . После завершения процесса представления основных функционально активных полипептидов создаются условия селекции тимоцитов по их способности распознавать собственные молекулы МНС (табл. 7 2).
Таблица 7.2
Этапы реорганизации генов ар-цепей Т-клсточного рецептора
|
Этап |
Характер реорганизации |
Фенотип тимоцитов |
Область тимуса |
|
1 |
нативный геном |
CD4-CDfi-apTKP* |
субкапсула |
|
2 |
соединение DJ |
CD4-C:D8-apTKP- |
субкапсула |
|
3 |
завершение реорганизации генов р-цспи |
СП4 CDS орТКР- (p-цепь в цитоплазме) |
субкапсула |
|
4 |
начало реорганизации генов о-цепи |
С D4+С D8 ^ рТКР* |
промежуточная зона между субкапсулой и корой; кора |
|
5 |
завершение реорганизации генов о-цсли |
CD4+CDS+apTKP1 CD4+CD8+«3TKP+ |
кора; кортико-медуллярное сое ди нен ие |
- Положительная и отрицательная селекция клеток в тимусе. Формирование клоноспецифических Т-клеток
- Эксперименты, демонстрирующие распознавание рецепторами Т-меток комплекса “своего " с “чужим ”
В главе 3 были представлены молекулярные основы двойного распознавания Т-клетками — распознавания молекул I или II классов МНС и ассоциированных с ними антигенных пептидов. Изучению молекулярных механизмов такого распознавания предшествовали опыты с использованием систем взаимодействия несингенных (аллогенных) клеток in vitro.
Первые опыты в этом направлении были проведены с ин- бредными морскими свинками линий 2 и 13, которые отличаются друг от друга только по генам, контролирующим антигены II класса МНС (рис. 7.4). Т-клетки морских свинок, предварительно сенсибилизированных одним из антигенов (овальбумином, туберкулином и др.), вносили в культуру макрофагов, которые презентиру- ют антиген, использованный для иммунизации. Во всех случаях, когда макрофаги и Т-клетки были генетически идентичными (сингенными), регистрировался сильный пролиферативный ответ Т- клеток, распознавших антиген на поверхности сингенных макрофагов. В то же время Т-клетки, отличающиеся от макрофагов по антигенам II класса, не в состоянии развить пролиферативный ответ в несингенной системе клеточного взаимодействия. Эти первые опыты позволили предположить, что примированные Т-клетки распознают не только антиген, использованный для иммунизи- ции, но и собственные антигены гистосовместимости. Однако уз-
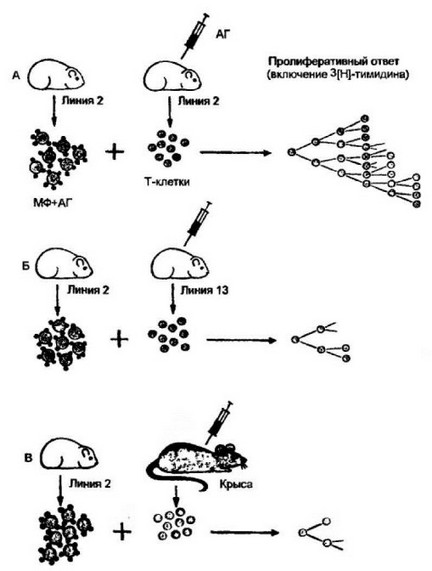
Рис. 7.4. Пролиферативный ответ (цитированных Т-клегок с микрофагами различных генотипов.
Инбредные морские свинки линий 2 и 13 отличаются друг от друга только по генам II класса МНС. Макрофаги (МФ), проинкубированные с антигеном (АГ) (овальбумином, туберкулином и др.), обеспечивают интенсивную пролиферацию in vitro сингенных, идентичных по генам II класса Т-клеток, примированных к соответствующему антигену (А). В то же время Т-клетки морских свинок, отличающиеся от донора макрофагов по генам II класса, не в состоянии развить пролиферативный отпет (Б). Нет ответа и при ксеногенном сочетании: морская свинка — крыса (В)
нать антиген на чужеродной макрофагальной поверхности, имеющей отличающуюся молекулу II класса МНС, этим клеткам не удалось.
Демонстративные опыты были проведены с клонами Т-клеток от гибридных морских свинок (2 х 13)Fi, иммунизированных двумя антигенами — овальбумином и туберкулином (рис.7.5). От примированных животных выделили 4 клона антигенреактивных
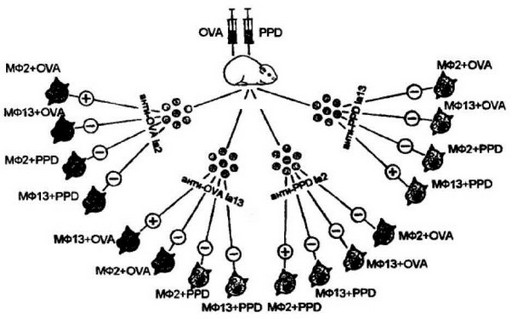
Рис. 7.S. Способность клонов Т-клеток морских свинок специфически реагировать с антигеном и молекулами II класса главного комплекса гистосовместимости.
Гибридов морских евкнок (2x13)F] иммунизировали двумя антигенами (АГ)- туберкулином (PPD) и овальбумином (OVA). От примированных животных выделено 4 клона антигенреактивных Т-клсток, каждый из которых способен реагировать только на один из антигенов, ассоциированных с макрофагами одной из родительских линий (2 или 13). Результат реакции оценивали по интенсивности пролиферации клонированных Т-клеток, взаимодействующих in vitro с макрофагами (МФ), ирезентирующими тот или иной антиген. Во всех случаях клон отвечал только на тот антиген и молекулу II класса МНС, по которым шла селекция при клонировании
Т-клеток, каждый из которых способен реагировать только на один из антигенов, ассоциированных с макрофагами одной из родительских линий (линии 2 или линии 13)* Результаты реакции оценивали по интенсивности пролиферации клонированных Т-клеток, взаимодействующих in vitro с макрофагами определенной линии, презентирующими один из антигенов: макрофаги линии 2 + овальбумин, макрофаги линии 13 + овальбумин, макрофаги линии 2 + туберкулин и макрофаги линии 13 + туберкулин. Во всех без исключения случаях реакция Т-клеток регистрировалась только на то сочетание макрофага с антигеном, к которому прошло клонирование. Замена либо гаплотипа макрофага, либо антигена отменяла реакцию пролиферации. Поскольку две линии морских свинок отличались друг от друга только по генам, контролирующим молекулы II класса МНС, сделали вывод, что отдельный клон Т-клеток имеет антигенраспознающие рецепторы, направленные на комплекс антигена с продуктами этих генов.
Представленные опыты, несмотря на свой феноменологический характер, позволяли сделать принципиальное заключение: рецепторы Т-клеток распознают не собственно чужеродный антиген, а его комплекс с молекулами МНС. Однако они не давали ответа на вопрос, с какой субпопуляцией Т-клеток связано двойное распознавание.
Специальные исследования по выяснению данного вопроса констатировали, что рестрикция по генам МНС существует как для Т-хелперов, так и для Т-киллеров. При этом ограничения в зависимости от характера субпопуляции касаются разных генов МНС: как генов, контролирующих молекулы I класса, так и генов, ответственных за синтез молекул П класса.
В опытах in vitro по генерации Т-хелперов, усиливающих продукцию антител, были получены следующие результаты (рис. 7.6).
В культуру поглотивших антиген макрофагов вносились предшественники Т-хелперов, которые были либо генетически идентичными, либо отличались от макрофагов по генам МНС. После определенного времени совместного культивирования Т-клетки переносили во вторичную культуру, содержащую сингенные клетки селезенки (источник антителопродуцентов) и гомологичный антиген. В тех случаях, когда Т-лимфоциты получали от первичной культуры, в которой взаимодействующие клетки были идентичны по генам, контролирующим молекулы II класса, констатировалось сильное развитие иммунного ответа. В то же время Т-клетки от культуры, содержащей не идентичные по генам II класса клетки, оказались неспособными обеспечить хелперный эффект во вторичной культуре.
Таким образом, созревание Т-хелперов из предшественников в первичной кульгуре происходит только в условиях идентичности между взаимодействующими клетками по молекулам II класса. Различия, затрагивающие поверхностные молекулы, контролируемые другими генами МНС, не имели значения для генерации Т- хелперов.
Сходные по целевой направленности опыты были проведены при использовании двух систем анализа — in vivo и in vitro (рис.
- . Мышей определенного генотипа иммунизировали не нативным антигеном, как это делается в обычной экспериментальной работе, а антигеном, прошедшим переработку в макрофаге и представленным на его поверхности в иммуногенной форме. Схема опыта включала два этапа. Первый этап — иммунизация in vivo. Мышам определенного генотипа вводили несингенные, отличающиеся по генам II класса макрофаги, которые экспрессировали чужеродный антиген. После определенного времени от иммунизированных животных выделяли сенсибилизированные клетки селезенки. Второй этап экспериментов состоял в изучении способнос-
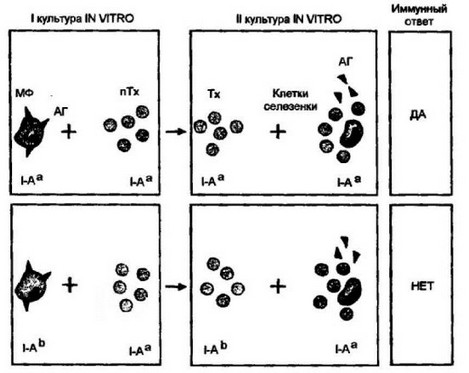
Рис. 7.6. Участие генов II класса главного комплекса гисгосовмесгнмости в индукции Т-хелперов у мышей.
Презснтируюшие антиген (АГ) макрофаги (МФ), относящиеся к определенному гаплотипу по генам И класса главного комплекса гистосовместимости (например, |-Аа или 1-Аь), помещали в культуру in vitro вместе с Т-лимфоцитами. После определенного времени совместного культивирования Т-лимфоциты, прошедшие примированис в первичной культуре, переносили во вторичную культуру, куда добавляли интактные клетки селезенки и гомологичный антиген. В тех случаях, когда Т-лимфоциты получали от первичной культуры, в которой взаимодействующие клетки (макрофаги и Т-клстки) были идентичны по генам II класса, констатировали выраженное развитие антителопродукиии во вторичной культуре. В то же время Т-лимфоциты от первичной культуры, содержавшей не идентичные по генам II класса клетки, оказывались неспособными обеспечить хелперный эффект во вторичной культуре. Иначе, созревание Т-хелперов из предшественников происходит только в условиях идентичности по генам II класса между взаимодействующими клетками ги выделенных клеток развивать вторичный ответ in vitro при взаимодействии с макрофагами различных гаплотипов. Выяснилось, что вторичный ответ развивается только в том случае, если в систему вносят макрофаги, генетически идентичные тем, которые были использованы при первичной иммунизации in vivo. Макрофаги, сингенные клеткам селезенки, нс могли индуцировать вторичный ответ.
Объяснение этому эксперименту, как и предыдущему, сводится к следующему. В процессе первичной иммунизации Т-хелпе- ры распознают чужеродный антиген в комплесе с молекулами II класса. В результате накапливается клон Т-хелперов, обладающих антигенраспознающими рецепторами, специфичность которых 168
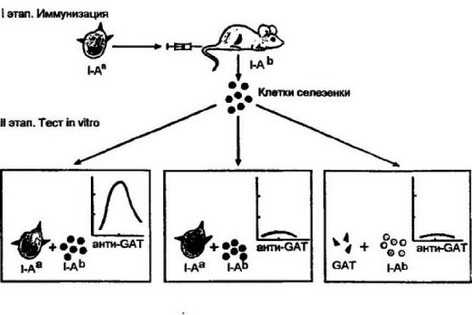
Рис. 7.7. Участие генов II класса главного комплекса гистосовместнмости в при- мироваиин Т-хелперов н их взаимодействии при вторичном ответе in vintro.
При иммунизации мышей с определенной характеристикой по генам II класса главного комплекса гистосовместимости (например, 1-Аь) макрофагами от донора с иным гаплотипом (например, 1-А“), поглотившими антиген (АГ; в конкретных опытах использовали полиглутаминовую кислоту полиаланинполитиро- зин — GAT), иммунный ответ (анти-GAT), будет развиваться в культуре in vitro только в том случае, если в культуральную систему взаимодействия вносят макрофаги того генотипа, которые использовали при первичной иммунизации. Сингенные макрофаги, ассоциированные с тем же антигеном, не способны обеспечит* развитие вторичного иммунного ответа. Нет ответа и при использовании свободного антигена. В процессе примирования in vitro были отобраны антигснспецифи- ческие клоны Т-хелперов, способных распознать антиген в комплексе с молекулами II класса того га плоти па, который был предложен при иммунизации. Представление таким Т-хелперам антигена, ассоциированного с собственными (сингенными) молекулами II класса, не обеспечивает их распознавание и формирование иммунного ответа in vitro (схему, представляющую механизм описанных опытов, см. на рис. 7.8.)
ограничена особенностями строения как чужеродного антигена, так и молекул II класса МНС, Во вторичной культуре такой клон отвечает только на комплекс, использованный при иммунизации (рис. 7.8).
Цитотоксические Т-клетки, как и Т-хелперы, распознают не собственно чужеродный антиген, а его комплекс с молекулами МНС. Однако ограничения в данном случае касаются молекул I класса. Это заключение было сделано по результатам достаточно простых, но демонстративных опытов. Мышей с определенным гаплотипом иммунизировали одним из вирусов (рис. 7.9). От при- мированных животных получали Т-клетки, которые использовали в цитотоксическом тесте с клетками-мишенями. В тех случаях, когда
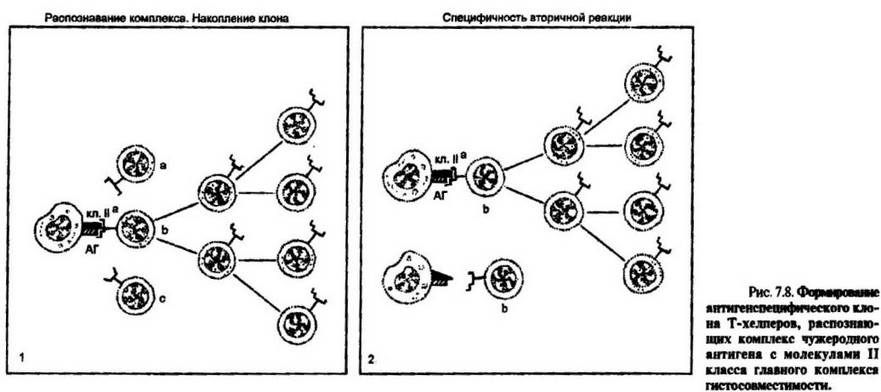
1.Отбор антигенспецифического клона. Антиген (АГ) образует комплекс с молекулами 11 класса главного комплекса гистосовместим ости. Среди .множества лредсуществуюших антигенспецифических клонов Т-хелперов (а, Ь, с и т.д.) в процесс распознавания вступит только тот из них, который имеет антигенраспознающий рецептор (ТКР), конформационно соответствующий антигенному комплексу. Факт взаимодействия рецептора с антигенным комплексом обеспечит накопление соответствующего клона Т-хелперов (завершится процесс примирования клона). 2. При вторичном иммунном ответе на тот же самый антигенный комплекс ( на схеме антиген+мо- лскула II класса гаплотипа “а”) накопленный клон антигенспецифических Т-хелперов ответит быстрой пролиферативной реакцией. Если этому клону будет предложен тот же самый антиген, но в комплексе с молекулами II класса иного гаплотипа, не использовавшегося при первичной иммунизации (например, гаплотип “Ь"), то клон останется ареактивным к новому антигенному комплексу
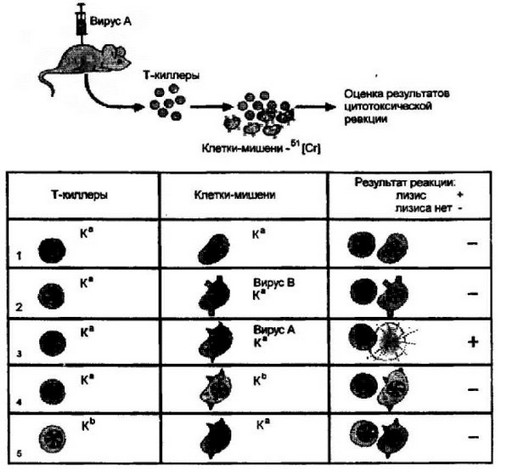
Рис. 7.9. Генетические ограничения при взаимодействии Т-киллеров (ЦТЛ) с клетками-мишенями, зараженными вирусом.
Мышей с определенной характеристикой по локусу К или D иммунизировали одним из вирусов (условно вирусом А). От примированных животных получали Т-клетки, которые использовали в цитотоксическом тесте с клетками-мишенями, зараженными вирусом и относящимися по характеру локуса К (или D) либо к донору Т-клеток, либо к его аллельному варианту. Цитотоксическую реакцию оценивали по интенсивности выделения *'Сг из клеток-мишеней. Примиро- ванные Т-киллеры гаплотипа К“ не дают реакции с генетически идентичными, интактными клетками-мишенями (1). Нет реакции и при заражении клеток-мишеней вирусом, отличающимся от вируса использованного при иммунизации (2). Цитотоксическая реакция положительная, если генетически идентичные Т-кил- лерам клетки-мишени заражают гомологичным вирусом (3). В то же время при использовании клеток-мишеней, отличающихся по локусу К от Т-киллеров, цитотоксическая реакция не развивается даже при наличии гомологичного вируса у клеток-мишеней (К* против Кь или Кь против К" — 4,5). Аналогичные отношения выявлены для локуса D. В то же время генетические ограничения не проявляются по генам, контролирующим молекулы II класса. Из этих опытов следует, что Т- киллеры распознают как собственные молекулы I класса, так и чужеродный вирусный антиген
Т-киллеры и мишени обладали идентичным геном, контролирующим молекулы I класса (Н-2К или H-2D), развивалась сильная цитотоксическая реакция. При генетических различиях по генам I класса реакция не развивалась. Ограничения касались только этих генов и не затрагивали генов, контролирующих антигены II класса.
Аналогичные результаты были получены при использовании гаптена (рис. 7.10).
Объяснение полученных данных строится на том представлении, что в процессе примирования происходит селекция клона Т-
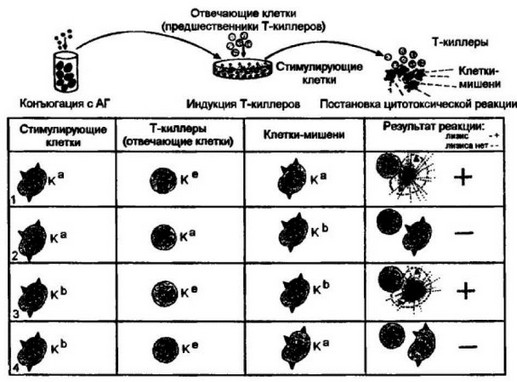
Рис. 7.10. Генетические ограничения при взаимодействии Т-киллеров с клетками-мишенями, конъюгированными с гаитеном.
Клетей с определенной характеристикой по локусу К конъюгировали с простым химическим соединением — гаптеном. Такие клетки выступали в качестве стимулирующих, антигенпредставляющих клеток в культуре in vitro, куда вносили интактные Т-клетки, идентичные или отличающиеся по локусу К от стимулирующих клеток. После 4-5 суток совместного культивирования Т-клетки собирали и тестировали в цитотоксической реакции с клетками-мишенями, конъюгированными с гомологичным гаптеном. При генетической идентичности по локусу К между стимулирующими и отвечающими клетками, а также клетками-мишенями развивается выраженная цитотоксическая реакция (1). Цитотоксический ответ Т- киллеров отсутствует, если между стимулирующими клетками и клетками-мишенями имеются различия по локусу К (2, 4). В то же время генетическая идентичность по локусу К между этими клетками обеспечивает развитие полноценной цитотоксической реакции, хотя локус Т-киллеров представлен в аллельном варианте по отношению к локусу мишени (К* против Кь; 3). Аналогичные отношения выяапены для локуса D. Генетические различия по гемам I! класса не имеют значе- ния 172
киллеров, способных распознавать комплекс антигена с молекулами I класса определенного гаплотипа. В связи с этим популяция Т-клеток, обогащенная специфическими Т-киллерами, будет распознавать только те мишени, зараженные вирусом, которые имеют одинаковый с Т-киллерами генотип по генам I класса.
