Использование цитокинов в качестве лекарственных препаратов
Будучи физиологически активными молекулами, цитокины уже вскоре после их открытия стали апробироваться в качестве лекарственных средств. Раньше других нашли медицинское применение интерфероны (особенно IFN I типа) благодаря наличию у них антивирусной активности. С начала 80-х годов прошлого столетия начинаются систематические испытания различных цитокинов в качестве противоопухолевых средств, стимуляторов кроветворения и с другими целями.
Ряд особенностей физиологии цитокинов осложняет их применение в качестве лекарственных средств.
- Как факторы преимущественно местного действия, цитокины, как правило, быстро выводятся. Так, для IL-1, IL-2 и ряда других цитокинов время их полувыведения составляет минуты. Это требует частых инъекций или непрерывного капельного (или с помощью микронасосов) вливания препаратов.
- Цитокины — полифункциональные молекулы. В связи с этим трудно добиться целенаправленного эффекта от их применения без сопутствующих побочного действия или даже серьезных осложнений (см. далее).
- Цитокины функционально взаимосвязаны и образуют единую цито- киновую сеть. Введение цитокинов извне влияет на функционирование сети, усиливает (реже ослабляет) выработку практически всех ее компонентов в результате чего результирующая реакция может быть обусловлена не введенным цитокином, а другими составляющими сети. Например, при введении высоких доз IL-2 может развиться шок, подобный септическому, за счет гиперпродукции TNFa.
В настоящее время область медицинского применения цитокинов относительно узка. Препараты цитокинов используют в нескольких областях медицины.
- Интерфероны a и в применяют в качестве антивирусных препаратов для лечения гепатитов В и С.
- IFNp используют для лечения рассеянного склероза.
- Препараты GM-CSF (молграмостим) и G-CSF (филграстим) используют для стимуляции соответственно грануломиело- и гранулопоэза, нарушенных в результате химиотерапии, а также действия ионизирующей радиации. G-CSF используют также для мобилизации стволовых кроветворных клеток в кровоток с последующим использованием крови в качестве источника этих клеток для восстановления гемопоэза, нарушенного летальным облучением при лечении гемобластозов.
- Для лечения злокачественных опухолей применяют препараты IFNa2 (см. раздел 2.5.6.1). Применение с той же целью препаратов IL-2 приостановлено. В ограниченном масштабе применяют мутеины — генетически модифицированные производные TNFa и ряд других цитокинов. Цитокины обычно вводят внутривенно, капельно, короткими курсами.
Несколько подробнее остановимся на использовании цитокинов для лечения злокачественных опухолей (табл. 4.25). Цитокиновую терапию злокачественных опухолей стали разрабатывать и внедрять в онкологическую клиническую практику с начала 80-х годов прошлого века, когда в экспериментах на мышах была показана противоопухолевая эффективность высоких доз рекомбинантного IL-2. Вскоре этот подход был реализован в клинической практике и была показана его эффективность (положительный ответ на монотерапию в 20—25% случаев) при первичном раке почки и злокачественной меланоме. Недостатком метода были тяжелые осложнения, приводившие к летальному исходу в 2% случаев. В настоящее время использование IL-2 для лечения опухолей приостановлено в связи с риском индукции регуляторных Т-клеток. Более широкое распространение получило лечение с использованием рекомбинантных форм IFNa2. Его применяют (также в высоких дозах) для лечения вышеупомянутых иммунозависимых опухолей, а также лимфом, рака молочной железы, рака мочевого пузыря, некоторых сарком. Противоопухолевое действие IFNa основано на способности усиливать экспрессию молекул MHC-I, антипролиферативном эффекте, стимуляции дифференцировки Т-лимфоцитов в направлении Thl-клеток и ряде других эффектов. Хотя лечение IFNa также дает осложнения, они проявляются реже и в менее выраженной форме, чем при лечении IL-2. В настоящее время IFNa является единственным цитокином, прочно вошедшим во вспомогательный арсенал противоопухолевых препаратов. Его используют на фоне базовой противоопухолевой терапии; показана его способность усиливать эффект химиотерапевтических препаратов.
Таблица 4.25. Использование цитокинов для лечения опухолей
|
Цитокин |
Использование для лечения опухолей |
|
IFNa |
Применяют в клинической практике в сочетании с базисной терапией |
|
IL-2 |
Клиническое применение приостановлено в связи с риском индукции регуляторных T-лимфоцитов |
|
IL-15 |
Испытывают в качестве заменителя IL-2 |
|
TNFa |
Применяют для локального лечения (перфузия), а также в форме мутеинов |
|
GM-CSF |
Применяют для активации макрофагов и стимуляции миелопоэза |
|
G-CSF, IL-ip |
Применяют для стимуляции миелопоэза на фоне химиотерапии |
|
IFNy, IL-12 |
Испытывают в качестве дополнительных средств иммуно- и генотерапии |
|
IL-4, IL-5, IL-6, IL-7 |
Испытывают в качестве дополнительных средств иммунотерапии |
|
Хемокины |
Испытывают в качестве антиангиогенных средств |
Испытанию на противоопухолевую активность подверглось большинство известных цитокинов, однако в большинстве случаев их прямое использование в форме инъекций не признано обоснованным. Так, противоопухолевой активностью обладает TNFa, но его высокая токсичность препятствует использованию данного цитокина в лечебных целях. Нативный TNFa применяют для локальных перфузий участков тела (например, конечностей), в которых расположена опухоль. Разработано и используется в онкологической практике несколько препаратов мутеинов — продуктов мутантных генов TNFa с ослабленной токсичностью, способных избирательно взаимодействовать с рецептором TNFRI (р55), передающим сигналы к апоптозу клетки. IFNy, играющий столь важную роль в противоопухолевом иммунитете, в качестве лечебного препарата оказался недостаточно эффективным и способным давать осложнения, обусловленные неадекватной активацией макрофагов. Аналогичные недостатки свойственны препаратам на основе IL-12. Некоторые побочные эффекты, вызываемые цитокинами, удается обойти, вынося этап их действия на клетки иммунной системы за пределы организма.
С лечебными целями используют преимущественно препараты рекомбинантных цитокинов. В ограниченном масштабе применяют экстракты лейкоцитов, обогащенные цитокинами [отечественные препараты лейкинфе- рон (интерферон лейкоцитарный человеческий) и суперлимф (препарат для местного применения, созданный Л.В. Ковальчуком)]; в последнем лечебная эффективность обусловлена не только цитокинами, но и дефензинами).
Наиболее часто проявляется 4 типа осложнений цитокинотерапии.
- Гриппоподобный синдром — недомогание, тошнота и рвота, боли в мышцах и суставах, а также другие проявления, характерные для начала инфекционных заболеваний, при которых эта симптоматика связана с выделением провоспалительных цитокинов.
- Шок, подобный септическому, без бактериемии — тяжелое осложнение, проявляющееся внутрисосудистым свертыванем крови, падением кровяного давления; обусловлен повышенной выработкой TNFa.
- Синдром протекания капилляров — патогенетически не до конца проясненное состояние, причиной которого служит повышение проницаемости капилляров преимущественно для жидкой части крови; оно проявляется развитием сначала насморка и диареи, а затем отека легких, часто смертельного.
- Синдром наркотической зависимости — проявляется особенно часто при лечении интерферонами.
Антицитокиновая терапия
Антицитокиновая терапия основана на применении антагонистов цитокинов. Ее используют преимущественно при лечении воспалительных заболеваний аутоиммунной природы. Разрабатывают подходы к ее использованию при аллергических заболеваниях.
В качестве противовоспалительных средств используют рекомбинантные аналоги природных белков — рецепторный антагонист IL-1 — raIL-1, растворимые рецепторы для TNFa (TNFRII), а также гуманизированные (см. раздел 3.6.2.5) моноклональные антитела к TNFa (инфликсимаб, реми- кейд). Благоприятный клинический эффект препаратов на основе моноклональных антител к TNFa получен при ревматоидном артрите, болезни Крона, спондиллоартрите, ювенильном артрите, псориатическом артрите, псориазе, гранулематозе Вегенера, полиомиозите, рассеянном склерозе.
Антицитокиновая терапия для лечения аллергических заболеваний находится в процессе разработки. Сообщалось об испытании при бронхиальной астме и других аллергических заболеваниях гуманизированных моноклональных антител к ряду цитокинов, как имеющих прямое отношение к патогенезу аллергических процессов (IL-5, IL-4, IL-13, IL-9), так и к провоспалительным цитокинам TNFa, IL-1 и IL-25. Испытаны также растворимые рецепторы для IL-4, моноклональные антитела к ним и IL-4-мутеины. Несмотря на улучшение ряда лабораторных показателей, например, ослабление эозинофилии при лечении антителами к IL-5, клиническая эффективность препаратов оказалась в целом незначительной. Только при высоких дозах наблюдали снижение риска развития обострений. Умеренный клинический эффект получен от применения растворимых препаратов рецепторов для IL-4 и моноклональных антител к IL-13. Более выраженный клинический эффект достигнут при использовании инфликсимаба (анти-TNFa), что согласуется с представлениями об участии TNFa в патогенезе бронхиальной астмы.
Использование моноклональных антител в иммунотерапии
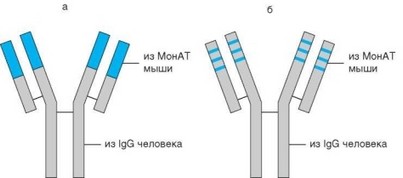
Выше мы рассмотрели несколько примеров использования моноклональных антител к цитокинам в иммунотерапии воспалительных заболеваний. Другая важная область применения лечебных препаратов на основе моноклональных антител — онкология, в особенности лечение лейкозов. С этой целью используют антитела к мембранным молекулам, характерным для клеток, вовлеченных в лейкозный процесс, и экспрессированым на них с плотностью, достаточной, чтобы вызвать элиминацию клеток (путем компле- ментзависимого цитолиза, фагоцитоза опсонизированных клеток или антителозависимого контактного цитолиза). Наиболее яркий пример препарата, успешно используемого для лечения хронического В-клеточного лимфолейкоза — препарат мабтера (ритуксимаб) на основе моноклональных антител к мембранной молекуле CD20, являющейся одной из маркерных молекул В-лимфоцитов. Другой пример лечебных моноклональных антител — антитела к молекуле СD52 — СAMPATH. Антитела обоих типов принадлежат к классу IgG, который характеризуется медленным выведением из организма, что облегчает создание необходимой концентарции антител. Все моноклональные антитела, используемые в иммунотерапии, исходно мышиные. Однако с помощью генно-инженерных процедур все их составные части, кроме V-гена или гипервариабельных участков, заменены на человеческие. Такие моноклональные антитела называют гуманизированными (рис. 4.55).
Для лечения солидных опухолей разрабатывают препараты иммунотоксинов — молекул, совмещающих прицельность антител с цитотоксичностью растительных токсинов. Для этого полумолекулу (состава HL) моноклональных антител, специфичных к маркерной молекуле опухоли, ковалентно связывают с токсической субъединицей растительного токсина, чаще всего рицина или винкулина. Благодаря прицельной доставке молекулы иммунотоксина к опухолевой клетке (за счет специфичности активного центра антитела) цитолиз клетки-мишени может быть достигнут при концентрации иммунотоксина, практически безвредной для организма (рис. 4.56). Известны варианты этого подхода — использование вместо токсина радионуклида, комплексирование двух антител с разной специфичностью, направленной против опухолевого антигена и эффекторной клетки (для их сближения). Однако эти подходы при их очевидной привлекательности пока не нашли широкого практического применения из-за недоста-
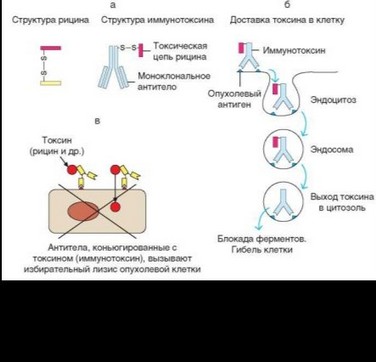
точной эффективности и возможного риска проявления общетоксического эффекта препаратов.
Цитотерапия и генотерапия
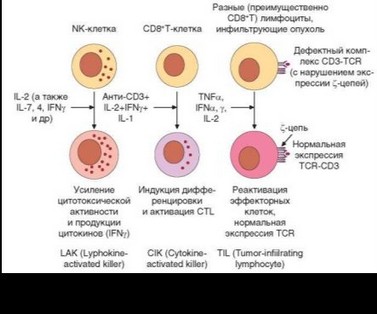
В связи с тем, что цитокинотерапия злокачественных опухолей нередко сопровождается осложнениями, было разработано направление биотерапии, основанное на использовании клеток иммунной системы, обработанных цитокинами вне организма. Оно получило наименование адоптивной (от adoptive — приемный) иммуноцитотерапии (табл. 4.26). Принцип данного подхода состоит в том, чтобы вынести этап действия на иммуноциты токсичных цитоикнов за пределы организма и вводить в него уже активированные аутологичные клетки. Известно 3 варианта клеток, используемых в адоптивной цитотерапии — LAK-, CIK- и TIL-клетки (рис. 4.57). О LAK-клетках неоднократно говорилось выше. Это NK-клетки, стимулированные in vitro IL-2 или другими цитокинами в течение 5—7 сут, в результате чего они приобретают способность лизировать более широкий спектр трансформированных клеток, чем обычные NK-клетки. CIK-клетки — это мононуклеары (или очищенные CD8 + Т-клетки), активированные моноклональными антителами к CD3 с добавлением смеси IL-2, IL-1 и IFNy, что обеспечивает поликлональную пролиферацию только Т-лимфоцитов и их дифференцировку в цитотоксические Т-клетки. O TIL-клетках говорилось выше (см. 4.1.2.3). Реактивация цитокинами in vitro значительно повышает их способность лизировать опухолевые клетки. Главная сложность обусловлена ограниченной доступностью TIL. Эта проблема отпадает при прорастании опухолей в серозные полости, в экссудате которых TIL присутствуют обычно в достаточных количествах. Главная проблема всех методов цитотерапии, помимо трудоемкости получения клеток и риска развития побочных эффектов, — отсутствие методов прицельной доставки вводимых клеток в опухоль.
Таблица 4.26. Клетки, применяемые при адаптивной цитотерапии
|
Название клеток |
Источник |
Индукторы и активаторы |
Механизм действия |
Показания при иммунопатологии |
|
Кроветворные стволовые клетки |
Костный мозг. Кровь |
G-CSF — для мобилизации в кровь |
Замещение дефектов кроветворения и иммунопоэза |
Замещение при иммунодефитах, в частности, после воздействий радиации и химиопрепаратов |
|
Лимфокин- активированные киллеры (LAK) |
Кровь |
IL-2 |
Активированные NK-клетки проявляют повышенную противоопухолевую активность |
Меланома, первичный рак почки, возможно, другие иммунозависимые опухоли |
4.8. Применение методов и принципов иммунологии...
Окончание табл. 4.26
|
Название клеток |
Источник |
Индукторы и активаторы |
Механизм действия |
Показания при иммунопатологии |
|
Цитокин- индуцированные киллеры (CIK) |
Кровь |
Анти-СD3+; совместное действие IL-2, TNFa и IL-1 |
Активированные Т-лимфоциты проявляют повышенную противоопухолевую активность |
То же |
|
Лимфоциты, инфильтрирующие опухоль (TIL) |
Асцит из серозных полостей при прорастании в них опухолей |
Совместное действие TNFa, IL-2, IFNa, IFNy |
Активированные лимфоциты, инфильтрирующие опухоль, реактивируются и проявляют высокую противоопухолевую активность |
Любые злокачественные опухоли |
|
Регуляторные Т-клетки |
Кровь |
IL-2, TGFp, толеро- генные дендритные клетки |
Ослабление аутоиммунных и нормальных иммунных процессов |
Профилактика реакции «трансплантат против хозяина». В перспективе — лечение аутоиммунных процессов, повторных выкидышей и т.д. |
Разрабатывают также методы сочетания цитотерапии с генотерапией. Последняя состоит в переносе клеток, в которые предварительно транс- фецированы гены, кодирующие вещества с противоопухолевой активностью, чаще всего цитокины (IFNy, TNFa, IL-2, IL-12 и др.). Гены могут внедрять в сами опухолевые клетки, в клетки стромы опухоли или в TIL. Трансфецированные клетки вводят в опухоль, в которой они секретиру- ют цитокины, что обеспечивает их оптимальную доставку к мишеням — опухолевым клеткам или эффекторным клеткам иммунной системы.
Генотерапию используют (пока в очень ограниченном масштабе) для лечения первичных иммунодефицитов. Наиболее успешным оказалось использование этого подхода для лечения варианта ТКИН с дефицитом аденозиндезаминазы. В аутологичные клетки костного мозга больного трансфецируют ген ADA и трансплантируют их в организм. При успешном встраивании перенесенных клеток в костный мозг генетический дефект устраняется. Известно несколько других примеров устранения генетических дефектов, являющихся причиной иммунодефицита, с помощью генотерапии — перенос гена у(с)-цепи для устранения Х-сцепленной формы ТКИН и др.
Лечебные вакцины
Лечебные вакцины, предназначенные для терапии злокачественных опухолей, аутоиммунных заболеваний и аллергии, находятся в процессе разработки.
Основой для создания вакцин практически всегда служат дендритные клетки. С их применением связан ряд проблем. Одна из них состоит в получении дендритных клеток избранного типа в достаточных количествах. Существует 2 подхода для выделения и размножения in virto дендритных клеток — их дифференцировка из стволовых клеток или из моноцитов. Последний подход предпочтительнее в связи с большей доступностью исходных клеток — моноцитов. Моноциты культивируют в присутствии GM-CSF и IL-4; для их созревания в систему обычно добавляяют TNFa. Вторая проблема состоит в выборе разновидности клеток для создания вакцины, что определяется поставленными задачами: в случае онковакцин необходимо усилить противоопухолевый иммунитет, при аллергии и аутоиммунных процессах — ослабить аллергическую гиперчувствительность или иммунный ответ на аутоантигены. В связи с этим в качестве основы вакцин используют дендритные клетки различных типов и степени зрелости. Основой онковакцин должны служить зрелые миелоидные дендритные клетки (DC1), желательно стимулированные IL-12 и/или IFNy. При этом желательно дополнительное воздействие на клетки РАМР-содержащих стимуляторов врожденного иммунитета, действующих через TLR. Для получения аллерговакцин и вакцин для подавления аутоиммунных процессов необходимо использовать плазмоцитоидные (DC2) или незрелые миелоид- ные дендритные клетки, дополнительно обработанные IL-10.
Еще одна задача состоит в нагрузке дендритных клеток антигеном. В качестве антигена используют потенциально протективные молекулы — опухолеспецифические антигены или онкофетальные белки, аллергены, потенциальные аутоантигены или другие молекулы, в зависимости

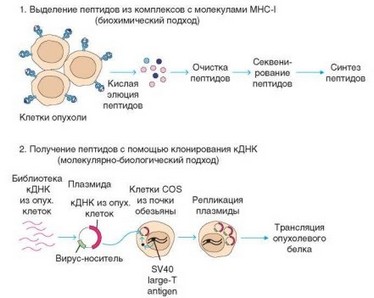
от поставленных задач. Получение необходимых антигенов и пептидов (в частности опухолеассоциированных) для нагузки дендритных клеток решается методами молекулярной биологии (рис. 4.58). Процесс нагрузки должен учитывать особенности клеточной биологии и презентации антигена эффекторным клеткам. Так, в случае аллергических и аутоиммунных вакцин антиген может «подаваться» дендритным клеткам обычным путем, с помощью его введения в среду, из которой клетка может эндоцитировать молекулы и затем презентировать их в составе молекул MHC-II. При создании онковакцин такой путь также можно использовать для получения опухолеспецифических TM-клеток. Однако наряду с этим необходимо формировать путь поступления антигена в цитозоль дендритных клеток. Это позволит презентировать его в составе молекул MHC-I, что необходимо для индукции цитотоксических Т-лим- фоцитов.
РЕЗЮМЕ
Основное назначение иммунной системы — защита организма от патогенов. В этой защите участвуют механизмы врожденного и адаптивного иммунитета: первые полностью обеспечивают ее начальные этапы (первая линия защиты), вторые играют ключевую роль в повышении ее эффективности и специфичности иммунных процессов в эффекторной фазе иммунного ответа и при формировании иммунологической памяти. Характер реакции иммунной системы на возбудителя инфекции во многом определяется локализацией патогена и его природой.
Другие объекты, против которых направлена активность иммунной системы, — злокачественные опухоли. Полагают, что иммунная система обеспечивает удаление многих злокачественных клеток; однако она не может разрушить сформировавшуюся опухоль. Одна из многих причин слабости противоопухолевого иммунитета состоит в отстутствии экспрессии опухолевыми клетками PAMP. Однако такое же отсутсвие PAMP не пряпятствует отторжению генетически чужеродных тканей. Для предотвращения отторжения плода в процессе эволюции сформировались многочисленные механизмы, связанные с функционированием плаценты. Помимо плода, в организме млекопитающих существует ряд других иммунологически привилегированных участков, с большей или меньшей надежностью изолированных от иммунной системы.
Защита собственных тканей организма от повреждающего действия иммунных факторов достигается благодаря наличию аутотолерантности, формирующейся на разных уровнях (удаление аутоспецифических клонов в тимусе, индукция их анергии на периферии, повторная перестройка аутоспецифических рецепторов). Кроме того, активность аутоспецифических клонов блокируют регуляторные Т-лимфоциты. При повреждении механизмов аутотолерантности развиваются аутоиммунные процессы, лежащие в основе многочисленных заболеваний. Другое проявление повышенной активности иммунной системы — аллергия — разновидность гиперчувствительности, при которой взаимодействие антигена (аллергена) с IgE-антителами, фиксированными на тучных клетках, вызывает неадекватную реакцию, обусловленную выбросом содержимого гранул тучных клеток и синтезом активных веществ.
Большую группу заболеваний образуют иммунодефициты. Существует значительное число первичных иммунодефицитов, обусловленных мутациями генов, отвечающих за развитие и функционирование клеток иммунной системы. Приобретенные (вторичные) иммунодефицитные состояния развиваются под влиянием цитотоксических воздействий, голодания, нарушений метаболизма, эндокринной патологии, инфекционных заболеваний, особенно вирусных. Наиболее тяжелая форма приобретенных иммунодефицитов — ВИЧ-инфекция/СПИД, при которых вирус поражает клетки иммунной системы. Наконец, иммуноциты могут претерпеть злокачественное перерождение, что приводит к развитию лейкозов и лимфом.
В практическую медицину активно недряются методы иммунодиагностики, иммунопрофилактики и иммунотерапии. Основная задача профилактической иммунологии — разработка вакцин с целью индукции иммунологической памяти к инфекционным агентам в обход инфекционного заболевания. В последние годы понятие «вакцина» стали трактовать шире, чем в период зарождения иммунологии. Разрабатывают вакцины, предназначенные для лечения злокачественных опухолей, аутоиммунных и аллергических заболеваний. Интенсивно разрабатываются подходы к лечению иммунопатологии и злокачественных опухолей, основанные на использовании принципов и методов иммунологии.
