Иммунологические принципы реализуются в профилактике инфекционных заболеваний и иммунозависимой патологии в форме вакцинации. Наиболее длительную и богатую историю имеет вакцинация с целью предупреждения инфекционных заболеваний. С разработки первых подходов к предупреждению инфекционных заболеваний более тысячелетия тому назад началась предыстория иммунологии, а в конце XIX века успешное создание методов вакцинации породило иммунологию как самостоятельную научную дисциплину.
В главе 1 кратко рассмотрена предыстория иммунологии, однозначно сводимая к истории вакцинации. Около 3 тыс. лет назад впервые письменно упомянуто предупреждение заболевания оспой путем ее прививки, многие столетия использовавшееся (в основном в Азии) в форме вариоляции. В конце ХVШ в. Э. Дженнер разработал безопасный и надежный метод профилактики оспы путем вакцинации — прививки материала, содержащего инфекционный агент коровьей оспы. В 1880 г. Л. Пастер разработал (на примере холеры кур) общие принципы вакцинации с использованием живой ослабленной вакцины. В результате целенаправленного «ослабления» вируса бешенства была получена вакцина, защищающая людей от поражения этим вирусом при заражении в результате укусов животных. После этого деятельность по созданию и использованию вакцин стала непрерывной и кодифицировалась законами.
Первоначальный смысл понятия «вакцина» заключен в следующем определении. Вакцинами называют препараты, предназначенные для формирования иммунологической памяти и протективного иммунитета к антигенам возбудителей, минуя стадию инфекционного заболевания. Вакцинацией называют способ создания протективного иммунитета с помощью вакцин. Расширенное употребление термина «вакцины» (в отношении препаратов с противоопухолевой, противоаллергичекой активностью или направленных на лечение аутоиммунных заболеваний) заставляет несколько изменить акценты. В этом, новом смысле под вакцинами следует понимать препараты, содержащие антигенный материал, направленные на предотвращение и лечение инфекционных, опухолевых процессов, а также проявлений гиперчувствительности путем индукции эффекторных клеток и клеток памяти, оказывающих защитное действие. В этом разделе речь пойдет о противоинфекционных вакцинах.
Различают несколько развновидностей вакцин, характеристики которых представлены в табл. 4.22. Исходный вариант вакцин, введенный в практику Л. Пастером, представляет живые аттенуированные (ослабленные) вакцины. Пастер использовал для этого культивирование в неблагоприятных условиях. Очевидно, причиной ослабления вирулентности послужили серии мутаций, обеспечивавших приспособление микроорганизма к измененной среде обитания с утратой качеств, которые в этих условиях не давали преимуществ (патогенности, вирулентности). Такие вакцины, как правило, эффективны, но всегда существует опасность реверсии с восстановлением патогенности и вирулентности. Кроме того, при ослабенном иммунитете (например, при первичных иммунодефицитах у детей) даже аттенуированные патогены могут вызвать инфекционный процесс. Вариант такого подхода — противооспенная вакцина Э. Дженнера, полученная на основе вируса коровьей оспы, который у человека вызывает слабовыраженное заболевание, но, в силу перекрестной антигенной реактивности, обеспечивает иммунитет против вируса человеческой оспы.
Таблица 4.22. Разновидности вакцин
|
Тип вакцины |
Характеристика |
Примеры |
|
Живые ослабленные (аттенуированные) |
Вирулентность патогенов снижена разными способами, в частности культивированием в неблагоприятных условиях. Вакцины эффективны, но сохраняют опасность реверсии |
Вакцины против оспы, краснухи, кори, полиомиелита (вакцина Сэбина), герпеса, БЦЖ |
|
Убитые |
Патогены убиты различными способами (формалином и др.). Вакцины менее эффективны, чем живые |
Вакцины против бешенства, тифа, холеры, полиомиелита (вакцина Солка), коклюша |
|
Антитоксические |
Анатоксин, или токсоид (инактивированный токсин) в сочетании с адъювантом |
Вакцины против дифтерии, столбняка |
|
Синтетические |
Синтетический эпитоп, конъюгированный с иммуногенным носителем или адъювантом |
Вакцины против сальмонеллеза, йерсиниоза, ящура, гриппа |
|
Рекомбинантные |
Основаны на использовании методов молекулярной генетики. Выделенный ген протек- тивного антигена вводят в безопасный вектор. Гены вирулентности удаляют с сохранением протектив- ных генов и т.д. |
Вакцины против гриппа, герпеса, везикулярного стоматита и т.д |
|
ДНК-вакцина |
Плазмиду, содержащую ген протективного антигена, вводят в мышцу, в клетках которой он экспрессируется |
Вакцины против гепатита В |
|
Идиотипические |
Вместо антигена используют антиидиотипические антитела, воспроизводящие конфигурацию эпитопа |
Экспериментальные вакцины |
Другой распространенный вид традиционных вакцин — убитые вакцины — предложен Р. Пфеффером (R. Pfeiffer) и У Колле (Ж Kolle) также в конце XIX века. Убитые вакцины в принципе не могут вызвать инфекционных осложнений, но они могут быть токсичны, аллергенны и иметь другие побочные эффекты, обычно обусловленные примесями. Метод, применяемый для того, чтобы убить патогены, не должен вызывать инактивацию протективных антигенов. Такие вакцины используют для профилактики сальмонеллеза, брюшного тифа и ряда других заболеваний, особенно вызываемых внеклеточными патогенами. Убитые вакцины более безвредны, но, как правило, менее эффективны, чем ослабленные, что связано с отсутствием самоподдержания микробных клеток.
Логическое развитие принципа использования убитых микроорганизмов — их фракционирование и включение в вакцинный препарат субклеточных компонентов, содержащих протективные антигены (субъединичные вакцины). Следующим шагом на этом пути стало создание химических вакцин путем выделения активных молекул или их химического синтеза.
Вариант вакцин — препараты на основе продуктов микроорганизмов — токсинов, предназначенные для их инактивации. В интактном виде использовать токсины невозможно в связи с их токсичностью. Для вакцинации применяют анатоксины — токсины, инактивированные обработкой формалином или иными агентами, устраняющими токсичность с сохранением антигенности. Широко распространена вакцинация дифтерийным, столбнячным и другими анатоксинами. Нередко вакцинные препараты содержат комбинацию из вакцин против различных возбудителей и их анатоксинов; при таком комбинировании может происходить взаимное усиление (адъювантность) отдельных компонентов вакцин. Классический пример такой комбинации — вакцина АКДС, содержащая дифтерийный анатоксин, столбнячный анатоксин и убитые Bordetella pertussis.
В последние десятилетия наметились коренные изменения в подходах к способам создания вакцин. Наиболее перспективным выглядит направление, основанное на использовании генно-инженерных подходов. Это позволяет, предварительно «разобрав» гены возбудителя, исключить из генома гены вирулентности и сохранить гены, кодирующие протективные антигены (рис. 4.52). В качестве вектора, в который вводят переконструированные гены, часто используют вирус осповакцины, сам по себе способствующий формированию гуморального и клеточного иммунного ответа.
Другой способ создания вакцин нового типа состоит в конструировании комплекса полностью синтетических субъединиц, одни из которых несут В-клеточные эпитопы, другие служат источником Т-клеточных эпитопов, а третьи отвечают за активацию клеток врожденного иммунитета. При этом структуру В-эпитопов могут воспроизводить синтетические пептиды или полисахариды, сами по себе не иммуногенные, но приобретающие эти свойства в комбинации с другими компонентами системы. При всей рациональной безукоризненности таких подходов для них характерна более слабая иммуногенность, чем для традиционных вакцин. Очевидно, это результат неполноты знаний о природе антигенности и иммуноген- ности, в связи с чем конструируемые таким образом вакцинные препараты
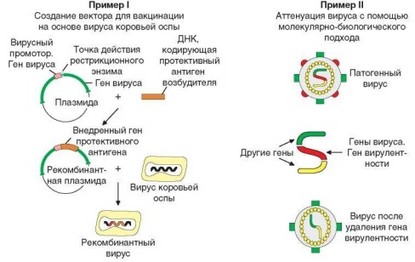
Рис. 4.52. Использование молекулярно-биологических подходов для создания вакцинных препаратов. Приведены примеры использования молекулярной инженерии для конструирования вакцин. Пример I иллюстрирует создание рекомбинантной вакцины. Сначала формируют плазмиду — путем внедрения гена, кодирующего антиген, под промотор другого гена, что дает преимущества при дальнейших манипуляциях. Полученную плазмиду внедряют в «нейтральный» вирус, в качестве которого обычно используют вирус коровьей оспы, используемый как носитель. Получаемый рекомбинантный вирус применяют как основу рекомбинантной вакцины. Пример II иллюстрирует принцип модификации генов возбудителя (обычно вируса) с целью лишения его вирулентности. Для этого гены вируса «разбирают», удаляют гены вирулентности и снова «собирают». В результате устраняются отрицательные эффекты вируса с сохранением его антигенов, обеспечивающих протективный эффект вакцины
не содержат некоторых, пока неизвестных компонентов, обязательных для обеспечения иммуногенности в полной мере. По мере пополнения знаний в этой области будут совершенствоваться вакцины такого рода. Так, недавно установленный факт зависимости адаптивного иммунного ответа от стимуляции врожденного иммунитета «образами патогенности» (РАМР) уже сейчас учитывается при построении новых вакцинных препаратов.
Адъюванты
Проблему усиления иммуногенности вакцин, а также препаратов, используемых в экспериментальной практике, обычно решают с помощью использования адъювантов — веществ, усиливающих иммунный ответ при введении одновременно с иммуногенами. Данные по адъювантам представлены в табл. 4.23. Различают несколько групп адъювантов — минеральные (алюминиевые квасцы — Al(OH)2 и др.), растительные (сапонины), микроб
ные (ЛПС, полисахариды, пептидогликаны, CpG-содержащие нуклеиновые кислоты, ослабленные микроорганизмы — БЦЖ,и т.д.), синтетические (полиэлектролиты и т.д.), цитокины, комплексные транспортные системы (липосомы, ISCOM и т.д.).
Таблица 4.23. Адъюванты
|
Название |
Примеры |
Состав |
Механизм действия |
Преобладающий тип ответа |
|
Минераль ные |
Алюминиевые квасцы |
Соли или гидроокись алюминия и кальция |
Депонирование, усиление фагоцитоза |
^2-зависимый |
|
Масляные эмульсии |
МF59, MPL, AS, полный и неполный адъюванты Фрейнда |
Вазелиновое масло, ланолин, эмульгатор (адъюванты Фрейнда; в полном адъюванте — содержатся микобактерии) |
Депонирование, стимуляция через паттернрас- познающие рецепторы |
Th1- (полный адъювант Фрейнда), ^2-зависимый (неполный адъювант Фрейнда) |
|
Липидные |
Липосомы, ниосомы, иммуности мулирующие комплексы |
Липидные частицы различного состава, в которые введен антиген |
Направленная достатвка антигена в клетки, например в цитотоксические Т-лим- фоциты при использовании иммуностимулирующих комплексов |
Цитоткосический, Th1-зависимый |
|
Нано частицы |
Дендримеры, полимерные наночастицы |
Наночастицы различных конструкций, в которые включен антиген |
Векторная доставка антигена в клетки |
Th1- и ^2-зависи- мый |
|
Вирусо подобные частицы |
На основе различных вирусных векторов |
Вирус без генетического материала, содержащий антиген |
Векторная доставка антигена в клетки |
TM-зависимый, цитотоксический |
Можно выделить несколько механизмов усиливающего действия, в разных комбинациях реализуемых в различных адъювантах. Это формирование депо антигена, удлиняющего срок его воздействия на иммунную систему, оптимальная доставка антигена, прямое стимулирующее действие на клетки иммунной системы и т.д. Однако с современных позиций важнейшим представляется комплекс механизмов, обеспечивающих развитие воспаления и стимуляцию механизмов врожденного иммунитета, особенно активности АПК, что в конечном счете стимулирует презентацию антигена Т-лимфоци- там. Относительный вклад этого комплексного механизма и формирования депо в обеспечение адъювантных свойств препаратов наглядно иллюстрируют эффекты неполного и полного адъювантов Фрейнда. Первый представляет смесь ланолина, вазелинового масла и эмульгатора, второй содержит эти же комопненты, но с добавлением БЦЖ — вакцинного штамма микобактерий (Micobacterium bovis). Для эффективной индукции первичного иммунного ответа обычно используют полный адъювант Фрейнда, для поддержания высокого уровня ответа на повторные иммунизации — неполный адъювант Фрейнда. Наиболее ответственный и «трудный» этап в развитии иммунного ответа — презентация антигена наивным Т-клеткам, осуществление которой невозможно без предварительной стимуляции клеток врожденного иммунитета, прежде всего дендритных клеток. Вероятно, реализации этой функции способствует воздействие на иммунную систему БЦЖ. После преодоления этого этапа вполне достаточным оказывается правильное дозирование антигена, медленно и длительно поступающего из депо, создаваемого липидной составляющей адъюванта.
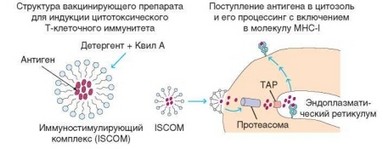
Состав адъюванта определяет не только общий иммуностимулирующий эффект, но и тип индуцируемого иммунного ответа (гуморальный или клеточный, опосредованный CD4+ или CD8+ Т-клетками). Так, использование провоспалительных стимулов (БЦЖ, другие микроорганизмы, вводимые в адъювант) способствует развитию воспалительной формы T-клеточного ответа, опосредованной TM-клетками. Усиление тимусзависимого гуморального иммунного ответа, опосредованного ^2-клетками, при этом также происходит, но его в большей степени стимулируют минеральные адъюванты, например, алюминиевые квасцы. Для усиления CD8+ Т- клеточного ответа необходимо создавать условия, благоприятствующие проникновению антигена в цитозоль, что обеспечивает его включение в молекулы MHC-I, презентирующие пептидный эпитоп CD8+ Т-клеткам. Таким адъювантом служат комплексы ISCOM (Immune stimulatory complexes), в которых антигены (в типичном случае вирусные) связаны с мицеллами гликозида Quil A в составе везикул, обеспечивающих трансмембранное проникновение антигена в цитозоль (рис. 4.53). Для облегчения доставки антигена в эндосомальный компартмент используют липидные пузырьки — липосомы, заполненные антигенным материалом.
Адъюванты нередко включают в состав вакцин для усиления иммуно- генности последних — при обязательном условии их безвредности. В связи с этим не все адъюванты разрешено включать в вакцины. Чаще всего с этой целью используют квасцы. Применение адъювантов Фрейнда — наиболее сильных адъювантов — запрещено в связи с их сильной реактогенностью.
В 70-е годы прошлого века Р.В. Петровым и Р.М. Хаитовым был разработан принцип создания полностью синтетических вакцин на основе пептидов, конъюгированных с носителем, который представляет собой адъювант. Первоначально в роли адъювантов использовали полиэлектролиты, но проблемы, связанные с их побочными эффектами, а также низкой дегра- дируемостью определили выбор другого адъюванта — полиоксидония, син-

тезированного в 80-е годы А.В. Некрасовым. Полиоксидоний (азоксимера бромид) представляет сополимер ^-окси)-1,4-этиленпиридина и (N-кар- бокси)-1,4-этиленпиперазинбромида. Его используют как самостоятельно в виде адъюванта, так и в составе вакцин. Наиболее известна вакцина против гриппа Гриппол, разработанная в 1988 г. Это полимер-субъединичная вакцина, которая содержит гемагглютинин и нейраминизаду вирусов гриппа А (НШ1, H3N2) и В, конъюгированные с полиоксидонием.
Существует еще несколько разновидностей современных вакцин, которые, однако, пока не нашли широкого практического применения, хотя их очень интенсивно исследуют в экспериментальных моделях. Одна из таких разновидностей — ДНК-вакцины. Они представляют бактериальные векторы, содержащие гены протективных антигенов, против которых нужно индуцировать иммунитет. Вакцины вводят в мышцу, в клетках которой происходит экспрессия генов и синтез антигенных белков. Механизмы реализации этих процессов в мышцах не до конца раскрыты.
Наконец, есть довольно экзотический вариант создания вакцин на основе антиидиотипических антител. Рассматривая природу идиотипии и ее роль в регуляции гуморального иммунного ответа, был отмечен факт, что при максимально возможном совпадении структур активного центра антител и идиотопа конфигурация активного центра антиидиотипических антител и эпитопа должны совпадать. Именно поэтому, когда использование нативных молекул патогенов по той или иной причине затруднено, теоретически можно применять вместо них антиидиотипические антитела. На этой основе создана вакцина против вируса гепатита В, однако ее эффективность оказалась невысокой. Антиидиотипические вакцины до сих пор остаются примером скорее остроумного движения мысли исследователей, чем реальным инструментом противоинфекционной защиты.
Вакцины — медицинские препараты, предназначенные для массового использования преимущественно у детей. В связи с этим существуют достаточно жесткие требования к вакцинным препаратам:
- наличие доказанного защитного эффекта — вакцины должны предотвращать развитие инфекционных заболеваний после заражения, эффект должен быть длительным (годы);
- безвредность — вакцина сама по себе не должна вызывать патологических эффектов;
- дешевизна;
- стабильность;
- простота использовнаия.
Вакцинация — узаконенная процедура (с учетом ограничений по медицинским показаниям). В нашей сторане действует закон от 1998 г. «Об иммунопрофилактике инфекционных болезней человека», в котором констатировано, что вакцинация составляет часть государственной политики в области здравоохранения. В нем оговорены правила проведения плановых прививок и прививок по эпидемиологическим показаниям. Во всех странах имеются календари прививок, содержащие перечни вакцин, предназначенных для плановой массовой вакцинации населения и правила их использования. В России календарем прививок предусмотрено проведение плановых прививок с применением 7 вакцин против 11 инфекционных заболеваний (табл. 4.24).
Таблица 4.24. Вакцины календаря обязательных прививок Российской Федерации (по Медуницын Н.В. Вакцинология. — М., 1999)
|
Вакцина |
Природа антигена |
Форма вакцины |
Наличие адъюванта |
Наличие стабилизаторов, консервантов |
Природа иммунитета |
|
БЦЖ |
Аттенуированные живые Micobacte- rium bovis |
Сухая |
Нет |
Нет |
Клеточный |
|
АКДАС |
Дифтерийный анатоксин; столбняч ный анатоксин; убитые Bordetella pertussis |
Жидкая |
Al(OH)2 |
Мертиолят (консервант) |
Гуморальный и клеточный |
|
Полиомие литная |
Аттенуированные живые вирусы трех типов |
Жидкая |
Нет |
Стабилиза торы |
Гумораль ный |
|
Коревая |
Аттенуиро ванный живой вирус |
Сухая |
Нет |
Антибиотики, стабилизаторы |
Гумораль ный |
Окончание табл. 4.24
|
Вакцина |
Природа антигена |
Форма вакцины |
Наличие адъюванта |
Наличие стабилизаторов, консервантов |
Природа иммунитета |
|
Паротитная |
Аттенуиро ванный живой вирус |
Сухая |
Нет |
Антибиотики, стабилизаторы |
Гумораль ный |
|
Против гепатита В |
НВв-антиген |
Жидкая |
Al(OH)2 |
Мертиолят (консервант) |
Гумораль ный |
|
Против крансухи |
Аттенуиро ванный живой вирус |
Сухая |
Нет |
Антибиотики, стабилизаторы |
Гумораль ный |
Первичную плановую иммунизацию осуществляют в различные сроки на протяжении первых лет жизни. Вакцину БЦЖ и вакцину против гепатита В вводят в первые дни после рождения, АКДАС — в возрасте 3 мес, противовирусные вакцины — через 12—15 мес после рождения (ранее эффекту вакцинации препятствуют антитела материнского происхождения, присутствующие в сыворотке крови ребенка). Первую иммунизацию проводят в виде 2—3 инъекций с интервалом 4 нед. Через несколько лет осуществляют бустерную иммунизацию, предназначенную для поддержания и усиления эффекта первой вакцинации. Основной путь введения вакцин — подкожный (реже внутримышечный). Значительные усилия прилагают для создания мукозальных (пероральных, назальных и т.д.) вакцин. Дозы вакцин и интервалы между введениями строго регламентированы.
Побочное действие вакцин может состоять в недомогании, умеренном повышении температуры, местных реакциях, реже развивается расстройство сна, боли в суставах, головная боль, рвота, обмороки. В большинстве случаев побочные реакции вызывают примеси, содержащиеся в вакцинных препаратах. Однако часть из них связана с действием провоспалительных факторов, неотделимых от активной составляющей вакцин. Так, реактогенность вакцины АКДАС обусловлена ее коклюшным компонентом. Более тяжелые последствия вакцинации квалифицируют как осложнения. Особую группу побочных эффектов образует поствакцинальный инфекционный процесс, обусловленный живыми ослабленными патогенами. Осложнения вакцинации разделяют на три группы — токсические, аллергические и поражение нервной системы. В единичных случаях (примерно 1:1 000 000) они могут вызвать гибель вакцинированных. Противопоказаниями к вакцинации служат иммунодефицитные состояния, осложнения и сильные реакции на предыдущую вакцинацию, аллергия к вакцинным препаратам.
Единичные осложнения вакцинаций и даже крайне редкие случаи смертельного исхода несосопоставимы с поистине глобальным положительным эффектом. Вакцинации сделали современный цивилизованный мир практически свободным от смертоносных эпидемий и резко снизили смертность от инфекционных заболеваний, особенно в детском возрасте.
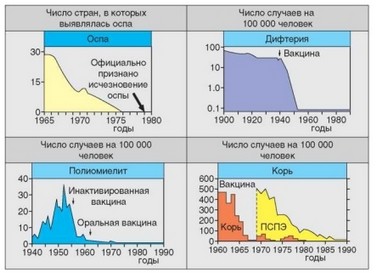
Рис. 4.54. Последствия успешной вакцинации против оспы, полиомиелита и кори. Внедрение адекватных методов вакцинации приводит к резкому снижению как случаев заболеваний, непосредственно вызываемой патогеном, так и осложнений от этих заболеваний (см. вариант с корью; ПСПЭ — подострый склерозирующий панэнцефалит)
На рис. 4.54 приведены графические иллюстрации, свидетельствующие о непосредственной связи резкого снижения частоты ряда инфекционных заболеваний (а также — в случае кори — и их типичных осложений) сразу после начала широкого применения вакцин. Благодаря вакцинации ликвидировано одно из особо опасных инфекционных заболеваний — оспа. Однако до сих пор существуют инфекции, в том числе и особо опасные, против которых эффективные вакцины не разработаны. К ним относят чуму, сифилис, гонорею, малярию, проказу, СПИД и др.
Вакцина против СПИДа
Наиболее акутальная и одновременно трудная задача вакцинологии — создание вакцины против СПИДа. Два обстоятельства резко затрудняют решение этой задачи:
- чрезвычайно высокий темп мутирования белков ВИЧ, особенно поверхностных, которые могут служить оптимальной мишенью для антител и эффекторных Т-лимфоцитов;
- поражение при СПИДе CD4+ Т-лимфоцитов — центральных клеток адаптивного иммуногенеза.
Определенные надежды на успех получения вакцин против СПИДа порождают данные, свидетельствующие о случаях резистентности к заражению и формирования у ВИЧ-инфицированных иммунитета, достаточного для замедления прогрессии заболевания. В пользу возможности создания
эффективных вакцин против СПИДа свидетельствуют также случаи успешной вакцинации обезьян, обеспечивающие устойчивость к вирусам SIV и SHIV (соответственно, обезьяний и рекомбинантный обезьяний/челове- ческий вирусы). Тем не менее проблематичность решения данной задачи в каждом конкретном случае подчеркивает сам термин, используемый для обозначения создаваемых вакцин — «кандидатные вакцины».
При разработке кандидатных вакцин против СПИДа используют стратегию, направленную на решение двух задач (отдельно или в сочетании) — индукции эффективных нейтрализующих антител или развитие Т-клеточного ответа (как правило, на основе цитоткосических CD8+ Т-лим- фоцитов), способного если не элиминировать, то сдерживать инфекцию. Наиболее привлекательным для построения вакцин было использование консервативных эпитопов (например, сайта связывания с корецептором или консервативных эпитопов белка gp41), однако проблема осложняется слабой доступностью этих эпитопов для действия нейтрализующих антител. На современном этапе разработки вакцины отрабатывают пути создания как лечебных, так и профилактических вакцинных препаратов.
Процесс создания и испытания вакцин против СПИДа осуществляется под контролем Глобального вакцинного центра (Global HIV/AIDS vaccine enterprise). Большинство кандидатных вакцин имеют в качестве основы ДНК-вектор или рекомбинантные белки и их комбинации. Чаще всего в них воспроизводятся эпитопы белков Gag и Pol. Живые аттенуированные вакцины, показавшие наибольшую эффективность на обезьянах, не могут быть использованы на людях из соображений безопасности. Для индукции Т-клеточного иммунитета применяют подходы, основанные на использовании дендритных клеток, нагруженных антигенами. В состав таких вакцинных препаратов вводят компоненты, стимулирующие (через TLR и другие патогенраспознающие рецепторы) врожденный иммунитет. Широко используют различные адъюванты, в том числе новые. Значительная часть кандидатных вакцин основана на использовании ДНК-плазмид.
В процессе доклинического испытания вакцин очень большое внимание уделяют отработке оптимальных моделей на животных с заражением ВИЧ, а также методов тестирования различных звеньев иммунитета. Экспериментальный анализ позволил избрать в качестве оптимального способа иммунизации схему «прайм-буст», т.е. двукратное введение вакцины, причем на первом и втором этапах могут быть использованы разные препараты. Как правило, праймирование осуществляется введением ДНК-вакцины, а бустирование — введением рекомбинантного белка.
К концу 2007 г. 31 кандидатная вакцина прошла I (или I/II) этап и пять вакцин — II или II и III этапы клинических испытаний.
В ряду испытуемых вакцин следует назвать отечественную кандидатную вакцину ВИЧРЕПОЛ, созданную совместными усилиями Института иммунологии ФМБА и Института вирусологии РАМН (Москва) в ходе выполнения научной программы «Вакцины нового поколения и медицинские диагностические системы будущего». Основой вакцины служит химерный рекомбинантный белок rec, содержащий последовательности полноразмерного внутреннего белка р24 (продукт гена Gag) и иммунореактивный фрагмент белка gp41 (продукт гена Env). Присутствие в вакцине эпитопа gp41 рассчитано на индукцию нейтрализующих антител, а наличие эпитопа р24 — на развитие Т-клеточного иммунного ответа. В качестве адъюванта вакцина содержит полиоксидоний (см. раздел 4.8.3.1) — полимерный иммуномодулятор, с которым конъюгирован антиген. Доклинические испытания констатировали способность вакцинного препарата индуцировать сильный гуморальный иммунный ответ с образованием антител, взаимодействующих с эпитопами, содержащимися в препарате, и содержащими их белками ВИЧ. Клинические испытания вакцины начаты в 2006 г.
В России созданы и испытываются еще две вакцины против СПИДа — КомбиВИЧвак (инъекционная форма) и САЛ-ВИЧ (суппозиторий для мукозальной иммунизации), разработанные в Центре вирусологии и биотехнологии «Вектор». КомбиВИЧвак представляет собой вирусоподобную частицу, внутри которых содержится плазмида pcDNA-TCI (кодирует несколько эпитопов ВИЧ), а на поверхности — белок ТВ!, содержащий 4 Т-эпитопа и 5 В-эпитопов, присутствующих в разных белках ВИЧ. САЛ-ВИЧ представляет аттенуированные клетки Salmonella enteritidis, содержащие плазмиду рсDNA-TCI.
Противоопухолевые профилактические вакцины
Создание профилактических противоопухолевых вакцин — реальная цель иммуноонкологов. До недавнего времени работа в этом направлении не выходила за рамки экспериментальных исследований. Недавно создана первая профилактическая противоопухолевая вакцина — вакцина против папилломавируса, предотвращающая развитие рака шейки матки. Таким образом, фактически эта вакцина в равной степени относится к инфекционной и онкологической областям и создана по правилам, разработанным для других противовирусных вакцин. Тем не менее ее предназначение коренным образом отличается от целей традиционных вакцин, поскольку она участвует в предупреждении развития не инфекционного заболевания, а опухоли.
Вакцинацию осуществляют в виде инъекций вакцинного препарата девочкам в возрасте 12—13 лет (в некоторых странах возраст первой вакцинации — 9 лет). В последние годы вакцинацию против папилломавируса стали осуществлять и в России. Пока она не входит в разряд обязательных.
