Растворимые антитела и мембранные иммуноглобулиновые рецепторы различаются только строением своей С-концевой части. В этой главе рассмотрим общие структурные особенности мембранных и растворимых молекул иммуноглобулинов.
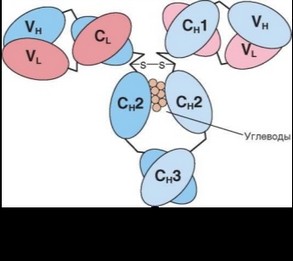
Молекулы иммуноглобулинов состоят из двух типов полипептидных цепей — тяжелых (H — heavy) и легких (L — light). Так называемый мономерный иммуноглобулин содержит две Н- и две L-цепи, расположенные симметрично и соединенные дисульфидными связями (рис. 3.1). Единственная дисульфидная связь, соединяющая Н- и L-цепи, локализуется недалеко от С-конца легкой цепи. Н-цепи скрепляются различным числом дисульфидных связей, о чем будет сказано ниже. Молекулу иммуноглобулина можно разрушить до отдельных полипептидных цепей восстановлением дисульфидных связей дитиотреитолом или меркаптопурином. Легкие цепи содержат 2, а тяжелые — 4—5 гомологичных сегмента — домена. Эти сегменты образованы примерно 110 аминокислотными остатками и имеют сходную пространственную организацию, стабилизированную одной дисульфидной связью, но различные функции. Молекулярная масса L-цепей — 50—60 кДа, Н-цепей — 100—120 кДа, мономера иммуноглобулина — 150—170 кДа.
Во всех цепях N-концевой домен участвует в распознавании антигена. Главную роль при этом играет пространственное соответствие, или комплементарность, антигенраспознающей части молекулы иммуноглобулина с распознаваемым эпитопом. Специфичность иммуноглобулинов определяется первичной структурой антигенраспознающих доменов, называемых вариабельными, или V-доменами (от variable). V-домены тяжелых и легких цепей (VH и VL) участвуют в формировании антигенсвязывающего участка, или активного центра антител.
Структура остальных доменов молекулы иммуноглобулина постоянна. Поэтому их называют константными, или С-доменами (от constant). В состав L-цепи входит 1 С-домен (Q) Н-цепей — 3 или 4 С-домена (CH1, CH2 и т.д.). С-домены определяют эффекторные функции иммуноглобулинов, не связанные с распознаванием антигена, а предназначенные для взаимодействия с рецепторами клеток, активации комплемента и т.д., что необходимо для реализации эффекторных функций антител.
Протеазы расщепляют молекулы иммуноглобулинов на фрагменты, при этом под воздействием разных протеаз можно получить различные продукты (рис. 3.2). Так, папаин расщепляет молекулы иммуноглобулинов на 2 типа фрагментов — Fab (Fragment antigen binding) и Fc (Fragment cristallizable). Из молекулы выщепляется два Fab-фрагмента и один Fc-фрагмент. Как сле-
б
дует из названия, Fab-фрагмент сохраняет способность связывать антиген, поскольку содержит активный центр антител (V-домены обеих цепей, CL- и C^-домены). Fc-фрагмент включает остальные С^-домены, скрепленные дисульфидными связями. Название Fc-фрагмента определило обозначение рецепторов, распознающих «хвостовую» часть антител — Fc-рецепторы. Другой протеолитический фермент — пепсин — расщепляет молекулу ближе к С-концу Н-цепей, чем папаин, — «ниже» дисульфидных связей, скрепляющих Н-цепи. В результате при действии пепсина образуется двухвалентный антигенсвязывающий F(ab’)2-фрагмент и укороченный Fc’-фрагмент.
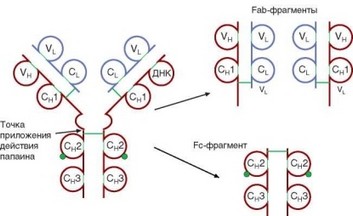
Рис. 3.2. Фрагментация молекулы IgG с помощью папаина. Схематически представлено формирование протеолитических фрагментов Fab и Fc
Выделяют два типа L-цепей — к и X, различающиеся строением ^-домена. Строение СН-доменов обусловливает разделение Н-цепей и молекул иммуноглобулинов на изотипы, или классы, первоначально идентифицированные серологически (т.е. с помощью сывороточных антител к различным изотипам). Выделяют 5 основных изотипов Н-цепей — ц, у, а, 5 и е. Каждая молекула иммуноглобулина может содержать Н-цепи только одного изотипа. В зависимости от структуры Н-цепей выделяют 5 классов молекул иммуноглобулинов — IgM, IgG, IgA, IgD и IgE (латинские буквы в названии иммуноглоублинов соответствуют греческим в обозначении изотипов Н-цепей). Иммуноглобулины классов IgG и IgA разделяют на подклассы (субтипы), также в зависимости от особенностей Н-цепей. У человека выделяют 4 подкласса IgG — IgG1, IgG2, IgG3, IgG4 (у мышей — IgG1, IgG2a, IgG2b, IgG3) и 2 подкласса IgA — IgA1 и IgA2. Н-цепи этих подклассов иммуноглобулинов обозначают соответствующими греческими буквами с цифрой (у1, у2, у3, у4, а1, а2). Иммуноглобулины всех классов могут принадлежать к К- и L-типам в зависимости от присутствия в их составе L-цепей к- или X-типов соответственно. У человека соотношение K- и L-типов составляет 3:2. Данные о свойствах иммуноглобулинов разных классов и подклассов представлены в табл. 3.1 и отражены на рис. 3.3.
Таблица 3.1. Свойства иммуноглобулинов
|
Свойство |
IgM |
IgG |
IgA |
IgD |
IgE |
|
Молекулярная масса, кДа |
950 |
150; IgG3 — 165 |
150; димер — 300 |
185 |
190 |
|
Число мономеров |
5 |
1 |
1 или 2 |
1 |
1 |
Окончание табл. 3.1
|
Свойство |
IgM |
IgG |
IgA |
IgD |
IgE |
|
Валентность |
5 |
2 |
2 или 4 |
2 |
2 |
|
Изотип Н-цепи |
В |
Y |
а |
8 |
s |
|
Число С-доме- нов в Н-цепи |
5 |
4 |
4 |
4 |
5 |
|
Число S-S связей между Н-цепями |
4 |
3-12* |
4 или 5 |
1 |
3 |
|
Содержание углеводов, % |
12 |
3 |
8 |
13 |
12 |
|
Содержание в сыворотке, мг/мл |
1,5 |
13-14** |
3,5*** |
0,03 |
0,00002 0,0005 |
|
Срок полужизни, сут |
5-10 |
23; IgG3 - 7 |
6 |
3 |
2 |
|
Скорость синтеза, мг/кг в сутки |
7,9 |
34 |
66 |
0,4 |
0,0016 |
|
Активация комплемента |
Классический путь |
Классический путь(кроме IgG4) |
|
|
|
|
Клетки, связывающие иммуноглобулин через FcR |
|
Макрофаги/ моноциты, нейтрофилы |
Макрофаги/ моноциты, нейтрофилы (слабо) |
|
Тучные клетки, базофилы |
|
Функции |
Мембранный рецептор. Первичный иммунный ответ |
Вторичный иммунный ответ; защита от бактерий и вирусов |
Преобладающий класс в секретах слизистых оболочек |
Мемб ранный рецептор |
Реагины; защита от паразитов |
* - IgG1 - 3; IgG2 - 5; IgG3 - 13; IgG4 - 3. ** - IgG1 - 9; IgG2 - 3; IgG3 - 1; IgG4 - 0,5. *** - IgA1 - 3; IgA2 - 0,5.
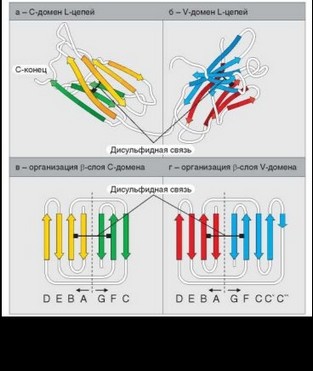
Домены иммуноглобулинов представляют собой глобулы, образованные двумя слоями, содержащими несколько р-складок. В С-домене P-слои содержат 4 и 3 р-складки, в V-домене — оба слоя состоят из 4 р-складок. Схема взаимного расположения р-складок отражена на рис. 3.4. Между слоями есть дисульфидная связь, соединяющая складки В и F и стабилизирующая структуру домена. Аналогичные домены парных полипептидных цепей повернуты на 180° относительно друг друга. Противоположную ориентацию имеют также соответствующие домены Н- и L-цепей. Домены контактируют друг с другом при помощи гидрофобных взаимодействий.
Суперсемейство иммуноглоублинов
Такая схема строения доменов (два параллельных организованных определенным образом p-слоя, соединенных дисульфидной связью) очень широко распространена в структуре молекул, функционально значимых для иммунной системы, — молекул суперсемейства иммуноглобулинов (IgSF). По числу и взаиморасположению слоев выделяют домены C- и V-типов. V-тип подразумевает определенный способ взаиморасположения р-складок, а не вариабельность молекулы (свойственная этим доменам только в составе антигенраспознающих структур — иммуноглобулинов и TCR). На рис. 3.5 представлены некоторые представители обширного суперсемейства иммуноглобулинов. В некоторых случаях молекулы имеют смешанный состав и содержат наряду с иммуноглобулиновыми структурно отличные домены. Пример таких «комбинированных» молекул — MHC, в которых только прилежащие к мембране домены принадлежат к суперсемейству иммуноглобулинов, а дистальные имеют иную конфигурацию.
Наиболее древний и простой представитель этого семейства — молекула Thy-1, экспрессируемая у человека в основном на нервных клетках, а у мышей — также на кроветворных клетках и Т-лимфоцитах. Эта молекула содержит единственный домен V-типа. По-видимому, суперсемейство иммуноглобулинов возникло до зарождения адаптивной иммунной систе-
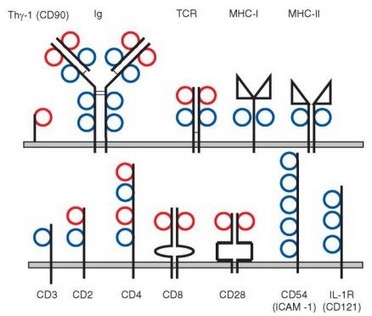
Рис. 3.5. Суперсемейство иммуноглобулинов. Синие кружки обозначают С-домены; красные — V-подобные домены. Значки иной формы означают, что домен не относится к суперсемейству иммуноглобулинов
мы (об этом свидетельствует наличие молекул с такой структурой у беспозвоночных), но широко использовалось при ее формировании. Наблюдаемое у позвоночных разнообразие членов этого семейства возникло в результате сочетания дупликаций генов с точечным мутационным процессом.
