V-домены Н- и L-цепей содержат 4 участка с относительно постоянным составом, называемые каркасными участками, и 3 высоковариабельных участка, называемые гипервариабельными (рис. 3.6). Положение гипервариабельных участков варьирует в различных цепях; оно примерно соответствует расположению 25—35, 50—60 и 93—102 аминокислотных остатков. Поскольку эти участки играют ключевую роль в распознавании и связывании антигена, их еще называют участками, определяющими комплементарность — CDR (Complementarity determining regions).
V-домены могут быть одинаково передставлены в иммуноглобулинах всех классов. По строению каркаса выделяют 3 подгруппы Н-цепей, 3 подгруппы к-цепей и 5 подгрупп ^-цепей. Каркасная последовательность V-доменов весьма консервативна. Их гомология внутри подгруппы составляет 85—90%.
В пространственной структуре V-доменов вариабельные последовательности расположены в зоне изгибов полипептидной цепи, направленной навстречу соответствующим участкам V-домена другой цепи (т.е. CDR
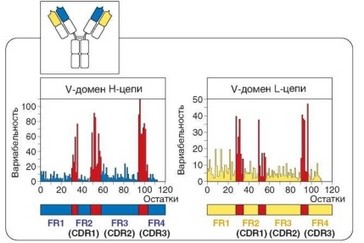
Рис. 3.6. Локализация гипервариабельных участков, определяющих разнообразие антигенсвязывающих участков антител, в V-доменах Н- и L-цепей. На графиках представлено число вариантов аминокислотных остатков, выявленное в каждой позиции V-доменов цепей L и H. В гипервариабельных участках молекул регистрируют значительное превышение уровня вариабельности, по сравнению с остальной частью молекул (по Kabat E.A. et al, 1977)
H- и L-цепей направлены навстречу друг другу). В результате формируется гидрофильный канал, образующий антигенсвязывающий участок (активный центр) иммуноглобулинов. Он представляет собой полость длиной 6 нм и шириной 1,2—1,5 нм (по данным электронной микроскопии). Площадь поверхности, предназначенной для контакта с антигеном, составляет 7,2 нм2. Пространственная структура этой полости, обусловленная строением гипервариабельных участков, определяет специфичность антител, т.е. их способность распознавать и связывать конкретные молекулы на основе пространственного соответствия. Сверхвысокая вариабельность CDR и активных центров обеспечивает уникальность молекул иммуноглобулинов, синтезируемых В-лимфоцитами одного клона, не только по структуре, но и по способности связывать различные антигены.
В формирование активного центра вносят вклад пространственно разделенные участки Н- и L-цепей. Гипервариабельные участки V-доменов входят в состав активного центра не полностью — поверхность анти- генсвязывающего участка захватывает только около 30% CDR. Структура активного центра была первоначально установлена методом мечения по сродству, основанным на регистрации места связывания меченых низкомолекулярных лигандов. Позже многие детали структуры активных центров антител и их взаимодействия с антигеном были установлены с помощью рентгеноструктурного анализа кристаллов молекул антител.
Антигенсвязывающая способность V-доменов Н- и L-цепей по отдельности выражена значительно слабее, чем в составе активного центра. Поскольку мономерные иммуноглобулины содержат по две пары Н- и L-цепей, молекула содержит два антигенсвязывающих участка, что наглядно демонстрируется с помощью электронной микроскопии: при связывании антителами бифункционального лиганда образуются видимые кольцевые структуры.
