ИММУНОЛОГИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА В НОРМЕ И ПРИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЯХ
Желудочно-кишечный тракт человека обладает поразительной способностью адаптации по отношению к чрезвычайному разнообразию пищевых продуктов и к различным режимам питания. Имеется сложный комплекс механизмов для регуляции системы пищеварения и функции вегетативной нервной системы, циркулирующих гормонов, локальных нейрональной и эндокринной тканей в стенке кишечника, которые принимают участие в ассоциированном контроле перистальтики, секреции пищеварительных соков, всасывания нутриентов и элиминации пищевых остатков. Существуют также регуляторные механизмы, индуцирующие и подавляющие иммунологические реакции на антигены, попавшие в желудочно-кишечный тракт с продуктами питания.
В настоящее время не представляется возможным отделить функцию пищеварения от иммунологической функции кишечника.
Желудочно-кишечный тракт — важный орган иммунитета. Воздействие антигенов внешней среды делает его существенным компонентом в развитии защитных реакций против патогенных микроорганизмов и многих неорганических веществ. Иммунокомпетентная (лимфоидная) ткань тракта представлена организованными структурами (пейеровы бляшки, аппендикс, миндалины, лимфатические узлы) и отдельными клеточными элементами. Популяция клеток лимфоидной ткани разнородна и состоит из множества групп, подгрупп и клонов клеток с различными функциональными свойствами и специфичностью рецепторов, распознающих антигены. Общее количество клонов лимфоцитов, представляющих собой потомство одной клетки, достигает 107, численность каждого клона может составлять 105 клеток [Gotz Н.,
- . Кишечник является основной зоной, где в естественных условиях происходит сенсибилизация иммуноцитов, которые затем «оккупируют» другие органы и ткани, и служит отправной точкой для циркуляции клеток между различными органами.
Окружающая среда слизистой оболочки кишечника накладывает определенные ограничения на характер и регулирование иммунных реакций, которые происходят в нем. Тогда как большинство клеток нашего организма находятся в стерильном окружении и подвержены воздействию ограниченного количества антигенов, эпителий желудоч-
но-кишечного тракта отделяет ткани макроорганизма от огромного количества живых и неживых антигенов, несущих признаки чужеродной в генетическом отношении информации, при этом большинство из них безвредны, а иногда и полезны для хозяина. Пероральное воздействие антигена обычно создает, с одной стороны, местную «слизистую» IgA-защиту (секреторный иммунитет) и клеточно-опосредо- ванную реакцию, но с другой — и системную толерантность или гипореактивность — подавление последующей выработки антигеноспе- цифических антител классов IgG и IgM и развития клеточно-опосредованного иммунитета [Richman L. К. et al., 1981]. Эта дихотомия зивисит от иммунорегулирующих функций слизистой оболочки лимфоидной ткани. Последняя образует важный лимфоидный орган в организме. Лимфоциты распределяются в значительных количествах в собственной пластинке и в меньших количествах — в эпителии. Собственная пластинка также содержит много изолированных лимфоидных фолликулов, сосредоточенных в основном в пейеро- вых бляшках, аппендиксе и миндалинах. В настоящее время очевидно, что слизистая оболочка лимфоидной ткани имеет уникальную структуру и функционально отличается от общей иммунной системы. В эпителии преобладают Т-лимфоциты, большинство из которых имеет супрессорные — цитотоксические маркеры [Selby V. et al., 1981]. Собственная пластинка содержит гетерогенную группу клеток, в том числе В- и Т-лимфоциты, макрофаги, моноциты и большое число плазматических клеток, секретирующих иммуноглобулины, особенно IgA.
Благодаря исследованиям последних лет стало очевидным, что вход антигенов происходит преимущественно контролируемыми путями через эпителий пейеровых бляшек, количество которых достигает у человека 200 и они большей частью сосредоточены в ileum. В каждой бляшке имеется куполообразный участок, под которым находятся фолликулы с герминативными центрами. В исследованиях на мышах показано, что Т-клетки населяют участки между фолликулами и присутствуют в куполе и эпителии, а В-лимфоциты находятся в герминативных центрах и на куполообразных участках. Пейеровы бляшки лишены афферентных лимфатических сосудов, но эпителиальные М-клетки, лежащие под ними, имеют необычную морфологию: их поверхность покрыта не микроворсинками, а микроскладками, и они находятся в тесной функциональной зависимости от прилегающих лимфоцитов. Особенности этих М-клеток отражают их специализированную способность к бурному пиноцитозу. Материал забирается и пропускается через клетку к «ожидающим» лимфоцитам, которые затем мигрируют, а их место занимают «свежие» лимфоциты. Обнаружено, что лимфоциты пейеровых бляшек не обладают свойствами киллеров; Т-клетки не удается трансформировать в цитотоксичные клетки, независимо от того, применялся антиген перорально или парентерально. Невозможно также индуцировать путем иммунизации in vitro переход В-клеток, являющихся в 80% случаев носителями IgD, в плазмоциты [Kagnoff М. F., 1980]. Неспособность В-клеток пейеровых
Схема 18. Ретикуляция антигениндуцированных лимфоцитов пейеровых бляшек (групповых лимфатических фолликулов) и синтез иммуноглобулинов в слизистой оболочке желудочно-кишечного тракта [Webster A. D. В., 1985].
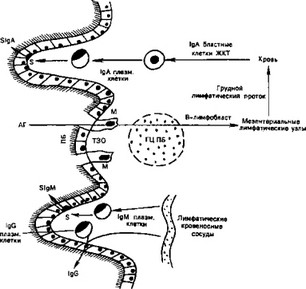
АГ — антиген; ПБ — пейерова бляшка; ТЗО — тимусзависимая область ПБ; ГЦПБ — герминативный центр ПБ; SlgA — секреторный IgA; S — секрет плазматических клеток; М — клетки специального фагоцитоза; ЖКТ — желудочно- кишечный тракт.
бляшек образовывать антитела может быть связана с относительным дефицитом макрофагов. Имеются веские доказательства, что пейеровы бляшки участвуют в «вылавливании» антигенов из просвета кишки, которые могут активизировать лимфоциты, хотя и не индуцируют эффекторцую функцию. Активированные антигенами В-клетки мигрируют из пейеровых бляшек в другие участки, в том числе в собственный слой кишечника, и там действуют как эффекторные клетки, секретируя IgA [Cebra J. J. et al., 1976]. Таким образом, можно предположить, что пейеровы бляшки являются предшественниками для специфических IgA-реакций в собственном слое кишечника, хотя возможно, что разбросанные в его слизистой оболочке лимфоидные фолликулы выполняют такую же функцию (схема 18).
Значение доступа антигенов через слизистую оболочку других участков, кроме пейеровых бляшек, у человека еще не полностью
выяснено, но есть основания полагать, что это наблюдается у незрелых детей и в условиях измененной проницаемости слизистой оболочки. Главная функция желудочно-кишечного тракта — пищеварение — связана с проникновением в энтероцит макромолекул и продуктов внут- риполостного переваривания. Макромолекулы связаны с мембраной микроворсинок и входят в клетку в пузырьках, которые, слипаясь, образуют фаголизосомы. Внутриклеточное переваривание происходит внутри этих структур, тем не менее антигенов оказывается достаточно для индуцирования иммунного воздействия и выделения «без обработки» и осаждения в межклеточных пространствах вследствие обратного пиноцитоза. Установлено, что у недоношенных детей в сыворотке можно обнаружить некоторые недеградированные пищевые протеины и специфические антитела к ним [Roberton D. М. et al., 1982].
Сенсибилизированные антигенами лимфоциты пейеровых бляшек мигрируют в брыжеечные лимфатические узлы, а оттуда по лимфатическим сосудам через грудной проток и систему кровообращения «целеустремленно» направляются к собственному слою кишечника, главным образом в качестве клеток, секретирующих IgA [Tomasi Т. В. J. et al., 1980]. Тот факт, что лимфоциты, ассоциированные с тонкой кишкой, направляются к собственному слою не содержащих антигенов эксплантатов кишечника, указывает на специфичность, «прицель- ность» такой миграции, хотя свойства ответственных за этот эффект рецепторов как лимфоцитов, так и слизистой оболочки пока не определены. На нескольких экспериментальных моделях было показано, что, кроме специфической миграции лимфоцитов и стимулированного антигенами увеличения лимфоидных клонов, наблюдается образование специфических антител в участках слизистой оболочки, отдаленных от очага первичной сенсибилизации. Однако требуется дополнительная информация, чтобы ответить на вопрос, распространяется ли иммунная реакция с одного участка кишечника на другие его отделы. Постоянный обмен между клетками различных лимфоидных органов, связанный с интенсивной рециркуляцией Т-лимфоцитов, обеспечивает функционирование лимфоидной ткани как единого целого и обусловливает генерализацию иммунных реакций организма. Феномен рециркуляции лимфоцитов имеет важное значение в процессах резорбции антигенов в кишечнике и обеспечении локальных факторов защиты [Hopkins J. et al., 1984].
Известно, что IgA преобладает среди иммуноглобулинов во всех секретах и в собственной пластинке кишечника. IgAl и IgA2 часто обнаруживаются в секретах, хотя 90% циркулирующего IgA представляет собой мономерный IgAl [Dobbins W. О., 1982]. IgA секретируется в двумерной форме, в которой a-цепи связаны перемычкой J. J-цепь имеет родственное отношение к синтезируемому и секретируемому эпителиальными клетками гликопротеину. Такое объединение с секреторным компонентом позволяет всему комплексу транспортироваться через эпителиальные клетки кишечной стенки в полость кишки. Молекулы IgM транспортируются аналогичным механизмом. Некото-
ззо
рое количество IgA неизбежно попадает из мезентериальных лимфатических узлов в кишечные лимфатические сосуды, а оттуда — в грудной проток. Двумерные и полимерные его формы быстро захватываются гепатоцитами и экскретируются в желчь.
В настоящее время признано, что у животных гепатобилиарная секреция представляет собой количественно наиболее важный путь, по которому IgA получает доступ в кишечник, где время его появления в двенадцатиперстной кишке совпадает с прохождением пищи из желудка.
В слизистой оболочке есть также клетки, вырабатывающие, иммуноглобулины других классов, но их значительно меньше. Так, соотношения плазматических клеток, продуцирующих IgA, IgM и IgG, 20 : 3 : 1. IgG могут обнаруживаться в полости кишки в результате «пассивной» диффузии. Отметим, что лимфоциты, продуцирующие IgE, особенно часто встречаются на поверхности слизистых оболочек [Halsey J. F. et al., 1980].
Главная функция кишечных антител — иммунное отторжение у поверхности слизистой оболочки. Секреторный IgA удерживается около эпителиальных клеток в результате взаимодействия с цистино- выми остатками в слизи, покрывающей гликокаликс. Он занимает благоприятную позицию, чтобы препятствовать поглощению антигенов пищи путем комплексирования с ними и ускорения их деградации. Как установлено, пероральная иммунизация животных снижает мак- ромолекулярный антигенный, захват и предотвращает связывание токсинов с рецепторами мембран микроворсинок. Двумерная IgA может функционировать как агглютинин, уменьшая прилипание бактерий к энтероцитам. Хотя и полагают, что IgA не способен активировать систему комплемента, бактерицидная деятельность рассматривается вместе с индукцией клеточно-опосредованной цитотоксичности, зависящей от антител [Lowell G. Н. et al., 1980].
За последние два десятилетия в литературе появилось много сообщений о результатах исследований иммуноглобулинов при заболеваниях печени, желчного пузыря, желудка, поджелудочной железы, тонкой и толстой кишок и других органов пищеварения [Логинов А. С. и др., 1986; Martin D. et al., 1984]. Однако детальный анализ и критическое сопоставление данных разных авторов в отношении содержания иммуноглобулинов при заболеваниях органов пищеварения представляются в достаточной степени затруднительными, так как для определения иммуноглобулинов используются различные методические приемы, не всегда учитываются особенности заболевания. Тем не менее определение количественного содержания, физико-химических и биологических свойств иммуноглобулинов при заболеваниях желудочно- кишечного тракта позволяет установить преимущественную «заинтересованность» тех или иных классов иммуноглобулинов, получить представление о функциональном состоянии В-системы иммунитета. Это в свою очередь имеет диагностическое и прогностическое значение, так как динамическое исследование содержания иммуноглобулинов
позволяет в известной степени судить о течении заболевания, его прогрессировании, а также эффективности проводимой терапии.
Клеточный иммунитет кишечника в отличие от системы секретируемых им антител изучен недостаточно. Известно, что после перо- рального воздействия антигенов системные клеточные иммунные реакции выявляются редко. Полагают, что местные клеточно-опосредованные защитные реакции имеют важное значение, хотя место этих реакций в слизистой оболочке кишки остается невыясненным из-за отсутствия удовлетворительных методов количественного определения функций Т-лимфоцитов в лимфоидной ткани кишечника. Исследования на животных показали, что атрофия ворсинок и инфильтрация мастоцитами собственной пластинки кишки тимусзависимы. «Болезнь отторжения» у человека и животных после пересадки аллогенного костного мозга опосредована Т-клетками и по общему признанию вызывает гистопатологические и функциональные изменения в тонкой кишке. У мышей, перорально иммунизированных овальбумином, продукция лимфокинов происходит в мезентериальных лимфатических узлах. Эти исследования позволили сделать вывод, что определенные проявления кишечной патологии — скорость продуцирования клеток в криптах и число Внутриэпителиальных лимфоцитов могут служить в качестве объективных индикаторов повышенной чувствительности замедленного типа в слизистой оболочке кишечника и что тест ингибирования миграции лейкоцитов при исследовании на материале мезентериальных лимфатических узлов также можно использовать для определения клеточного иммунитета лимфоидной ткани кишечника [Mowat A. et al., 1981, 1982]. У взрослых, больных целиакией, показано наличие признаков продуцирования фактора ингибирования миграции макрофагов в условиях органной культуры тонкой кишки при взаимодействии с а-глиадином [Howdle P. D. et al., 1982].
У грызунов изучались и некоторые другие клеточные иммунные функции слизистой оболочки кишечника методом изолированных лимфоцитов. У интраэпителиальных лимфоцитов было продемонстрировано наличие антителозависимой клеточно-опосредованной цитотоксичности, естественной киллерной клеточной активности и клеточноопосредованного лимфолизиса. Было также доказано, что лимфоциты в собственной пластинке кишки пролиферируют под воздействием аллогенных клеток, вызывая клеточно-опосредованный лимфолизис. Показано, что у человека митогениндуцируемая клеточная цитотоксичность имеет место в изолированных колониях внутриэпителиальных лимфоцитов [Chiba М. et al., 1981; Tagliabue A. et al., 1981, 1983; Goodacre R. L. et al., 1982].
Очевидно, когда здоровые люди получают безвредные антигены, в слизистой оболочке кишечника не развиваются реакции клеточного иммунитета. Тем не менее клеточные иммунные реакции слизистой оболочки могут выполнять роль дополнительного фактора при некоторых синдромах мальабсорбции различного генеза. Энтеропатия у больных с ИДС и мальабсорбцией может возникать как следствие
аутоиммунного процесса, так и в результате локального иммунного ответа на паразитарную инвазию, например при лямблиозе. Имеются данные, что клеточный иммунитет слизистой оболочки кишечника на пищевой антиген является наиболее вероятной причиной повреждения кишечника при целиакии, энтеропатии, обусловленной непереносимостью белка коровьего молока, а возможно, и в случае некоторых форм пищевой аллергии. Локальная иммунная реакция на пищу может отягощать мальабсорбцию у некоторых детей с упорной диареей. Ясно, что при таких заболеваниях патогенез в большей мере обусловлен индуцированием клеточного иммунитета, а не возникновением толерантности при поступлении антигена с пищей. Это означает, что по крайней мере теоретически возможно восстановить нормальный иммунологический ответ у больных с пищевой аллергией путем использования специально выработанной иммунотерапии для воздействия на иммунорегулирующие клетки. При этом необходимо иметь в виду тот факт, что многие функции пищеварения остаются нормальными при тяжелых# заболеваниях желудочно-кишечного тракта, сохраняется также большинство иммунологических реакций на пищевые продукты.
Еще в начале века было установлено, что воздействие антигена может привести к состоянию толерантности, т. е. исчезновению системной реакции на антиген. В то время как обычно парентеральная иммунизация вызывает как секреторный, так и системный иммунный ответ, поступление некоторых антигенов с пищей может привести к специфическому состоянию ареактивности или пероральной толерантности. Некоторые типы пероральной иммунизации ведут к депрессии не только определяемой антителами системной реакции, но и снижению контактной чувствительности («феномен Сульцбергера — Чейса»). Механизмы, с помощью которых такая толерантность возникает и поддерживается, полностью не разгаданы. Среди возможных объяснений — циркуляция комплексов антиген — антитело, поглощение антигена печенью, циркуляция сывороточных депрессивных факторов, активация клеток-супрессоров в лимфоидной ткани кишечника. Возможно, что существует не один механизм супрессии или толерантности для обеспечения функции этого жизненно важного защитного гомеостатического процесса, происходящего в кишечнике.
Распределение подклассов лимфоцитов в слизистой оболочке расширило наше понимание механизмов, связанных с регуляцией иммунных реакций, происходящих в кишечнике [Ferguson А., 1983]. Ранние исследования внутриэпителиальных лимфоцитов, расположенных между цилиндрическим эпителием, показали, что их число значительно сокращается у животных, лишенных тимуса. Последующее изучение поверхностных маркеров подтвердило преобладание в эпителии Т-клеток, показывающих супрессорные и цитотоксические признаки. Некоторые межэпителиальные лимфоциты имели также рецепторы для маркеров, обладающих хелперной функцией [Selby W. S. et al., 1981, 1984; Lyscom N. et al., 1982]. Пейеровы бляшки содержат несколько популяций клеток, связанных с иммунорегуляцией. К ним относятся
Т-супрессоры и специфические регуляторные Т-клетки для реакций с участием IgM и IgG (как и в реакциях замедленной гиперсенсибилизации), в то время как в пейеровых бляшках определяем главным образом Т-хелперы для IgA [Richman L. К. et al., 1981; Kawanishi H. et al., 1983]. Концепция контрсупрессорных систем представляет собой еще один возможный механизм, лежащий в основе иммунорегуляции, связанной с окружающей средой на микроуровне. Исследования на мышах показали, что популяция лимфоцитов пейеровых бляшек предотвращает подавление Т-клетками реакций класса иммуноглобулинов на пероральные антигены. Установлено также, что сыворотка от животных, толерантность которых была повышена вследствие перораль- ной иммунизации, придает реципиентам способность к специфической супрессии [Green D. R. et al., 1982]. Последствия этих выводов для человека пока еще не ясны. Однако попытки характеризовать эти факторы как IgA, IgG, иммунные комплексы или антиидиотипные антитела не дали четких результатов.
Обработка антигенов в печени также оказывает влияние на толерантность: попадание антигенов в портальную вену способствует развитию толерантности, чего не происходит в тех случаях, когда кровь из желудочно-кишечного тракта минует печень. Взаимодействие антигенов с печеночными макрофагами, возможно, играет важную роль в индукции супрессорных реакций [Strober W. et al., 1981].
Представляет интерес концепция, согласно которой активная секреторная иммунная реакция у человека одновременно с системной толерантностью может служить механизмом, тормозящим абсорбцию аллергенов и аутоантигенов. При этом системная толерантность рассматривается как защитный механизм против гиперчувствительности и аутоиммунных заболеваний, предупреждающий реакцию на антигены, которые оказались вне иммунного ответа. Это подтверждается тем, что сенсибилизация при атопии возникает в первые годы жизни, когда секреторная иммунная система еще незрелая и контакт аллергенов с лимфоидной тканью осуществляется легче, чем у взрослых. Кроме того, у лиц с дефицитом секреторных IgA отмечается высокая частота аллергических и аутоиммунных заболеваний. Таким образом, последующее изучение пероральной толерантности поможет улучшить методы профилактики некоторых Инфекционных болезней и позволит лучше понять патогенез аллергических и ауитоиммунных поражений. Наличие реакций гиперчувствительности признается в тех случаях, когда в результате иммунологических реакций в желудочно-кишечном тракте возникают повреждения тканей или системные нарушения [Ferguson A.'et al., 1980]. Влияние местной гиперчувствительности на гистопатологические процессы в слизистой оболочке тонкого и толстого кишечника изучалось на различных экспериментальных животных, но существуют и немногочисленные клинические наблюдения, подтверждающие результаты работ, проведенных на животных [Еагп- show P. et al., 1982]. Однако значение этого феномена для организма человека до настоящего времени остается предметом споров. В целом
повышенная чувствительность, обусловленная реакциями класса IgE, не вызывает каких-либо изменений в кишечной гистопатологии, предположения о дегрануляции тучных клеток не нашли подтверждения. При системной анафилаксии изменяется проницаемость сосудов и слизистой оболочки кишечника, пассивная кишечная анафилаксия вызывает отек стромы ворсинок и отделение эпителиальных клеток от базальной мембраны. Однако эффекты могут иметь вариабельный характер и очень вероятно, что воспалительная реакция, сопутствующая такой ситуации, создает благоприятные условия для дальнейшего развития гиперчувствительности других типов с вовлечением комплекса антиген — антитело на поверхности клеток.
Постулировано, что цитотоксическая гиперчувствительность является механизмом, вызывающим повреждение ворсинок. Исследования на кроликах с противокишечными антителами не выявили корреляции с развитием энтеропатии. Однако был описан пациент с органоспецифичными антителами к эпителиальным клеткам, полной атрофией ворсинок и дефицитом IgA [McCarthy D. М. et al., 1978].
Несомненно, что осаждение иммунных комплексов в слизистой оболочке может вызвать ее повреждение. Однако представляется мало вероятным, что у человека местные концентрации антигенов и антител могли бы способствовать образованию комплексов. В целом повышенная чувствительность, обусловленная иммунными комплексами, приводит к инфильтрации тканей нейтрофилами и образованию депозитов без существенных изменений морфологии слизистой оболочки.
Опосредуемые клеточными механизмами реакции гиперчувствительности в слизистой оболочке с трудом поддаются определению. Рассматриваются различные их аспекты в отношении целиакии и энтеропатии вследствие чувствительности к молочному белку.
Регуляция иммунных реакций слизистой оболочки кишечника представляет собой сложный процесс, который может модифицироваться в различных ситуациях, включая наличие или отсутствие повреждения слизистой оболочки, а также такие факторы, как инфекция, адъюванты, зрелость, состояние питания и генетический потенциал индивидуума. Клинически у человека имеются три конкретные ситуации, в которых непереносимость пищевых белков встречается особенно часто: в грудном возрасте, у детей, родители которых страдают атопическими реакциями, и после перенесенного гастроэнтерита. У ребенка, родители которого страдают атопическими реакциями, достоверно чаще развивается пищевая аллергия, чем у детей без этой семейной особенности. Однако на подобную генетическую предрасположенность большое влияние оказывают факторы окружающей среды. Нарушения кишечной проницаемости могут способствовать сенсибилизации, но сами по себе не вызывают иммунологических нарушений. Однако изменения иммунологической реактивности могут возникнуть в результате повреждения слизистой оболочки, хотя, по-видимому, в этих случаях трудно различить первичные и вторичные эффекты [Jackson P. G. et
al., 1981]. Общепризнанно, что у некоторых детей острый гастроэнтерит предшествует непереносимости белка коровьего молока.
У новорожденных иммунологические реакции незрелы. У человека внутриэпителиальные лимфоциты появляются с 11 нед, а пейеровы бляшки на 6—9-м месяце гестации. Концентрации IgA обычно низкие в течение первых нескольких месяцев жизни. Этот временный иммунодефицит считается причиной патогенеза реакций гиперчувствительности в раннем детстве [Stephens S., 1986]. Исследования подклассов Т-лимфоцитов в кишке новорожденных грызунов обнаружили распределение их в эпителии, характерное для незрелых особей, причем первоначальный пик приходился на развитие клеток с маркерами супрессоров цитотоксических лимфоцитов [Lyscom N. et al., 1983]. В течение этого периода развития иммунной системы новорожденные обеспечиваются некоторой защитой за счет материнского молока.
Человеческое молоко содержит множество неспецифических иммунных факторов — макрофаги, лизоцим, лактоферрин и СЗ-, С4-ком- поненты комплемента. В нем присутствуют также стимуляторы иммунитета — интерферон и лейкоцитарный хемотаксический фактор. Специфический иммунитет, обеспечиваемый IgA, включает антитела в молоке, направленные против энтеральных антигенов. Предшественники плазматических IgA клеток, возникающие в пейеровых бляшках, нацеливаются на секреторные островки тканей молочных желез в такой же степени, как и на собственную пластинку. Считается, что желудочно-кишечный тракт новорожденного непроницаем для иммуноглобулинов, но есть основания полагать, что IgA молозива может попадать с сыворотку новорожденного через 18—24 ч после рождения и начала кормления.
Около 50% лимфоцитов, содержащихся в человеческом молозиве, составляют Т-клетки, но во время лактации их количество уменьшается до 20%. Свойства этих клеток — клеточно-опосредованный лимфоли- зис и пролиферативные реакции на растворимые антигены позволяют предположить, что они имеют больше общего с внутриэпителиальны- ми лимфоцитами, чем с периферической лимфоидной системой [Pignata С. et al., 1982]. Соотношение лимфоцитов молозива человека с хелпер- ным и супрессорным фенотипом аналогично таковому соотношению внутриэпителиальных лимфоцитов тонкой кишки и ниже соотношения, отмечаемого в периферической крови [Richie Е. R. et al., 1982]. Значение Т-лимфоцитов в молоке, некоторые из которых берут свое начало в слизистой оболочке лимфоидной ткани, изучено пока мало, но имеются клинические и экспериментальные данные, показывающие, что у человека и животных эти клетки, возможно, пересекают кишечный барьер [Manning L. S. et al., 1980; Seelig L. L. et al., 1981; Pollack M. S. et al., 1982]. Детальные последствия этого феномена остаются неясными, но интересно, что в большинстве исследований отмечалось более низкое число случаев инфекций и аллергических заболеваний у детей, вскармливающихся грудью.
Иммунологические аспекты вскармливания новорожденных очень
сложны. Иммунная система плода, как известно, почти полностью формируется в первые недели его развития, тем не менее она, как правило, в нормальных условиях активно не функционирует до момента рождения в основном вследствие недостаточной антигенной стимуляции. В результате взаимодействия с антигенами, в том числе и пищевыми, происходит развитие иммунологического ответа, сопровождающееся нарастанием уровня иммуноглобулинов. При первом употреблении пищевого продукта содержащиеся в нем антигены обнаруживаются в крови, лишь затем появляются специфические антитела, относящиеся в основном к IgA. Однако такая реакция провоцирует развитие регулирующих иммунный ответ механизмов. Поэтому у взрослых, ранее употреблявших в пищу данный продукт, только незначительное количество пищевого антигена проходит до системного кровотока, большая его часть включается в комплекс с IgA, чего, как правило, не наблюдается у детей раннего возраста [Paganelli R. et al., 1981]. Лица, не употреблявшие ранее в пищу данный продукт, еще только будут приобретать этот защитный механизм, контролирующий иммунное исключение, и поэтому у них наблюдается более полное всасывание. Кроме того, всасывание антигена обеспечивает также частичную толерантность иммунологической системы, проявляющуюся при последующем парентеральном попадании антигена в организм. Эти три ответа на один и тот же антиген, которые происходят одновременно, находятся под генетическим контролем и могут варьировать в определенной степени независимо друг от друга, даже по отношению к одному и тому же антигену. Возможно, толерантность, а также иммунное исключение зависят и от некоторых внешних факторов, таких как питание.
Материнское молоко само по себе, видимо, неантигенно для младенца, но через него могут передаваться антигены тех пищевых продуктов, которые употребляла мать. Эти антигены способны вызвать развитие, например, экземы у уже сенсибилизированного ребенка, а также не исключено, что они сами могут создавать сенсибилизацию [Soothill J. F., 1983].
Непереносимость продукта, для которой имеются доказательства ее иммунологического механизма, является пищевой аллергией, а в том случае, когда доказан неаллергический механизм (например, энзимная недостаточность), патологическое состояние обычно определяется как пищевая идиосинкразия. Если патогенетический механизм остается невыясненным, используется общий термин «непереносимость к продукту питания». В каждом случае патология может протекать с вовлечением только желудочно-кишечного тракта либо с изменениями со стороны многих органов-«мишеней» [Soothill J. F., 1982]. Существует еще термин «ложная пищевая аллергия» для обозначения комплекса патологических проявлений, имитирующих аллергическую реакцию немедленного типа и обусловленных неспецифическим гистаминовым механизмом. Гистамин высвобождается, как известно, под влиянием IgE, но нужно иметь в виду, что возможна прямая гистаминолиберация
без посредничества антител. В это определение укладываются многие типы пищевой непереносимости, представленные одинаковыми симптомами, в том числе и те, при которых в последующем может быть установлено, что причинный фактор не является гистамином, а могут быть вовлечены простагландины и лейкотриены [Moneret Vautrin D. А.,
1983].
Непереносимость к продукту может быть связана с белками, углеводами, жирами, витаминами, а возможно, и другими агентами. Так, при целиакии у больных детей, как правило, наблюдается непереносимость лактозы, степень которой коррелирует с тяжестью поражения слизистой оболочки тонкой кишки. У большинства пациентов при элиминации из питания глютена устраняется и непереносимость лактозы, за исключением случаев конституциональной алактазии. Существуют, кроме того, случаи непереносимости коровьего молока, обусловленные воздействием молочного протеина. Механизм ее развития не установлен. Также неизвестно, может ли белок молока оказывать повреждающее действие на слизистую оболочку тощей кишки у взрослых.
Непереносимость белка коровьего молока наблюдается в основном в раннем детском возрасте как явление временное, исчезающее обычно до 2-летнего возраста. Клинический симптомокомплекс включает в себя диарею, стеаторею, рвоту, потерю массы тела, а в слизистой оболочке тощей кишки развиваются изменения, напоминающие случаи нелеченой целиакии, хотя и не столь выраженные. Могут наблюдаться' и сходные иммунологические нарушения, такие как повышение уровня сывороточного IgA, а также увеличение в слизистой оболочке кишечника числа плазмоцитов, продуцирующих IgA, IgM, IgE. Кроме того, выявлено, что. некоторые из этих плазматических клеток содержат антитела класса IgA и IgE к Р-лактоглобулину или к бычьему сывороточному альбумину [Pearson J. R. et al., 1983]. Наряду с увеличением числа внутриэпителиальных лимфоцитов, наличием эозинофильных инфильтратов и дегранулированных мастоцитов в тканях обнаруживаются преципитины и возникает вопрос, к какому типу аллергии (I и/или III, или даже IV) можно отнести наблюдаемые реакции и можно ли связать атрофию ворсинок с активностью Т-лимфоцитов. Все типы аллергических реакций иногда присутствуют одновременно, осложняя анализ «конечных» воспалительных изменений. Патологические изменения подвергаются обратному развитию при исключении молока из питания. Сходство характера гистопатологических повреждений при непереносимости белка коровьего молока и целиакии позволило предположить о родстве механизмов развития обеих патологий, однако при интолерантности молочного протеина наблюдается некоторая эффективность кромолина-натрия, чего не отмечают при глютеновой энтеропатии [Pepys J., 1982].
При целиакии обнаружено много иммунологических нарушений, что послужило основанием для предположения об иммунологическом генезе этого заболевания. Однако возможно, что многие из обнару
женных иммунологических отклонений являются только лишь реакцией на глютен, а также и на другие антигены, которые проникли через барьер слизистой оболочки, повышая напряжение иммунологической системы [Jackson P. G. et al., 1981]. Не существует данных, которые свидетельствовали бы о том, что повреждение слизистой оболочки возникает посредством иммунологического механизма, хотя не исключено, что он является причиной необратимости процесса повреждения [Cooke W. Т. et al., 1983]. Не имеет объяснения и первичный аффект слизистых, хотя не исключается, что этот процесс и не связан с иммунологическими реакциями. Имеются серьезные основания предполагать, что важную, возможно, и основную роль в развитии целиакии имеют конституциональные факторы. На фоне конституциональной предрасположенности многочисленные провоцирующие воздействия в комплексе или каждое в отдельности могут запускать механизм, который ведет к повреждению слизистой оболочки, особенно в недостаточно зрелом кишечнике. Несомненно, что связывание глютена с поверхностью энтероцитов и последующие иммунологические реакции являются важным моментом в развитии характерных для целиакии изменений слизистой оболочки. Гипотеза «отсутствия пептидазы» оказалась несостоятельной, хотя до настоящего времени она имеет сторонников, также не идентифицировано специфическое токсичное вещество, содержащееся в глютене. Наконец, остается без ответа вопрос, почему только ограниченное число людей заболевают целиакией, несмотря на то, что глютенсодержащие продукты употребляет все человечество.
Итак, иммунологическая теория объясняет целиакию как проявление гиперчувствительности к глютену [Levenson S. D. et al., 1985]. Предполагают, что в начале заболевания глютен связывается со специфическими рецепторами эпителиоцитов, детерминированных генами главного комплекса гистосовмесгимости HLA-B1 и HLA-B8 [Falchuck Z. М. et al., 1980]. Однако доказывается необходимость для развития гиперчувствительности к глютену носительства еще и DR-антигенов —‘ DR2, DR3, DR4 [Ellis A. et al., 1984]. В зоне наибольшего повреждения слизистой оболочки тонкой кишки было обнаружено скопление DR- подобных антигенов. «Привязывание» развития целиакии к определенным генам гистосовместимости окончательно разрешило бы вопрос о генетической предрасположенности к заболеванию, что в настоящее время еще требует доказательств. При рассмотрении клеточной реакции со стороны слизистой оболочки тонкой кишки на действие глютена было отмечено активное вовлечение лимфоидной ткани кишечника в этот процесс — увеличение в собственной пластинке слизистой оболочки числа лимфоидных и плазматических клеток, вырабатывающих антиглиадиновые антитела 3 классов иммуноглобулинов — A, G, М. Увеличения содержания IgE не наблюдалось [Gerf-Bensussan N. et al., 1985; Leigh R. L. et al., 1985]. Попытки определить специфическую фракцию глиадина, которая может вызвать образование антител, остаются пока безуспешными [Rawcliffe Р. М. et al., 1985]. Так, 'в сыво
ротке крови и кишечном содержимом больных целиакией обнаружены