Анемии этой труппы обусловлены недостаточной или аномальной утилизацией внутриклеточного железа при синтезе гемоглобина, несмотря на нормальное или даже повышенное содержание железа в митохондриях эритрокариоцитов. Такие дефекты могут быть связаны с наследственными нарушениями, главным образом при синтезе порфиринов, или с приобретенным характером поражения, например в результате отравления свинцом или недостаточности витамина В6. Отличительным признаком этого типа анемий является насыщение организма железом, в связи с чем ранее использовался термин «сидероахрестические», т. е. железонасыщенные анемии.
Обмен порфиринов
Порфирины - органические вещества, в основе которых лежит тетрапир- рольное кольцо с четырьмя пиррольными кольцами или ядрами, соединенными между собой метановыми мостиками или связями (=СН—) (рис. 43).
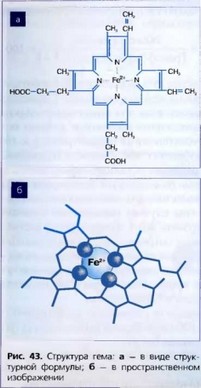 Порфирины широко распространены в природе в виде комплексов с ионами железа - НЬ и Mb, входят в состав ферментов (каталазы, ок- сидазы, цитохромоксидазы и др.). Порфирины синтезируются во всех клетках организма, но основная масса - в эритроидных клетках костного мозга. На основе порфиринов в эритробластах костного мозга синтезируется гемоглобин. Синтез порфиринов происходит также в клетках печени, они используются для образования окислительно-восстановительных ферментов (каталазы, цитохромов, пероксидазы).
Порфирины широко распространены в природе в виде комплексов с ионами железа - НЬ и Mb, входят в состав ферментов (каталазы, ок- сидазы, цитохромоксидазы и др.). Порфирины синтезируются во всех клетках организма, но основная масса - в эритроидных клетках костного мозга. На основе порфиринов в эритробластах костного мозга синтезируется гемоглобин. Синтез порфиринов происходит также в клетках печени, они используются для образования окислительно-восстановительных ферментов (каталазы, цитохромов, пероксидазы).
Синтез гема начинается в митохондриях с присоединения сук- цинил-кофермента-А (СоА) к глицину, в результате чего образуется 8-аминолевулиновая кислота (АЛК). Этот процесс идет с участием фермента АЛК-синтетазы, в качестве кофермента которого выступает пи- ридоксаль-5-фосфат (производное витамина В6). Активность фермента может быть угнетена химическими веществами, в частности свинцом,
алкоголем, снижена глюкозой или гемом. Считается, чтоАЛК-синтетаза ограничивает скорость биосинтеза гема в печени. При конденсации двух молекул 6-АЛ К образуется порфобилиноген (ПБГ). Эта реакция катализируется дегидразой АЛК, активность которой снижается под действием свинца и гемина При конденсации четырех молекул ПБГ синтезируется уропорфириноген (УРО). В этом процессе участвуют 2 фермента: уропорфириноген-Ш-синтетаза и порфобшиноген-де- заминаза. Из УРО образуется копропорфириноген III, синтез которого катализируется ферментом УРО-декарбоксшазой. Копропорфириноген III под действием копропорфириноген Ш-оксидазы превращается в протопорфириноген IX. Следующий этап биосинтеза гема - преобразование протопорфириногена IX в протопорфирин IX - осуществляется ферментом протопорфириногеноксида- зой. Заканчивается синтез порфиринов включением двухвалентного железа в протопорфирин IX. Процесс катализируется митохондриальным ферментом феррохелатазой (гемсинтетаза), в результате чего образуется гем.
Гем одинаков для всех видов гемоглобина, последние различаются между собой структурой глобина. Гем крайне неустойчив и легко превращается в гематин с окислением Fe2+ в Fe31 и присоединением к последнему ОН . Он также легко превращается в гемин, который вместо ОН содержит хлор. Гем обладает способностью вступать в обратимую комбинацию с кислородом. При связывании кислорода железо должно быть в активной 2-валентной форме. Основные этапы синтеза гема показаны на рис. 44. Каждый этап контролируется специфическим ферментом.
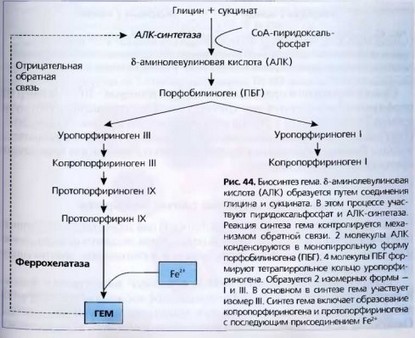
связи, где конечный продукт гем регулирует синтез АЛК на уровне транскрипции и трансляции. Основная часть порфиринов, синтезированных в костном мозге, идет для образования гемоглобина.
В результате дефицита одного из ферментов синтеза гема развивается порфирия. При порфирии из-за нарушения синтеза гема снимается механизм обратной связи, прекращается ингибирование скорость-лимитирующего фермента АЛК-синтетазы, поэтому при легких формах порфирии удается поддерживать адекватный синтез гема (анемия не развивается), а происходит накопление промежуточных продуктов. АЛК, ПБГ и уропорфириноген водорастворимы, поэтому при накоплении экскретируются с мочой (рис. 45), при этом моча приобретает розовый или красный оттенок. Копропорфирин и протопорфирин нерастворимы в воде, они экскретируются с желчью и определяются в кале.
Отрицательная обратная связь
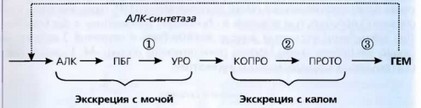
Рис. 45. Наиболее часто встречающийся дефицит или частичное снижение активности определенных ферментов синтеза гема, являющиеся причиной развития: ® - острой перемежающейся порфирии, © — наследственной копропорфирин, ® — вариегатной (пестрой) порфирии. Эритропоэтическая порфирия может возникнуть при дефектах на уровне ® и ©
Синтез порфиринов происходит в виде двух изомеров - III и I. Изомер III порфиринов используется для синтеза гема. При нарушении этого пути изомер I синтезируется в большем количестве, чем в норме. Эритроциты, содержащие гемоглобин с изомером I, имеют меньшую продолжительность жизни и быстро разрушаются в селезенке (болезнь Гюнтера, или врожденная эритропоэтическая порфирия).
Обмен порфиринов
Порфирины - органические вещества, в основе которых лежит тетрапир- рольное кольцо с четырьмя пиррольными кольцами или ядрами, соединенными между собой метановыми мостиками или связями (=СН—) (рис. 43).
 Порфирины широко распространены в природе в виде комплексов с ионами железа - НЬ и Mb, входят в состав ферментов (каталазы, ок- сидазы, цитохромоксидазы и др.). Порфирины синтезируются во всех клетках организма, но основная масса - в эритроидных клетках костного мозга. На основе порфиринов в эритробластах костного мозга синтезируется гемоглобин. Синтез порфиринов происходит также в клетках печени, они используются для образования окислительно-восстановительных ферментов (каталазы, цитохромов, пероксидазы).
Порфирины широко распространены в природе в виде комплексов с ионами железа - НЬ и Mb, входят в состав ферментов (каталазы, ок- сидазы, цитохромоксидазы и др.). Порфирины синтезируются во всех клетках организма, но основная масса - в эритроидных клетках костного мозга. На основе порфиринов в эритробластах костного мозга синтезируется гемоглобин. Синтез порфиринов происходит также в клетках печени, они используются для образования окислительно-восстановительных ферментов (каталазы, цитохромов, пероксидазы).
Синтез гема начинается в митохондриях с присоединения сук- цинил-кофермента-А (СоА) к глицину, в результате чего образуется 8-аминолевулиновая кислота (АЛК). Этот процесс идет с участием фермента АЛК-синтетазы, в качестве кофермента которого выступает пи- ридоксаль-5-фосфат (производное витамина В6). Активность фермента может быть угнетена химическими веществами, в частности свинцом,
алкоголем, снижена глюкозой или гемом. Считается, чтоАЛК-синтетаза ограничивает скорость биосинтеза гема в печени. При конденсации двух молекул 6-АЛ К образуется порфобилиноген (ПБГ). Эта реакция катализируется дегидразой АЛК, активность которой снижается под действием свинца и гемина При конденсации четырех молекул ПБГ синтезируется уропорфириноген (УРО). В этом процессе участвуют 2 фермента: уропорфириноген-Ш-синтетаза и порфобшиноген-де- заминаза. Из УРО образуется копропорфириноген III, синтез которого катализируется ферментом УРО-декарбоксшазой. Копропорфириноген III под действием копропорфириноген Ш-оксидазы превращается в протопорфириноген IX. Следующий этап биосинтеза гема - преобразование протопорфириногена IX в протопорфирин IX - осуществляется ферментом протопорфириногеноксида- зой. Заканчивается синтез порфиринов включением двухвалентного железа в протопорфирин IX. Процесс катализируется митохондриальным ферментом феррохелатазой (гемсинтетаза), в результате чего образуется гем.
Гем одинаков для всех видов гемоглобина, последние различаются между собой структурой глобина. Гем крайне неустойчив и легко превращается в гематин с окислением Fe2+ в Fe31 и присоединением к последнему ОН . Он также легко превращается в гемин, который вместо ОН содержит хлор. Гем обладает способностью вступать в обратимую комбинацию с кислородом. При связывании кислорода железо должно быть в активной 2-валентной форме. Основные этапы синтеза гема показаны на рис. 44. Каждый этап контролируется специфическим ферментом.

связи, где конечный продукт гем регулирует синтез АЛК на уровне транскрипции и трансляции. Основная часть порфиринов, синтезированных в костном мозге, идет для образования гемоглобина.
В результате дефицита одного из ферментов синтеза гема развивается порфирия. При порфирии из-за нарушения синтеза гема снимается механизм обратной связи, прекращается ингибирование скорость-лимитирующего фермента АЛК-синтетазы, поэтому при легких формах порфирии удается поддерживать адекватный синтез гема (анемия не развивается), а происходит накопление промежуточных продуктов. АЛК, ПБГ и уропорфириноген водорастворимы, поэтому при накоплении экскретируются с мочой (рис. 45), при этом моча приобретает розовый или красный оттенок. Копропорфирин и протопорфирин нерастворимы в воде, они экскретируются с желчью и определяются в кале.
Отрицательная обратная связь

Рис. 45. Наиболее часто встречающийся дефицит или частичное снижение активности определенных ферментов синтеза гема, являющиеся причиной развития: ® - острой перемежающейся порфирии, © — наследственной копропорфирин, ® — вариегатной (пестрой) порфирии. Эритропоэтическая порфирия может возникнуть при дефектах на уровне ® и ©
Синтез порфиринов происходит в виде двух изомеров - III и I. Изомер III порфиринов используется для синтеза гема. При нарушении этого пути изомер I синтезируется в большем количестве, чем в норме. Эритроциты, содержащие гемоглобин с изомером I, имеют меньшую продолжительность жизни и быстро разрушаются в селезенке (болезнь Гюнтера, или врожденная эритропоэтическая порфирия).
